甘氨酸对H2O2诱导氧化应激的小鼠胚胎抗氧化能力的影响
周 晶,柳海星,李钟淑,方南洙
(延边大学农学院,吉林延边 133000)
活性氧(Reactive Oxygen Species,ROS)是指在动物机体内由氧构成且活性高的一类化合物的总称,其中最主要含氧自由基为超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(OH)[1]。H2O2是最常见的ROS物质,它在生物体内的来源主要是O2-的歧化反应。生理水平的ROS在生物体的各种信号反应中充当信使,如细胞增殖、分化和内源基因的表达等[2]。然而,当ROS生成量超过机体调控指标时,就会使细胞中蛋白质、脂质和DNA等大分子过度氧化,进一步威胁到生物体内各种生理生化反应的进行。
胚胎在母体发育过程中,因受到氧化-还原机制的保护[3],几乎不出现发育阻滞现象。一旦离开妊娠母体,胚胎的有氧代谢就会加强,同时又缺乏体内抗氧化酶的中和,细胞的氧化-还原系统会发生紊乱,这些扰乱胚胎正常发育的氧化现象统称为氧化应激(Oxidative Stress,OS)[4]。Nrf2信号通路是细胞抵御OS的重要防御机制,其调控的下游抗氧化酶在细胞防御中发挥重要作用[5]。Nrf2通路主要包括过氧化氢酶(CAT)和超氧化物歧化酶(SOD)等抗氧化基因[6]。同时,Nrf2因子被认为是防止细胞或组织受ROS影响而引起损伤的一个关键的防护因子,如高浓度的ROS诱发细胞核内Nrf2的积累以及Nrf2通路的激活,从而提高细胞内部抗氧化酶的活性以达到全面清除ROS的效果[7]。
甘氨酸(Glycine,Gly)是一种抗氧化剂,具有抗炎、免疫调节和细胞保护等作用[8-9]。Gly可在细胞、器官和整体水平上杜绝有害物质对细胞造成损伤[10],包括ROS的氧化作用。有实验表明,培养液中添加抗氧化剂能有效克服胚胎发育阻滞[11]。但是,Gly对氧化应激小鼠胚胎的作用及机理未被阐明,对此,本实验在细胞和分子水平上研究Gly对小鼠胚胎抗氧化能力的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 实验动物为健康且性成熟的昆明系雌性小白鼠,购自延边大学实验动物中心。小鼠均饲养在24℃环境中,光照周期为12 h(08:00—20:00),黑暗周期为12 h(20:00—08:00)。
1.1.2 实验试剂 孕马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)购买于宁波激素有限公司;Gly(货号:ST085)购买于碧云天公司;Qiagen RNeasy Mini Kit试剂盒购买于德国QIAGEN公司;PrimeScript™ RT Master Mix试剂盒购买于大连宝生物工程有限公司;2×Taq PCR Master Mix购买于天根生化科技有限公司;其他相关药品非特殊说明均购自Sigma公司。
1.2 实验方法
1.2.1 超数排卵 实验采用PMSG-hCG法对小鼠进行超数排卵处理,即将挑选健康、6~8周龄的雌性小鼠于第1天腹腔注射10 IU PMSG,48 h后再腹腔注射10 IU hCG,然后与成年公鼠进行1对1合笼交配,合笼15 h后检查阴道栓。
1.2.2 胚胎的收集及培养 在注射hCG 20~22 h,采用脱颈法处死见栓母鼠,在无菌条件下取出胚胎并放入透明质酸酶中脱去卵丘颗粒细胞。4 min后用M16培养液清洗3遍,然后转移到相应培养小滴中,在饱和湿度、5% CO2气相条件、37℃的培养箱中培养、孵育。
1.2.3 Gly浓度的筛选 1-cell胚胎于0、1、4、7、10 mmol/L Gly培养液中孵育,分别在24、48、96 h观察胚胎的发育情况并记录下卵裂率、4-cell和囊胚的发育率,以筛选出利于胚胎发育的最佳Gly浓度。
1.2.4 胚胎氧化应激模型的建立 胡德宝等[12]研究表明,H2O2引起OS的有效致死浓度为25 μmol/L。因此,本实验采用25 μmol/L H2O2建立氧化应激模型。将收集的胚胎置于25 μmol/L的H2O2中孵育30 min后,分别在M16培养液和最佳浓度Gly的培养液中进行培养,未经H2O2处理的胚胎作为对照组。
1.2.5 胚胎内部ROS水平的检测 囊胚期胚胎置于
1 mg/mL PVA小滴中洗涤3遍,然后避光置于10 μmol/L的DCHFDA染色液微滴中在培养箱内染色15 min;将染色后的囊胚用PVA清洗3遍,再分别放入一小滴M16中,于荧光显微镜下进行波长为535 nm的蓝色荧光激发,显色2 min后拍照。用Image J 1.49对荧光图片量化分析,结果用平均荧光强度相对值表示。实验重复5次。
1.2.6 总RNA提取及cDNA合成 培养 96 h后收集囊胚期胚胎17个(置于-80℃储存),胚胎总RNA提取根据Qiagen RNeasy Mini Kit试剂盒用法说明进行操作。总RNA提取后,根据PrimeScript™ RT Master Mix试剂盒用法说明进行反转录,合成的cDNA保存在-20℃备用。
1.2.7 巢式 PCR 应用 2×Taq PCR MasterMix 进行 12.5 μL体系的巢式PCR反应。反应体系:模板2 μL,5 μmol/L上、下 游引物(表 1)各 1 μL,2×Taq PCR Master Mix 6.5 μL,ddH2O22 μL。反应程序:第1次PCR 95℃预变性3 min;95℃变性30 s,59℃退火30 s,72℃聚合30 s,共进行30个循环;最后72℃延伸5 min。第2次PCR 95℃ 预变性 3 min;95℃ 变性 30 s,57℃ 退火 30 s,72℃聚合30 s,共进行35个循环;最后72℃延伸5 min。5 μL的PCR产物应用于1%琼脂糖凝胶电泳,随后用LANE 1D Analysis Software进行IOD值分析。1.3统计分析 每组数据至少重复3~5次。数据应用SPSS 17.0一般线性模型的单因素方差分析进行差异显著性分析,结果用平均值±标准误表示,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05为差异不显著。

表1 引物序列
2 结 果
2.1 不同浓度Gly对小鼠胚胎发育的影响 从表2可知,各组间的卵裂率无显著性差异(P>0.05);4 mmol/L Gly处理组4-cell发育率显著高于10 mmol/L处理组(P<0.05),与其他各组无显著性差异(P>0.05);4 mmol/L Gly处理组囊胚发育率显著高于其他组(P<0.05),其余各组间无显著性差异(P>0.05)。由此可见,4 mmol/L Gly能有效提高胚胎发育率。
2.2 Gly对氧化应激小鼠胚胎的影响 从表3可知,H2O2+Gly处理组的4-cell发育率极显著高于H2O2组(P<0.01),其囊胚的发育水平显著高于H2O2组(P<0.05);各处理组的卵裂率无显著性差异(P>0.05)。2.3 Gly对囊胚期胚胎ROS水平的影响 如图1所示,对照组和H2O2+Gly处理组ROS荧光强度分别极显著(P<0.01)和显著(P<0.05)低于H2O2处理组,而对照组与H2O2+Gly处理组没有显著性差异(P>0.05)。2.4 Gly对胚胎内源性抗氧化酶表达的影响 由图2可知,Gly能显著提高CAT(P<0.05)和SOD1(P<0.01)基因的表达水平,但对SOD2基因的表达无影响(P>0.05)。
3 讨 论
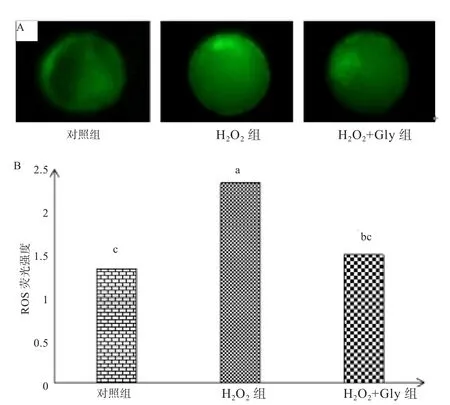
图1 囊胚ROS荧光染色图(A)及其定量分析图(B)
临床研究表明,补充Gly可以潜在地改善健康指标、协助控制代谢和预防各种疾病的发生[13]。高浓度Gly能帮助胚胎克服渗透压,进而有利于胚胎在体外的发育[14]。然而,本研究发现,对于小鼠胚胎来说,4 mmol/L Gly才能有效提高其在体外培养中的发育率。氨基酸作为一种渗透物时具有抗氧化作用,通过降低渗透压来保护分裂阶段的胚胎免受ROS损伤,并改善植入前小鼠胚胎的发育[15]。但本实验结果表明,4 mmol/L Gly处理不能显著提高4-cell发育率,而只对囊胚发育率有显著性影响。因此证明,4 mmol/L Gly对小鼠胚胎的抗氧化作用主要体现在囊胚时期。相关实验表明,Gly的抗氧化作用需要其他物质的协同才能更有效,如Tomomi等[16]研究发现,葡萄糖和Gly协同作用可提高猪囊胚在体外的发育率,胚胎的孵化数量较不添加或只添加Gly时显著增加。本实验中M16培养液只含有葡萄糖成分,Gly+H2O2处理组的小鼠胚胎4-cell发育率和囊胚发育率显著高于H2O2处理组,这与上述研究结果一致。

表2 Gly对小鼠合子期胚胎发育的影响

表3 Gly对氧化应激小鼠胚胎的影响
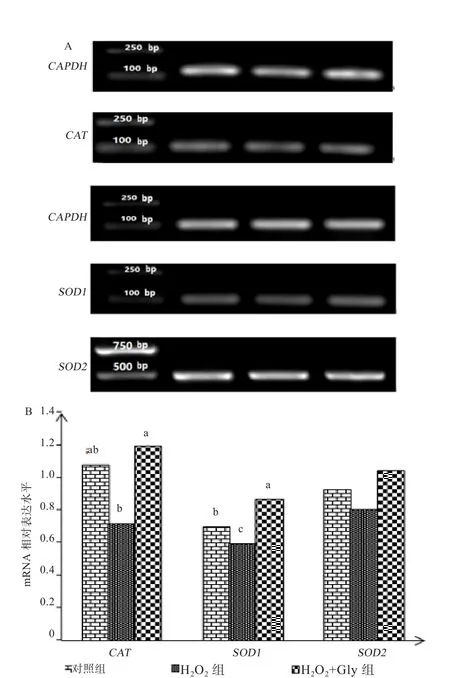
图2 囊胚期胚胎抗氧化酶基因表达的PCR图(A)及其定量分析图(B)
实际上,胚胎在体外的生存环境很难与体内环境相同,同时胚胎的抗氧化能力也有一定限度,所以减少胚胎受到的OS十分关键。机体的OS反应多是由于体内ROS水平升高而造成的,而H2O2是引起ROS水平上升的主要自由基之一[17]。本实验在H2O2诱导氧化应激的基础上,发现Gly能明显阻止H2O2导致的细胞内ROS水平升高,并改善小鼠胚胎发育到囊胚阶段的阻滞现象,这进一步证明了Gly可减缓胚胎在体外发育时受到OS。
胚胎内的ROS水平是由机体氧化-还原平衡和CAT、SOD等抗氧化酶来一起调控的[18]。当胚胎自身受到OS时,会激活Nrf2抗氧化通路。其中,Nrf2是细胞防御OS反应的关键因子,其在保护细胞免受氧化和亲电子应激中起重要作用[19]。在生理条件下,Nrf2处于细胞质中,逐渐被蛋白酶体等降解,只有当ROS激增即受到OS时,Nrf2的降解才被停止并转运到细胞核内。在核内,Nrf2会调节启动子区域的抗氧化基因转录并表达。例如,斑马鱼胚胎内ROS剧增时,会引起Nrf2活动的启停,过程中伴随一系列抗氧化酶活性增强[20]。本实验中,Gly能显著上调CAT和SOD1抗氧化基因的表达,但是对SOD2基因的表达无影响。由此得知,Gly可能通过上述Nrf2机制来提高小鼠胚胎的抗氧化能力。
以上实验结果证实了Gly能够有效地清除胚胎发育过程中产生的过量ROS,进一步推断Gly对小鼠胚胎体外发育具有抗氧化作用。

