自动乳腺全容积成像结合超声乳腺影像报告和数据系统分类诊断常规超声征象不典型的乳腺癌
李可基,龚业琼,申俊玲,吴晓莉,戴 兴,赖 萍
(攀枝花市中心医院超声科,四川 攀枝花 617067)
目前临床常用的乳腺超声检查对大部分恶性征象典型的乳腺癌具有较高诊断价值[1],但一些病灶较小或超声征象不典型的早期乳腺癌易被常规超声诊断为乳腺影像报告和数据系统(breast imaging reporting and data system, BI-RADS)分类3类及4A类而造成漏诊或误诊,且临床对此类肿块的处理多以随访观察为主,易延误治疗时机。自动乳腺全容积成像(automated breast volume scanner, ABVS)对鉴别乳腺肿块良恶性具有重要价值[2]。本研究将ABVS冠状位图像信息作为调整BI-RADS分类的参考因素,分析ABVS结合BI-RADS分类对常规超声恶性征象不典型乳腺癌的诊断价值。
1 资料与方法
1.1 一般资料 收集2015年7月—2017年10月经我院常规超声BI-RADS分类为3类及4A类的乳腺肿块患者832例(共876个乳腺肿块),均为女性,年龄 15~78岁,平均(37.0±13.6)岁;均于我院接受乳腺肿块切除术,术前均于常规超声扫查后接受ABVS扫查,术后均获病理结果。
1.2 仪器与方法
1.2.1 常规超声 采用Hitachi Hi Vision AVIUS彩色超声诊断仪,L74M浅表探头,频率 5~13 MHz。嘱患者仰卧,充分暴露乳腺。常规扫查乳腺,发现乳腺肿块后观察肿块形态、大小、内部回声、有无钙化、血流情况,并行弹性成像获取肿块的弹性评分。
1.2.2 ABVS 采用Siemens S2000彩色超声诊断仪,配备乳腺自动容积成像系统,14L5BV探头,频率 5~14 MHz。扫查时将容积探头与乳腺表面贴合,行内侧位、外侧位及前后位扫查。
1.3 图像分析 将常规超声及ABVS图像数据均传至东软PACS图文报告系统(版本5.0)。由2名超声医师分别独立分析图像,其中1名医师对常规超声图像进行BI-RADS分类,另1名医师结合ABVS冠状位图像特点对常规超声BI-RADS分类做出适当调整。调整方案:①如ABVS发现肿块周围呈典型“火山口”征[3],则修正BI-RADS分类为4C类;②如ABVS发现肿块边缘不局限(出现模糊、成角、细分叶或毛刺),则将常规超声BI-RADS分类上调一级,如肿块边缘局限则维持原分类不变。
1.4 统计学分析 采用SPSS 17.0统计分析软件。采用χ2检验比较常规超声BI-RADS分类为3类、4A类肿块与结合ABVS冠状位图像特点调整后为3类、4A类肿块中病理证实为恶性者所占比例的差异。将BI-RADS分类≥4B类肿块诊断为恶性,以术后病理结果为金标准,采用四格表法计算ABVS结合BI-RADS分类诊断乳腺恶性肿块的敏感度、特异度及准确率。P<0.05为差异有统计学意义。
2 结果
876个乳腺肿块,经术后病理证实为恶性肿块59个,包括浸润性导管癌23个、浸润性小叶癌16个、导管原位癌8个、小叶原位癌5个、黏液癌4个、淋巴瘤1个、恶性叶状肿瘤2个;良性肿块817个,包括纤维腺瘤497个、导管内乳头状瘤16个、良性叶状肿瘤9个、乳腺增生症291个、硬化性腺病4个。
876个乳腺肿块中,常规超声BI-RADS分类为3类558个,其中24个肿块病理证实为恶性,恶性率4.30%(24/558);4A类318个,其中35个肿块病理证实为恶性,恶性率11.01%(35/318)。
结合ABVS冠状位图像特点调整后,BI-RADS分类为3类肿块455个,其中恶性肿块3个,恶性率0.66%(3/455);4A类肿块176个,其中恶性肿块8个,恶性率4.55%(8/176);4B类肿块218个,其中恶性肿块31个,恶性率14.22%(31/218);4C类肿块27个,其中恶性肿块17个,恶性率62.96%(17/27)。

图1 患者女,39岁,右侧乳腺浸润性导管癌 A.常规超声仅见右侧乳腺12点钟方向形态稍不规则的弱回声肿块,周边并未出现典型“蟹足样”征象,常规超声BI-RADS分类为3类; B.ABVS冠状位图像显示右侧乳腺12点钟方向弱回声肿块周边出现数条毛刺,呈典型“火山口”征,将BI-RADS分类调整为4C类
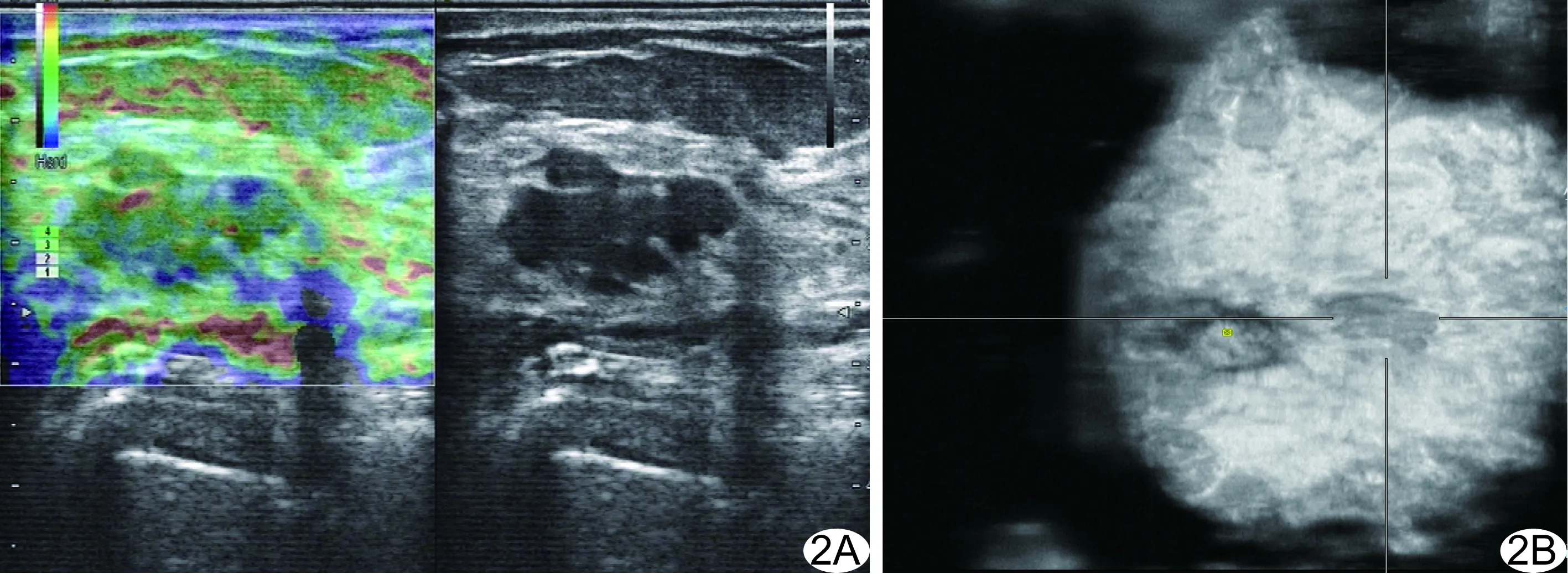
图2 患者女,53岁,左侧乳腺纤维腺瘤 A.常规超声可见左侧乳腺3点钟方向形态不规则的弱回声肿块,边界欠清,常规超声BI-RADS分类为4A类; B.ABVS冠状位图像显示左侧乳腺3点钟方向一弱回声,肿块形态欠规则,边缘光整,周边呈浅分叶状,未见明显毛刺及纠结征象,将BI-RADS分类调整为3类
ABVS发现27个肿块(常规超声BI-RADS分类3类15个,4A类12个)ABVS冠状面图像肿块边缘出现多条毛刺状弱回声,放射状向周围生长,呈典型“火山口”征,将BI-RADS分类上升为4C类(图1),病理证实其中17个肿块为恶性,包括导管内原位癌8个、小叶原位癌5个、浸润性导管癌4个。17个恶性肿块中,14个肿块直径<1.0 cm,最小者仅0.4 cm。 33个常规超声分为4A类的肿块ABVS冠状面图像肿块边缘光整,周边略成大分叶状,未见明显毛刺及纠结征象,将BI-RADS分类降为3类(图2),术后病理证实均为良性。
结合ABVS冠状位图像特点进行调整后,BI-RADS分类为3类、4A类肿块的恶性率明显低于常规超声BI-RADS分类为3类、4A类肿块(χ2=11.447、5.951,P=0.001、0.015)。ABVS结合BI-RADS分类诊断恶性肿块的敏感度为81.36%(48/59)、75.89%(620/817)及76.26%(668/876)。
3 讨论
2013版BI-RADS分类(2013-V5,2ndUS/MRI)[4]中细化了对于4类病变的诊断标准,并给出了对每类病变的处理意见。对于常规超声BI-RADS分类为3类及4A类的乳腺肿块,因其恶性率低,临床处理以观察、复诊为主[4]。本研究对此类肿块患者进一步行ABVS扫查,基于ABVS冠状位图像观察肿块的边缘情况,对常规超声BI-RADS进行调整,以提高BI-RADS分类鉴别乳腺良恶性肿块的效能[5]。
本研究结果显示,常规超声BI-RADS分类为3类的558个肿块中,24个为恶性,分类为4A类的318个肿块中35个为恶性;结合ABVS冠状位图像特点重新新分类后,BI-RADS分类为3类肿块455个,其中恶性肿块3个,4A类肿块176个,其中恶性肿块8个,经调整后BI-RADS分类为3类、4A类肿块中恶性率明显减低(χ2=11.447、5.951,P=0.001、0.015),提示ABVS结合BI-RADS分类诊断结果与术后病理结果更为接近,与朱罗茜等[6]的研究结果相符。此外,本研究通过ABVS复查,发现了部分常规超声BI-RADS分类为3类的漏诊病灶,15个病灶ABVS冠状位图像可见典型的“火山口”征,14个直径<1 cm(其中最小者直径仅0.4 cm)的病灶常规超声均分为3类及4A类,术后病理结果显示其中13个为原位癌,这些恶性肿块常规二维声像图像仅表现为一回声稍减弱或不均质区域[7],弱回声周围未见明显“蟹足样”恶性征象(图1A),且CDFI及弹性成像均未见明显恶性征象。阳练等[8]认为部分最大径≤2 cm的乳腺癌病灶并不具有典型二维声像图表现,原因在于病程早期肿瘤细胞相对较少,尚未突破导管基底膜,所形成的实性肿块较小,尚未对周围组织形成明显的浸润性生长,形态学上恶性征象不典型,易使常规超声BI-RADS分类过低,从而造成漏诊及误诊[8]。这也可能是本研究中常规超声BI-RADS分类为3类及4A类肿块中恶性率较高的原因。
乳腺癌因其生物学特征而向周围浸润生长,常表现为形态不规则、周边毛刺、非平行生长、穿枝状征象及高阻血流信号、砂砾样钙化、弹性成像硬度高等声像图特征;但并非所有乳腺癌均具有典型恶性征象,尤其是早期乳腺癌,常因肿瘤体积较小,常规超声只能提供横切面、纵切面图像,加之受到部分容积效应的影响,易于漏诊及误诊。ABVS能提供连续的冠状面图像,并可薄层扫描乳腺病灶(层厚仅0.5 mm),以显示早期一些细小的恶性征象,如边缘不局限(出现模糊、成角、细分叶或毛刺等),有利于弥补常规超声在这方面的不足[9],从而发现常规超声不能显示的小病灶及其恶性征象,避免早期恶性病灶漏诊。本组27个乳腺肿块(常规超声BI-RADS 3类15个,4A类12个)的ABVS冠状面图像肿块边缘出现多条毛刺状弱回声呈放射状向周围生长,呈典型的“火山口”征,因此将BI-RADS分类上升为4C类(图1B),病理证实17个为恶性肿块,且其中14个肿块直径<1.0 cm,最小者仅0.4 cm。另一方面,本研究发现33个肿块常规超声表现形态不规则,边界欠清,BI-RADS分为4A类(图2A)的肿块,ABVS冠状面图像肿块形态欠规则,边缘光整,周边略成大分叶状(图2B),未见明显毛刺及纠结征象,因此将BI-RADS分类降为3类,病理证实均为良性,提示将形态不规则又无其他恶性征象的肿块中ABVS冠状面图像显示边缘光整、无明显毛刺及纠结征象、未见明显砂砾样钙化灶者的BI-RADS分类降为3类,建议随诊复查,有利于避免不必要的穿刺活检。
超声诊断乳腺癌依据的众多恶性征象中,形态学改变始终排在首位。ABVS因其独特的冠状切面及薄层扫描,在显示肿块的形态、边缘细小毛刺及内部有无微钙化等方面具有其优势[10],但不能提供血流及弹性成像信息。评判乳腺肿块的良恶性需综合考虑多方面因素。ABVS联合BI-RADS分类能够提高对常规超声恶性征象不典型、直径较小的乳腺癌病灶的超声诊断阳性率[11],对诊断常规超声恶性征象不典型的乳腺癌(BI-RADS分类3类及4A类)具有重要价值,其敏感度、特异度、准确率均较高。

