人工表达β2肾上腺素受体的β激动剂多残留检测
胡梦华,王晶,余秋颖,张浩,樊剑鸣,王方雨
(1.河南省农业科学院动物免疫学重点实验室,郑州河南 450002)(2.郑州大学公共卫生学院,郑州河南 450001)
β肾上腺素受体激动剂(俗称“瘦肉精”)的违禁添加一直是威胁我国人群健康的问题之一,严重影响畜类食品安全和养殖业的健康发展[1]。尤其近年来添加剂的混合使用以及新型结构类似物的出现增加了检测的难度,因此开发一种β受体激动剂多残留快速检测技术成为了迫切需求。受体分析法是一种针对结构功能相似的目标物的类特异性快速检测方法,可实现β受体激动剂类药物的多残留检测以及对未知物的筛查[2]。作为受体分析法的核心识别元件,体外表达的β2肾上腺素受体(β2adrenergic receptor,β2AR)的活性和纯度一直是研究焦点。现有的研究表明,在大肠杆菌[3]、酵母[4]、昆虫细胞[5]、哺乳动物细胞[6]和无细胞表达系统[7]等均能得到具有一定活性的受体蛋白,但表达量及蛋白活性在不同的表达系统中具有差异性。
分子对接技术是根据配体与受体作用的“锁钥原理”(lock and key principle),模拟它们的相互作用,使两者结合形成低能构象,是药物虚拟筛选的重要手段[8]。实验表明,通过分子对接技术,可对多种乙酰胆碱酯酶与不同农药分子的敏感性进行了虚拟筛选[9];利用构建的GPCRs模型可以捕捉结合口袋的关键化学结构特点[10];可用于筛选抗HIV-1逆转录酶活性化合物[11],在中药研究方面也有其独特的优势[12,13]。
本研究利用分子对接技术,对β2AR受体蛋白的分子结构进行优化,基于优化后的分子结构人工合成基因,利用常见的大肠杆菌表达系统,将成功构建的重组表达质粒,转入BL21大肠杆菌,经IPTG诱导表达后,将诱导表达的受体蛋白利用组氨酸标签蛋白纯化磁珠进行蛋白纯化,并对纯化后受体蛋白进行活性鉴定,为建立基于受体分析法的β激动剂快速检测技术奠定理论基础。
1 材料与方法
1.1 质粒和细胞
pET32a质粒由本实验室保存;BL21(DE3)感受态细胞,购自天根生化科技(北京)有限公司;JM109感受态细胞,购自Takara公司。
1.2 试剂和材料
T4连接酶和ExTaq酶购自宝生物工程(大连)有限公司;限制性内切酶NdeⅠ和XholⅠ购自美国NEB公司;小提质粒试剂盒和DNA凝胶回收试剂盒购自上海索宝生物科技有限公司;组氨酸标签蛋白纯化磁珠购自海狸生物科技有限公司;辣根过氧化物酶(horse radish peroxidate,HRP)标记的克伦特罗来自Sigma公司;羊抗鼠二抗、His鼠源单克隆抗体购自Qiagen公司。磷酸盐缓冲溶液(phosphate buffered saline,PBS,0.01 mol/L);PBST 洗液(PBS∶Tween20=2×103∶1),包被缓冲溶液(carbonate buffered saline,CBS,0.05 mol/L NaHCO3/Na2CO3缓冲液),封闭液(PBST∶BSA=100∶1),终止液(2 mol/L H2SO4);其他常规试剂均为国产分析纯级别。
1.3 方法
1.3.1 分子对接
对接所需的β受体激动剂分子结构均从ZINC上下载,β2AR蛋白分子结构(2RH1),从PDB数据库中下载。依据2RH1的分子结构,对接口袋设定为包含Asp113、Asn312、Ser203、Phe193、Phe289、Phe290、Val114、Val117、Trp109、Tyr308、Tyr316、Tyr199、Trp286和Thr118残基的区域,Threshold定义为0.50,Bloat定义为10A。以上述蛋白的对接区域作为受体,以β受体激动剂类小分子药物作为配体,借助SYBYL软件中FlexX方法进行对接工作,对接前先对β2AR进行系列优化:提取出配体分子对侧链的修补、主链末端的处理,加氢、删除水分子、指定原子类型、加电荷和能量优化等均按 SYBYL默认值进行系列优化;利用SYBYL软件的蛋白质对接下面的Define来生成对接活性口袋,其它条件按SYBYL默认值。以对接结果中总评分值(Total Score)为最终判断对接结果的依据。
1.3.2 重组质粒的构建与鉴定
依据对接实验中β2AR受体蛋白的分子结构,将人工合成并改造的β2AR基因PCR扩增后与表达载体pET32a分别用NdeⅠ和XholⅠ进行双酶切,利用琼脂糖凝胶电泳切胶回收目的片段和载体片段。在 T4连接酶的作用下,16 ℃连接过夜。将阳性重组质粒送生工生物工程(上海)股份有限公司测序,验证读码框的正确性。序列正确的重组质粒命名为pET32a-β2AR1,并将重组质粒转入BL21大肠杆菌。挑选氨苄阳性的单菌落摇菌,用于目的蛋白的表达。
1.3.3 表达条件的优化及鉴定
将筛选出的BL21大肠杆菌菌液二次活化后1∶100接入加入氨苄抗性的LB培养基,37 ℃,220 r/min,振荡培养3 h,至细菌生长对数期(OD=0.6~0.9)。取出一部分菌液作为阴性对照,余下的菌液按终浓度为1 mmol/L,0.8 mmol/L,0.6 mmol/L和0.4 mmol/L加入诱导剂IPTG,37 ℃,诱导14 h后,将诱导表达的菌液超声破碎,将破碎后菌液进行SDS-PAGE鉴定,检测诱导表达的情况。
1.3.4 蛋白纯化及活性鉴定
在2 mL EP管中加入1 mL菌液上清,组氨酸标签蛋白纯化磁珠400 μL,4 ℃环境下,在摇床上结合反应1 h,在磁力架上进行磁性分离,保存分离液,并用浓度10 mmol/L~500 mmol/L的咪唑洗脱液洗脱受体蛋白,收集不同浓度咪唑洗脱液并进行SDS-PAGE检测。将含有受体蛋白的洗脱液用透析液进行梯度透析,得到纯化蛋白。CBS包被纯化后受体蛋白,5%BSA封闭液封闭过夜,ELISA检测目的蛋白的活性。
1.3.5 多残留检测曲线建立
纯化蛋白1∶1稀释后包被在酶标板,50 μL/孔。加入梯度稀释的克伦特罗、莱克多巴胺和非诺特罗3种β受体激动剂标准品(0 ng/mL、10 ng/mL、50 ng/mL、100 ng/mL、500 ng/mL、1000 ng/mL),50 μL/孔。同时加入 1∶500 稀释的 HRP-克伦特罗,50 μL/孔。37 ℃,30 min,PBST洗板,加入显色液,100 μL/孔,显色10 min,加入终止液,50 μL/孔,终止反应,酶标仪测各孔OD值。
1.3.6 交叉反应率的测定
根据标准曲线中的标准曲线公式,得到3种β受体激动剂的IC50值,计算3种β受体激动剂的交叉反应率(CR)。
计算公式:CR=[IC50(克伦特罗)/IC50(β受体激动剂)]
2 结果与分析
2.1 分子对接结果

图1 β2AR与β受体激动剂类药物分子对接模型图Fig.1 Modeling diagram of β2AR and β adrenergic receptor agonists by molecular docking

表1 分子对接结果Table 1 Result of molecular docking
β2AR蛋白分子结构(2RH1)与15种β受体激动剂进行分子对接后,以总评分值(Total Score)作为判断对接结果的依据,分子对接图如图1所示,分子对接结果如表1所示,β2AR受体蛋白在分子结构上能与多种β受体激动剂结合,并且其结合能力具有差异性。
2.2 重组表达质粒的鉴定

图2 重组表达质粒的双酶切鉴定Fig.2 Double enzyme digestion of recombinant expression plasmid
用限制性内切酶NdeⅠ和XholⅠ对重组表达质粒pET32a-β2AR1进行酶切鉴定,结果如图2所示,重组质粒经酶切之后出现两个条带,在1500 bp左右出现目的条带为β2AR基因片段,与预期片段大小相符,另一条为载体pET32a基因片段。
2.3 表达条件的优化及鉴定

图3 重组质粒诱导表达SDS-PAGE电泳图Fig.3 SDS-PAGE image of recombinant expression plasmid
将重组表达质粒转入BL21大肠杆菌,挑选Amp阳性的单菌落摇菌,分别标记为 1号菌,2号菌,3号菌和4号菌,诱导温度设置为37 ℃,IPTG的浓度设置为 1 mmol/L,0.8 mmol/L,0.6 mmol/L和 0.4 mmol/L,将诱导和未诱导表达后的菌液超声破碎后,SDS-PAGE检测结果如图3所示,诱导后的1号和2号菌在47 ku左右条带明显,3号和4号菌诱导后有目的蛋白的表达,但是条带不明显。
2.4 蛋白纯化及活性鉴定
2.4.1 表达蛋白的纯化
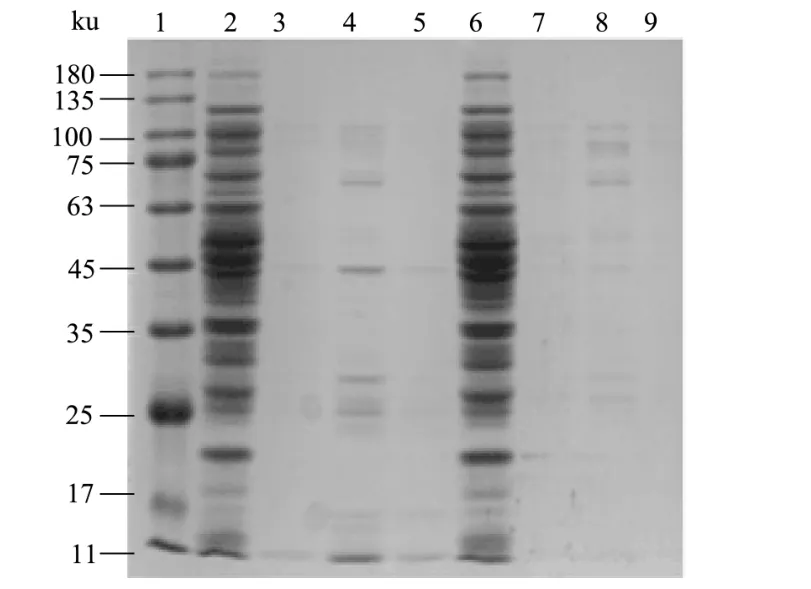
图4 不同咪唑浓度洗脱蛋白SDS-PAGE电泳图Fig.4 SDS-PAGE image of purified porcine β2AR protein eluted with different imidazole concentration
选取诱导表达较好的1号,2号菌液,经超声破碎、离心后留取上清,加入400 μL的磁珠进行蛋白的纯化,用不同浓度的咪唑洗脱液经SDS-PAGE检测后如图4所示,菌液均在浓度为300 mmol/L咪唑洗脱液下纯化出蛋白。
2.4.2 纯化蛋白的活性鉴定
将纯化后的受体蛋白采用 ELISA方法进行其活性鉴定,受体蛋白与辣根过氧化物酶(horseradish peroxidase,HRP)标记的克伦特罗、莱克多巴胺及非诺特罗均能够特异性结合,结果如表 2所示,pET32a-β2AR1表达的受体蛋白与三种激动剂的结合力最高的是IPTG为1 mmol/L,OD值分别为0.45、0.32、0.36。
2.4.3 多残留检测曲线建立

图5 不同激动剂的检测曲线图Fig.5 Testing curve of different β receptor agonists
包被纯化后的蛋白,ELRA方法检测受体蛋白对三种激动剂的检测能力,测得OD值以B/B0为纵坐标,以每种β受体激动剂浓度的对数值为横坐标,建立检测标准曲线。结果如图5所示,R2均大于0.9,受体蛋白对克伦特罗、莱克多巴胺及非诺特罗均表现出一定检测能力,尤其对克伦特罗的检测能力最高。
2.4.4 交叉反应率测定
3种β受体激动剂的标准曲线公式和R2值分别列出,计算它们的IC50值,得到交叉反应率。结果如表3所示,莱克多巴胺和非诺特罗与克伦特罗的交叉反应率分别为5.45%和66.16%。说明本次实验中表达的受体蛋白对β受体激动剂有一定的检测能力。

表2 表达蛋白活性鉴定结果Table 2 Result of molecular docking
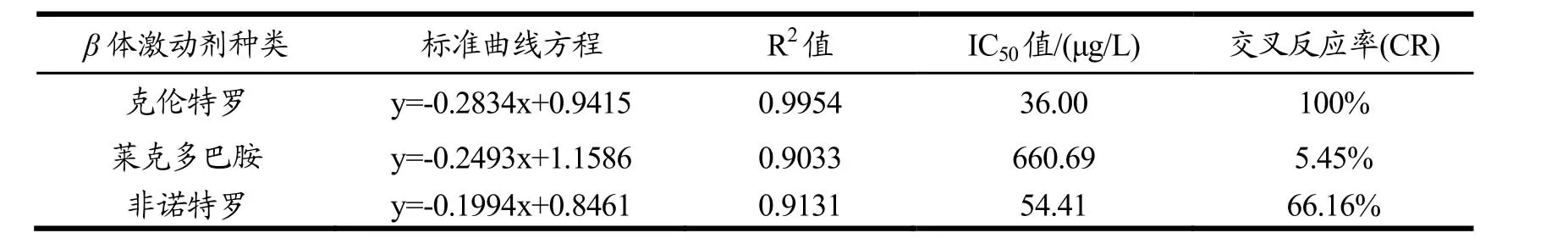
表3 交叉反应率测定结果Table 3 Determination of 3 β adrenergic agonists of by ELRA
3 讨论
目前针对动物源性食品中多种β受体激动剂残留量检测,主要包括确证分析法和快速检测法两类。国家标准中规定了液相色谱-串联质谱的测定方法,属于确证分析方法[14~16]。具有耗时长、成本高、难以实现现场检测等缺点。基于免疫学技术的快速检测方法[17~20]只能针对特定的β受体激动剂进行检测,因此不能满足市场对快速检测的需求。基于受体分析法的快速检测虽能对β受体激动剂类药物进行检测,目前还处在研究阶段[21,22]。
近年来,分子对接技术在药物[23]、化学[24]及其他领域[25]得到迅速发展,随着 GPCRs模型的建立及β2AR蛋白分子结构的发现,对它们的研究内容也更加广泛[26]。基于这些研究,本实验对β2AR蛋白与β受体激动剂的相互作用进行分析,利用分子对接技术实现β2AR基因的人工改造。
由于天然的β2AR在生物体内的含量低且难于分离,为了获取纯度高、活性好的β2AR,近年来人们尝试几乎所有的体外表达系统,均表达出具有一定活性的受体蛋白。本次实验在大肠杆菌成功表达的β2AR受体蛋白虽比以往其他系统表达的蛋白活性低,但比较其他大肠杆菌表达系统的研究[3],本实验得到了活性较高的受体蛋白。并且利用分子对接技术实现对β2AR基因的改造,为β2AR基因的人工改造提供新的思路,为实现β受体激动剂的快速检测奠定了理论基础。
4 结论
本实验利用分子对接技术对β2AR基因进行改造,利用大肠杆菌表达系统成功表达出具有活性的β2AR受体蛋白,ELISA进行其活性鉴定结果显示,β2AR受体蛋白与克伦特罗、莱克多巴胺及非诺特罗均能够特异性结合,OD值分别为0.45、0.32、0.36,与分子对接结果基本一致。多残留检测曲线显示,该β2AR受体蛋白具有一定的检测β受体激动剂的能力,这为β2肾上腺素受体在β受体激动剂的快速检测方面提供新的思路。

