酱香型白酒大曲和糟醅的真菌多样性分析
戴奕杰,李宗军,田志强
(1.湖南农业大学食品科技学院,湖南长沙 410128)(2.贵州省产品质量监督检验院,贵州贵阳 550016)
随着测序技术突飞猛进的发展,使用分子生物学手段来分析微生物群落多样性也得到越来越多研究者的关注。微生物的ITS基因是对真菌进行系统进化分类研究时最常用的分子标志物,广泛应用于微生物生态学研究中。近年来,高通量测序技术及数据分析方法的有效结合,大量基于ITS基因的研究使得越来越多的未知真菌菌种得以揭示。真菌的ITS基因相比18S rRNA基因或28S rRNA基因而言整体的变异性更强,因而物种间的序列差异会更大,分类信息会更加详尽一些,所以被广泛应用于真菌系统发育和分类的分子标记。
真菌在酿酒工艺过程中也是重要的微生物类群,主要为酵母和霉菌[1~4],其在酿造工艺中除了具有糖化、酒化作用,还可以生成一定量的酯类、醛类、杂环类物质。有研究表明,霉菌可代谢产生柠檬酸、葡萄糖酸和草酸等有机酸,有机酸进一步酯化作用产生一些香味物质,另有报道称,在产酶方面有不同的促进或抑制作用[3,5~10],酵母不仅能发酵糖类得到乙醇,而且能代谢产生某些香味成分,如具有酯香的酿酒酵母和有醇甜香的假丝酵母,毕赤酵母在不同底物和不同温度的发酵条件下,代谢产物主要有醇、酯、酸[11~15],在很大程度上影响了白酒产品味感和风味特征[16~18]。在酱香型白酒生产中,高温制曲导致大曲中几乎所有的酵母菌消失殆尽[19,20],在后来的堆积中糟醅又吸收了从空气或在操作时由生产器具裹入酒醅内的原料粉、曲粉、糖质,再加上适当的酸度条件,酵母菌在堆积发酵过程中大量繁殖[16],使入窖发酵得以顺利进行。在发酵过程中,由于营养成分、有机酸、溶解氧等的变化,霉菌的数量呈下降趋势,直至发酵过程结束[21~26],且不同轮次对微生物影响很大[27]。霉菌可代谢产生柠檬酸,葡萄糖酸,草酸等有机酸,还可以分泌淀粉酶、蛋白酶等酶[28]。在高温大曲中虽然含量较少,但能为曲酒生产积累大量的酶类,其中,根霉适应多种菌混合培养,由于偏利共生,酵母菌与霉菌混合培养时比单独培养增殖更好,具有潜在的、重要的应用价值。
本文利用ITS片段测序技术及成熟的数据分析方法,以高温大曲和堆积发酵酒醅为研究对象,分析真菌微生物多样性、群落结构特点、菌群组成的差异性、微生物之间可能存在的相互作用关系等。
1 材料与方法
1.1 材料
1.1.1 大曲的制备
按照传统大曲的配料及制备方法,在贵州某酒厂进行大曲的制备,分别选取3个制曲阶段的曲块,取样时间分别如下:曲块压制成型后入仓开始培养时(B1),培养时间至30 d出仓时(B2),出仓大曲存储1年并作为使用曲时(B3)。采用五点取样法为:以曲块对角线的中点作为中心抽样点,再于对角线上选择四个与中心样点距离相等的点作为抽样点。将上述采样位点的样品破碎并混匀后,分装于无菌袋封装标记,于-80 ℃冰箱中保存。具体采样位点见图1。
图1 大曲曲块取样点位示意图Fig.1 Diagram of sampling points of Daqu
1.1.2 酒醅的准备
按照传统酱酒的酿造工艺,采用上述准备的大曲,在酒厂进行酱酒的酿造。选取整个酱香白酒发酵工艺的下沙、造沙和七轮次发酵过程的高温堆积、窖池发酵工序的糟醅,取样时间分别为:采用如图 2、图3中的位置对高温堆积和窖池发酵酒醅进行取样。将每次取样点酒醅混匀后分装于无菌袋封装标记,于-80 ℃冰箱中保存。具体采样时间及位点见图2和3。

图2 高温堆积过程取样点位示意图Fig.2 Diagram of sampling points during high-temperature stacking
图3 窖池发酵酒醅取样示意图Fig.3 Sampling points of fermented grains in pool
1.2 主要试剂与仪器DNA提取试剂盒,美国MP Biomedicals公司;测序试剂盒,Illumina公司 Hiseq Rapid SBS Kit v2(FC-402-4023 500 Cycle)。文库构建,Illumina公司
TruSeq DNA PCR-Free Sample Prep Kit(FC-121-3001/3003)。
1.3 方法
1.3.1 样品预处理
称取7 g大曲和酒醅样品,用20 mL灭菌后的0.1 mol/L PBS缓冲液悬浮,加入玻璃珠,旋涡振荡5 min。300 r/min离心5 min,取上清,沉淀用PBS缓冲液重复洗涤3次,离心后收集上清液。全部上清于10000 r/min离心15 min,弃去上清,收集细胞沉淀。再用5 mL PBS洗3次,每次以10000 r/min离心15 min,收集沉淀。最后将沉淀重新悬浮于2 mL PBS溶液中,-20 ℃保存[29]。
1.3.2 样品DNA提取及ITS片段测序分析
采用环境样本DNA提取试剂盒(由罗宁生物提供)进行基因组DNA抽提后,使用0.8%的琼脂糖凝胶电泳检测DNA。使用真菌特异性引物对样品所提取的DNA的ITS区域进行扩增,ITS区引物ITS3_KYO2(5’-GATGAAGAACGYAGYRAA-3’) 和 ITS4(5’-TCCTCCGCTTATTGATATGC-3’)[30]。每个样本进行3个重复,每个PCR反应终止于线性扩增期,PCR结束后将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,检测条件5 V/cm,20 min,使用OMEGA胶回收试剂盒切胶回收PCR产物,TE缓冲液洗脱回收目标 DNA片段。将 PCR回收产物用 Qubit 2.0(ThermoFisher公司)或 GE NanoVue系统(GE Healthcare公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。使用 Illumina公司TruSeq DNA PCR-Free Sample Prep Kit进行文库构建。使用Illumina公司Hiseq Rapid SBS Kit v2测序试剂盒进行测序。
1.3.3 高通量测序数据统计分析
(1)对于双端测序得到的 PE reads首先使用FLASH[31]进行拼接,根据Barcode区分不同来源的样本。对序列质量进行质控,在去除低质量碱基及接头污染序列等操作过程后完成数据过滤,得到可供后续分析的高质量有效序列。
(2)使用QIIME[32]等软件在97%的相似性水平上利用 UPARSE算法[33]进行 OTU(Operational Taxonomic Units)的聚类,并挑选出OUT的代表性序列。
(3)使用 Uchime[34]去除嵌合体,并采用 Silva等数据库[35]进行物种分类信息的划分,同时去除注释为叶绿体、线粒体以及非细菌或古菌界的OTU。
(4)使用PyNAST算法[36]对代表性序列进行比对并过滤,然后使用FastTree[37]重构建进化树。从OTU表中去除在进化树重构建过程中被过滤掉的OTU,重抽样OTU表使每个样品具有相同的序列数。
(5)基于上述结果在群落组成(compositional)水平和系统发育(phylogenetic)水平上使用 QIIME和R等软件对样本进行Alpha多样性分析、Beta多样性分析和群落结构的差异性分析等,在物种水平上进行物种的差异分析和相关分析等。
2 结果与分析
2.1 酱香型白酒高温大曲的真菌多样性分析
2.1.1 真菌群落多样性指数
根据表1中丰度指数显示,高温大曲真菌的OTUs分类较少;多样性指数(Shannon)随大曲贮存时间的增加,表现为先下降后增加;物种丰度指数(Chao1∶504)在贮存一年后达到最高值。
高温大曲阶段,真菌微生物多样性数据变化较为平缓,而发酵培养30 d的样本Chao1数据变化稍有波动,但波动幅度不大,说明大曲在发酵过程中,真菌微生物群类在不断调整、平衡。

表1 基于ITS基因测序大曲不同发酵阶段中真菌微生物群落多样性分析Table 1 Analysis of microbial community diversity in different fermentation stages of Daqu based on ITS gene sequencing
2.1.2 真菌群落结构分析
在酱香型白酒酿造过程中,细菌占比为 90%以上,而真菌数量极少。从图4和图5中可以看出,高温大曲阶段,真菌菌门以Ascomycota和Basidiomycota两大类为主,前者呈先下降后上升变化,后者在发酵期间基本保持稳定。根据分类学分析结果,测序共检测出 4个门个 75个属。其中,占优势的菌属为Alternaria、Issatchenkia、Pyrenochaetopsis、Pichia等。Alternaria、Pyrenochaetopsis呈先上升后下降,Issatchenkia、Pichia呈先下降后上升。还有一些菌属数量虽少,但均在制曲期间保持平衡的存在,为大曲发酵提供重要物质转化基础。相对丰度,括号里的百分比代表只列出了平均丰度大于此比例的类群,其它类群全部归类在了Others中。
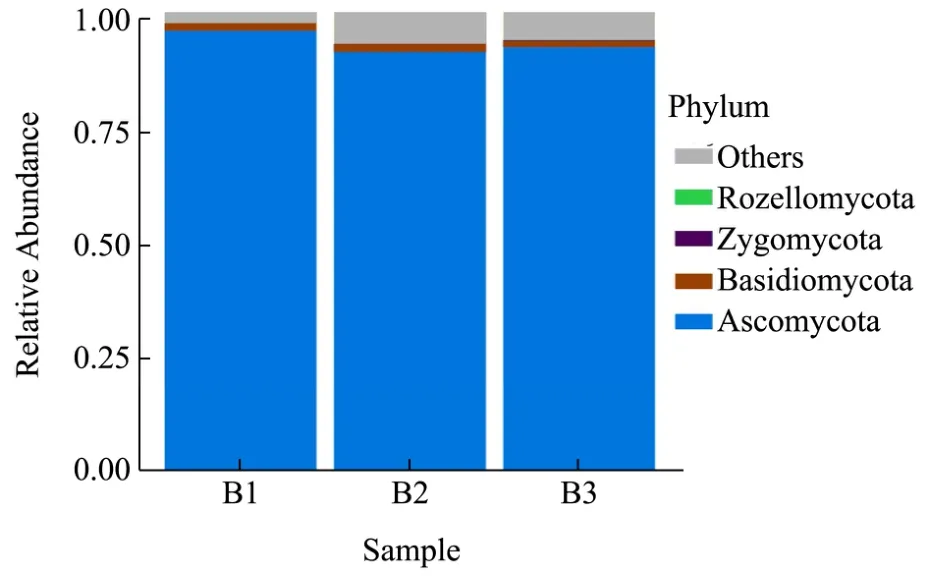
图4 门分类水平上的真菌菌群Fig.4 Fungus flora at door classification level

图5 属分类水平上的真菌菌群Fig.5 Genus of fungus at taxonomic level
2.2 酱香型白酒发酵过程中糟醅的真菌多样性分析
2.2.1 真菌群落多样性指数
表2中丰度指数显示,堆积发酵真菌的OTUs分类除2轮次起窖样本外,其他样本均高于200;多样性指数(Shannon)和物种丰度指数(Chao1)基本呈现起窖样本低,下窖样本高的变化趋势。堆积发酵中真菌微生物多样性数据变化较为平缓,只有基于Chao1的数据变化稍有波动,但幅度不大,整体来说真菌微生物丰富度较高。

表2 基于ITS基因测序堆积发酵阶段中真菌微生物群落多样性分析Table 2 Analysis of microbial community diversity in the stage of stacking fermentation based on ITS gene sequencing
2.2.2 真菌群落结构分析
根据分类学分析结果,从图6和图7可以看出,酱香型白酒不同发酵过程中的真菌群落结构中,糟醅组的菌群种类明显多于大曲样本,占比最多的是子囊菌门(Ascomycota)且表现为各轮次起窖时高下窖时低;其次是担子菌门(Basidiomycota),各轮次样本中下窖样本含量高于起窖样本;在轮次酒的最后阶段,出现接合菌门(Zygomycota)菌类。经分类统计,真菌测序序列分为 6个门 159个属。子囊菌门(Ascomycota)中占优的属是交链孢属(Alternaria)、Ciliophora、Cyphellophora、Botryotinia,部分丰度较小的酵母属,如伊萨酵母属(Issatchenkia)、毕赤酵母属(Pichia)。其中,交链孢属(Alternaria)除了糙沙和二轮次样本外,其余轮次下窖取样呈上升趋势;Ciliophora、Cyphellophora菌属均为前期存在菌类;酵母菌属类伊萨酵母属(Issatchenkia)、毕赤酵母属(Pichia)表现为从轮次取样开始,下窖时升高。担子菌门(Basidiomycota)中,存在属类为灵芝属(Ganoderma)、离褶伞属(Lyophyllum)、粉褶菌属(Entoloma)。以及轮次酒后期出现的根霉属(Rhizopus)、被孢霉属(Mortierella)。

图6 门分类水平上的真菌菌群Fig.6 Fungus flora at door classification level

图7 属分类水平上的真菌菌群Fig.7 Genus of fungus at taxonomic level
2.3 大曲和糟醅的真菌多样性比较
比较制曲和制酒工艺阶段,各发酵时间真菌菌属结构特点,从热图8能看出,真菌菌类组间差异显著,其中以Alternaria为主,其他菌属如Fusarium、Bionectria、Fusicolla丰度保持一致,而菌属Ciliophora、Cyphellophora在酒醅中优于大曲,相反Pyrenochaetopsis、Issatchenkia、Pichia、Botryotinia等菌属在大曲中优于酒醅。
从图9韦恩分析结果显示,曲药组和酒醅组样本OTUs分类中86.79%的序列占比是共有的,而酒醅有958个OTUs独有,大曲则是78个OTUs独有。说明酒醅样本的分类多于大曲样本,可能是“二次发酵”产生的结果。
真菌类菌属的网络关系较为复杂,一些优势菌类呈现负相关且多为酵母菌属,而部分霉菌类为正相关,一方面说明在特殊工艺过程中霉菌及少数外源菌类作用密切,另一方面揭示了部分优势菌的生长可能抑制某些酵母和霉菌的生长,从而影响风味物质的形成。

图8 属分类水平真菌的丰度类群热图Fig.8 Abundance group heat map of genus of fungus at taxonomic level

图9 样本OTUs韦恩图Fig.9 OTUs Wayne diagram of samples
3 讨论
传统的分离培养技术是微生物分析的基本方法,通过纯化分离得到纯种的菌株,再进行形态学、代谢组学以及分子生物学的分析,全面了解菌株特性。随着科技的创新进步,菌种研究方法从传统的分类学向现代分析生物学方法探索,在传统可培养分离技术的基础之上,逐渐出现了聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术、16S或18S rRNA基因序列同源性分析技术、聚合酶链式反应-限制性内切酶片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)技术、Biolog微平板技术、荧光定位杂交技术(fluorescence in situ hybridization,FISH)、高通量测序技术等的免培养方法。
虽然,传统可培养分离技术是白酒酒曲微生物群落研究领域的主要分析手段,由于很难模拟高温制曲的极端环境,仅凭能培养出的微生物很难说明微生物区系的组成情况。在自然界中,有相当一部分微生物是不能通过传统分离方法培养出来,更不能全面揭示微生物的结构及生长规律。随着科学技术高速发展,分子生物学在各个研究领域崭露头角,研究手段从传统微生物可培养研究方法逐渐向未培养等分子生物学技术过渡。
高通量测序技术(high-throughput sequencing)又称第二代测序技术,它可以一次性对几百万到十亿条DNA分子进行并行测序,这一优势对一个物种的转录组和基因组进行深入、细致、全貌的分析提供基础。相对于传统酿酒微生物鉴别和分析方法,微生物基因组学的技术方法更准确、快速简便。
相对于传统方法,本实验利用Hiseq测序手段对高温大曲和堆积发酵过程中的真菌微生物菌落结构进行分析,使我们更加深入地了解样本原生态的微生物多样性和群落结构,特别是复杂的堆积发酵工序所产生的菌群。在整个酿酒过程中,真菌微生物多样性还是相对较高,但窖内发酵的群落丰度除优势菌外都比较低,因此较难总结某些菌属的变化规律。但是值得一提的是,堆积发酵工艺中,由于材料来源广泛,除了高温大曲期间能鉴定出的菌群外,还获得了不少新菌种,如Coprinellus、Calcarisporium、Myxotrichum、Cladophialophora等,说明高温堆积工艺使得微生物丰度有所提高。
从生产工艺的角度,高温制曲中的微生物与品温和水分联系密切,因此群落结构变化相对容易看出。如Alternaria、Pyrenochaetopsis、Phaeosphaeria等随贮存时间的延长先上升后下降,Issatchenkia、Pichia、Candida、Ascobolus等呈先下降后上升。堆积发酵阶段,在不同轮次的酒醅中,菌群的种类结构整体来说都比较接近,说明在酱香型白酒酿造过程中菌群处于一个相对稳定的状态,占优势的菌属有交链孢属Alternaria、Ciliophora、Cyphellophora、Botryotinia、伊萨酵母属Issatchenkia、毕赤酵母属Pichia,除交链孢属Alternaria和优势酵母菌外,其他菌属丰度随轮次增加而上下波动,无明显变化规律。本文中,酵母类检测出14个酵母属,分别是Issatchenkia、Pichia、Candida、Zygosaccharomyces、Saccharomyces、Kluyveromyces、Hanseniaspora、Wickerhamomyces、Clavispora、Barnettozyma、Yarrowia、Kazachstania、Millerozyma、Tetrapisispora。
通过真菌菌类的比较分析,Alternaria、Fusarium、Bionectria、Fusicolla丰度保持一致,Ciliophora、Cyphellophora菌属在酒醅中优于大曲,而Pyrenochaetopsis、Issatchenkia、Pichia、Botryotinia等菌属则表现为在大曲中优于酒醅。由于堆积发酵的特殊工艺,酒醅样本中的菌属分类较大曲样本丰富。对酱香型白酒而言,普遍认为酵母菌与霉菌存在共生关系,利用网络分析方法对酿酒微生物间相互作用关系的研究却很少有报道。
4 结论
4.1 该研究运用高通量测序技术,分析了整个酿酒过程中主要真菌菌群的变化,发现堆积发酵过程中真菌微生物多样性相对较高,窖池发酵过程中的群落丰度除优势真菌外都相对较低。在窖池发酵过程中,除大曲中能鉴定出的真菌菌群外,还获得了一些新的类群,如Coprinellus、Calcarisporium、Myxotrichum和Cladophialophora等,说明高温堆积和窖池发酵可以更加丰富酱香白酒发酵的微生物多样性。
4.2 本研究采集了酱香型白酒酿造过程中大曲和酒醅样本,运用现代先进的科技手段,仅仅分析了传统酱香白酒酒曲和发酵过程中的真菌群落结构特点以及不同发酵阶段真菌的差异性,探讨了其影响白酒品质的可能机制。下一步将应用统计学分析方法,对这些主要因素进行科学分析,建立酒醅质量评价标准,以期能实现定向调控,生产出高质量的酱香型白酒。进一步对新发现的真菌菌属进行分离培养,探究其代谢产物与酱香风味成分的关系。为传统酱香型白酒的自动化、智能化生产提供科学数据。

