小鼠肾发育中Slit2及其受体Robo1的表达*
(锦州医科大学基础医学院,辽宁 锦州 121001)
神经迁移因子(Slit)及其跨膜受体蛋白(Roundabout,Robo)属于神经导向因子,两者最初是在果蝇中被检测到并在其神经系统筛选、克隆成功[1-2]。在哺乳动物中,Slit有3种亚型,Slit1、Slit2及Slit3。Robo有4种亚型,Robo1、Robo2、Robo3及Robo4。其中,Slit2蛋白广泛表达于神经组织、泌尿系统及呼吸系统[3-4];Robo1在神经、肺、肝脏、肾脏及心脏中均有表达[5-6]。实验研究显示Slit和Robo在神经系统广泛表达,并参与神经系统的发育过程;在非神经系统如肺、肾脏、心脏、卵巢、血管、性腺及乳腺等多个器官组织的发育过程中同样发挥重要作用[7-8]。本研究采用免疫组织化学技术和蛋白印迹技术对Slit2及其受体Robo1在小鼠肾发育中的表达进行系统观察和定量分析,为后续探讨其在肾发育中的作用奠定理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 中国昆明系清洁级小鼠90只[成年小鼠12~22 g,其余各胚(日)龄未测量体重]购自锦州医科大学实验动物中心[医动字第SCXY(辽)2013-2017号]。
1.1.2 实验试剂 Slit2兔多克隆抗体和Robo1兔多克隆抗体购自上海斯信生物科技有限公司提供,免疫组织化学试剂盒和二氨基联苯胺(Diaminobenzidine,DAB)显色试剂盒购自北京中杉金桥生物公司,3-磷酸甘油醛脱氢(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)鼠单克隆抗体购自上海康成生物工程有限公司。
1.2 实验方法
1.2.1 标本复制 成年雄、雌性小鼠合笼培育孕鼠。共9组,不同时间点各取10只。取胚龄(embryonic days,E)12 d胎鼠全胚;胚龄14 d至生后日龄(neonatal days,N)40 d小鼠肾脏,常规制备石蜡组织切片并提取蛋白。
1.2.2 免疫组织化学染色 切片脱蜡后,依次入100%乙醇2次,90%、80%和70%乙醇各1次,每次10 min,流水冲洗。配置枸橼酸钠修复液,加热至沸腾,切片完全浸入修复液,高压修复抗原2 min,室温自然冷却。取切片置于湿盒内,滴加3%过氧化氢反应10 min。滴加正常山羊血清封闭液反应1 h,轻轻甩去封闭液。滴加Slit2(1︰150)或Robo1(1︰150)4℃过夜。滴加聚合物辅助剂,37℃ 30 min。滴加辣根酶标记抗兔免疫球蛋白G(Immunoglobulin G,IgG)聚合物,37℃ 30 min。滴加DAB显色液,光学显微镜监测组织显色情况。当镜下可见明显棕黄色时,切片放入蒸馏水以终止显色。苏木精复染细胞核。
1.2.3 蛋白印迹检测 肾脏经超声粉碎机粉碎,加适量裂解液裂解,低温离心30 min,抽取上层液体,蛋白定量,分装。安装固定胶板,配胶,灌胶。蛋白样品及内参经加热变性后加样。电泳分离(浓缩胶电压90 V,分离胶电压120 V)。转膜(电压50 V,室温2 h)。5%脱脂奶粉封闭1 h。一抗Slit2(1︰500)或Robo1(1︰500)4℃孵育过夜。Tween20-Tris缓冲盐溶液(Tween20-Tris Buffered Saline,TTBS)洗膜30 min。二抗(1︰2 000)室温孵育2 h,TTBS洗膜30 min。发光溶液A、B各15 ml避光混匀,加至膜上,凝胶电泳图像分析仪拍照。以内参为标准,测定条带光密度值。
1.3 统计学方法
数据分析采用SPSS 16.0统计软件,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学染色结果
Slit2在胚龄12 d小鼠肾脏的生肾区开始表达。其中,Slit2在小鼠输尿管芽及其周围的间充质聚集的部位阳性表达,其余部位无广泛表达。在肾单位发育过程中,Slit2定位表达于逗号小体阶段和S小体阶段,且表达较强。在Ⅲ和Ⅳ期肾小体阶段及成熟肾小体阶段有微弱的表达。Slit2在肾脏泌尿小管如近端小管、远端小管及集合管发育过程中均有表达。见图1~4。
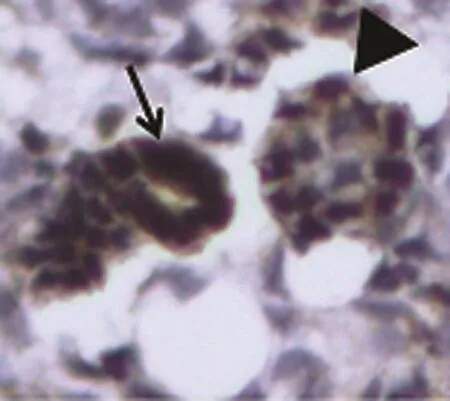
图1 Slit2在输尿管芽和生后肾组织的表达(免疫组织化学染色×400)

图2 Slit2在肾小体发育各阶段的表达 (免疫组织化学染色×400)
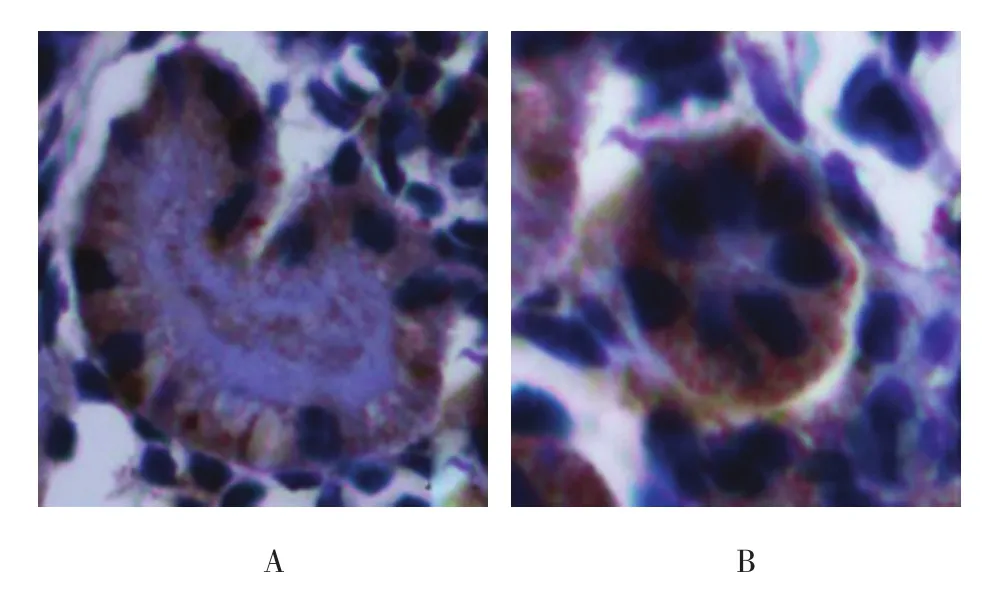
图3 Slit2在肾小管的表达(免疫组织化学染色×400)
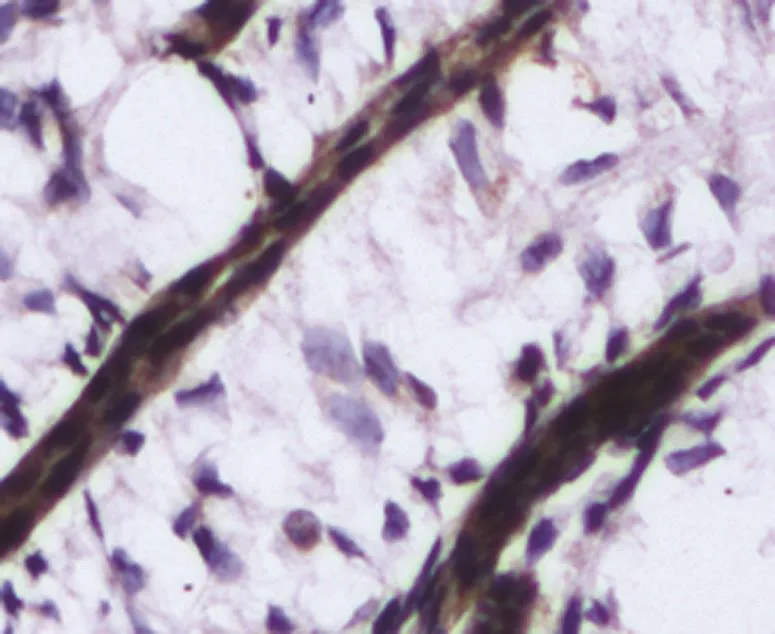
图4 Slit2在集合管的表达(免疫组织化学染色×400)
Robo1在胚龄12 d小鼠肾脏的生肾区开始表达。Robo1在小鼠生肾区广泛表达,主要分布于生后肾组织和输尿管芽上皮细胞基底面。在肾单位发育过程中,Robo1定位于逗号小体阶段、S小体阶段、Ⅲ和Ⅳ期肾小体阶段,且表达较强,在成熟肾小体阶段表达微弱。Robo1在小鼠肾脏泌尿小管如近端小管、远端小管及集合管发育过程中均有表达,主要分布于泌尿小管上皮细胞的基底面。见图5~8。
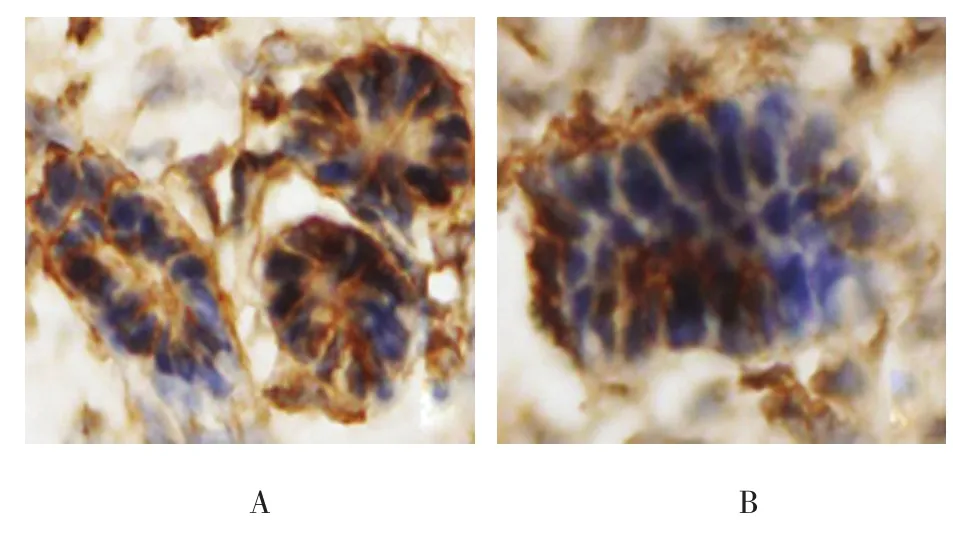
图5 Robo1在输尿管芽和生后肾组织的表达(免疫组织化学染色×400)
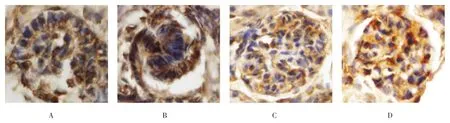
图6 Robo1在肾小体发育各阶段的表达 (免疫组织化学染色×400)
2.2 蛋白印迹检测结果
从小鼠胚龄14 d开始,Slit2蛋白表达随着胚(日)龄的增加,先呈现递增,胚龄16 d达峰值,随后递减。其中,Slit2蛋白表达在出生后1、7和40 d下调较为明显(F=16.564,P=0.012)(见图9)。Robo1蛋白表达随着胚(日)龄的增加而递减,在胚龄18 d、出生后1和14 d下调较为明显;出生后一直维持低水平表达(F=13.483,P=0.016)。见图10。
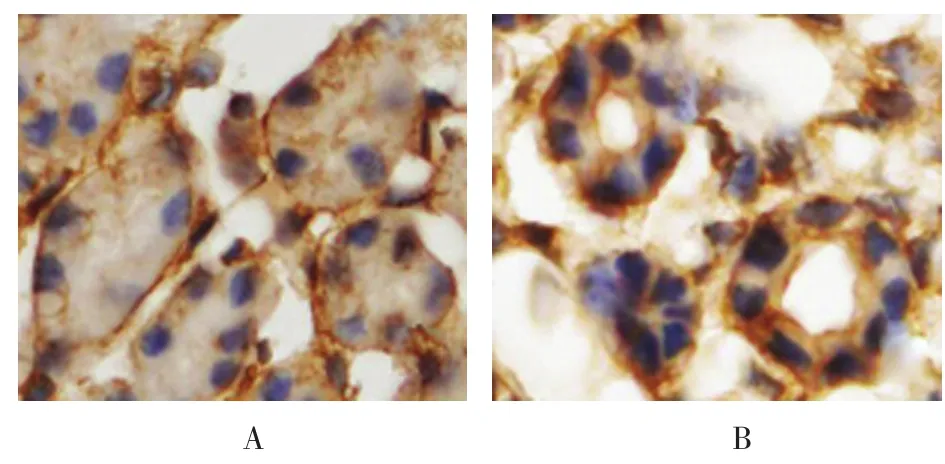
图7 Robo1在肾小管内的表达 (免疫组织化学染色×400)
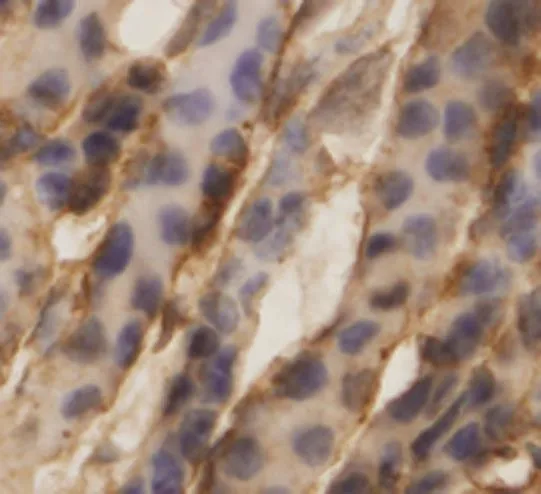
图8 Robo1在集合管的表达 (免疫组织化学染色×400)
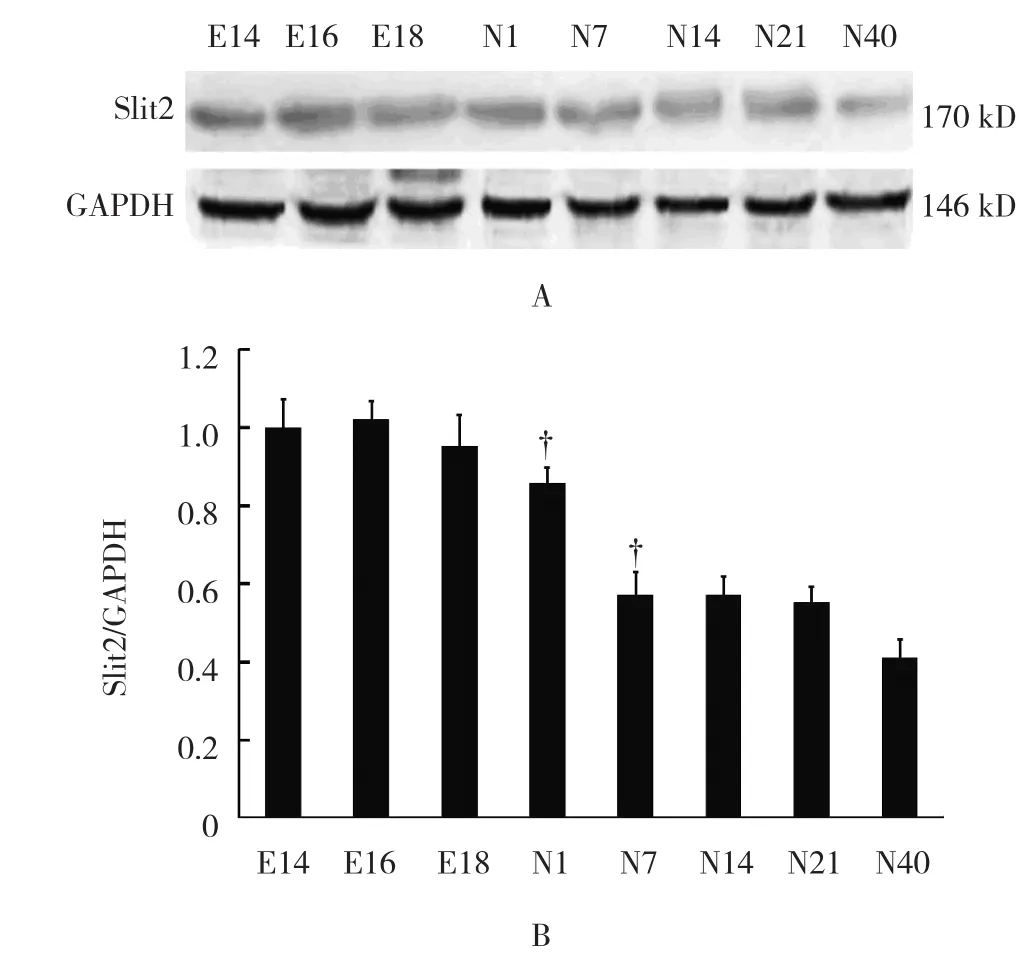
图9 Slit2在小鼠肾脏发育各阶段的表达
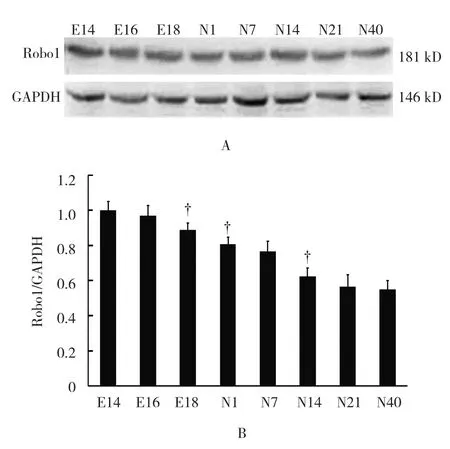
图10 Robo1在小鼠肾脏发育各阶段的表达
3 讨论
本研究显示,Slit2在胚龄12 d小鼠的输尿管芽及输尿管芽周围的间充质聚集部位开始有阳性表达,其余部位未见表达。而Robo1在生肾区广泛表达,主要分布于生后肾组织和输尿管芽上皮细胞基底面。说明Slit2及其受体Robo1在小鼠肾脏早期发育即输尿管芽的发生阶段就开始发挥作用。且之前研究报道也称Slit2基因敲除小鼠胚胎肾脏表现为多个输尿管芽,从而产生多个肾脏,说明Slit2对于输尿管芽的萌出起到关键的调控作用,其表达异常或基因缺失会影响输尿管芽的正常发生过程[9-10]。在肾小体发育过程中,Slit2及其受体Robo1均有阳性表达。Slit2定位表达于逗号小体阶段和S小体阶段,且表达较强;在Ⅲ和Ⅳ期肾小体阶段及成熟肾小体阶段有微弱的表达。Robo1定位表达于逗号小体阶段、S小体阶段、Ⅲ和Ⅳ期肾小体阶段,且表达较强,在成熟肾小体阶段有微弱的表达。两者的表达部位一致,提示Slit2及其受体Robo1参与调控肾小体发生发育的全部过程。另有报道称Robo受体家族中的Robo2表达于成熟肾小体的足细胞[11]。在糖尿病肾病患者肾小球中Robo2表达量下调,提示Robo2可能与肾脏肾小体足细胞功能的维持有关,参与调控足细胞的黏附力[12]。而本研究结果显示Robo1未见在足细胞表达,表明其可能对足细胞的发育和功能作用不大。Slit2和Robo1在肾脏泌尿小管(近端、远端小管及集合管)发育和成熟阶段均明显表达。可见,Slit2及其受体Robo1不仅参与肾小管和集合管的形态发生发育过程,对其功能维持也起到关键的调控作用。半定量分析结果表明,Slit2蛋白表达量随着胚(日)龄的增加,先呈现递增,胚龄16 d达峰值,随后递减。Robo1蛋白表达随着小鼠胚(日)龄的增加而递减,两者略有差异,但生后两者的变化趋势基本一致。蛋白印迹检测结果提示Slit2及其受体Robo1在生后表达较低,这可能与肾脏中肾小体的发育规律有关。对小鼠肾脏而言,肾小体的发育成熟主要集中在胚龄14 d到生后7 d。在生后7 d,随着生肾区的消失,肾小体发育成熟,数目不再增加[13]。而本研究结果提示,Slit2和Robo1主要在发育过程中的肾小体表达明显,而在成熟肾小体微弱表达。可见,Slit2和Robo1的蛋白表达变化规律与肾小体的发育规律是一致的。前期试验证实,胶质细胞系源性神经营养因子(glial cell linederived neurotrophic factor,GDNF)/GDNF家族受体α1(GDNF family receptor α1,GFRα1)/受体酪氨酸激酶(receptor tyrosine kinase,RET)信号通路参与调控小鼠肾脏发育[14]。根据文献报道,GDNF调控输尿管芽发生、发育。而在Robo2小鼠体内后肾间充质出现GDNF表达区域扩大,多个输尿管芽发生的现象[15]。提示这2个信号系统可能存在关联,Slit/Robo信号通路是否通过调控GDNF的表达来影响肾脏的早期发育,这些都需要进一步的实验进行验证。
综上所述,Slit2及其受体Robo1在肾脏发生和发育过程中有广泛表达,如后肾发生阶段出现的输尿管芽、生后肾组织、各期肾小体、发育及成熟阶段的泌尿小管(近端小管、远端小管及集合管)。可见,Slit2及其受体Robo1对于肾脏的发生阶段、中后期的分化阶段及成熟后的功能维持阶段均可发挥一定的作用。结合相关文献报道,有理由推测Slit2及其受体Robo1是肾脏发生、发育的必备调控因素,其表达异常会导致肾发育畸形及功能异常,从而引发相关临床症状。本研究不仅为阐明肾发育畸形的可能机制提供理论依据,同时也为肾发育畸形的临床诊断、治疗和预防提供思路。另外,本研究结果对Slit2及其受体Robo1在肾脏的表达进行系统观察和定位,也为后续的深入探究Slit2及其受体Robo1的功能提供了形态学依据。相信随着研究的不断推进,对肾发育畸形的发病机制将有更全面的认识和了解。

