H19/miR⁃29b/LOX影响胶质瘤细胞侵袭能力的体外研究
李城 李昌熙 王大新 戴燕 金世光
江苏省苏北人民医院1疼痛科,2医学实验研究中心(江苏扬州 225001)
近30年来,原发性恶性脑肿瘤发生率逐年递增,年增长率约为1.2%[1-2]。LncRNA H19基因位于人类染色体11P 15.5,全长2.3 kb。长非编码RNA能够与RNA结合蛋白相互结合进而参与蛋白质之间的相互作用;还能够以“海绵”体形式吸附microRNA影响其对下游靶基因的调节作用[3-5]。本课题组通过生物信息学预测发现H19可能直接结合miR⁃29b,同时预测发现,赖氨酰氧化酶(lysyl oxidase,LOX)为miR⁃29b的潜在靶基因。通过胶质瘤细胞系中干扰和过表达H19能够发现负调控miR⁃29b的表达。miR⁃29b能够调控DNMT3B⁃MTSS1轴来抑制肝癌细胞的上皮-间质转化(epithelial⁃mesenchymal transition,EMT)发生[6]。LOX通过氧化胶原和弹性蛋白的赖氨酸残基来起始这些纤维性蛋白的共价交联,从而稳定细胞外基质[7-8]。有研究表明LOX能够使细胞外胶原交联进而促进肿瘤的发展和转移[9]。因此,本研究深入探讨LncRNA H19、miR⁃29b、LOX信号通路调控网络在胶质瘤侵袭转移中的功能作用。
1 材料与方法
1.1 试剂0.25%胰蛋白酶消化液,RNA酶,10%胎牛血清H⁃DMEM培养液,胶质瘤细胞系U87⁃2M1、SW1088(实验室保存)。
1.2 仪器qRT⁃PCR仪(ABI StepOne Plus),生物安全柜 1205A(FORMA),CO2培养箱(FORMA),倒置显微镜IX70(OLYMPUS),超纯水机(Milli⁃Q Advan⁃tage A10),正置荧光显微镜(Zeiss Axio Scope A1)。
1.3 实验方法
1.3.1 荧光定量PCR检测样本中H19、LOX表达水平收集100例(50例正常及50例胶质瘤患者)样本,将上述临床样本提取RNA和蛋白,利用荧光定量PCR检测H19、LOX表达水平。
1.3.2 Transwell法检测干扰和过表达H19胶质瘤细胞的克隆形成能力将转染H19过表达或敲除的U87⁃2M1、SW1088胶质瘤细胞胰酶消化、离心,弃上清液,重悬于无血清培养基中,再将细胞置于含有Matrigel侵袭室内,在下室中加入有血清的培养基,于培养箱中诱导培养。次日用4%低聚甲醛室温固定30 min,结晶紫染色15 min,弃小室内液体,用棉签轻轻擦干,并置于显微镜下拍照。
1.3.3 细胞划痕实验检测干扰和过表达H19胶质瘤细胞的转移能力将H19过表达或敲除的U87⁃2M1胶质瘤细胞接种于6孔板中,置于培养箱中培养。次日观察细胞,待铺满培养板后,用200 μL枪头垂直画线,形成间隙。PBS重复洗3遍,再加入不含血清的培养基,放入培养箱中培养,分别于0、24 h显微镜下观察并拍照。
1.3.4 利用生物信息学软件Starbase,TargetScan预测miR⁃29b的靶基因通过生物信息学系统分析了潜在的RNA⁃RNA和RNA⁃蛋白相互作用网络,其中包括miRNA和LncRNA相互作用。
1.3.5 利用荧光素酶实验检测H19与miR⁃29b之间的调控关系构建H19野生型及突变型荧光素酶报告基因载体,过表达和敲除miR⁃29b检测荧光素酶表达水平。(1)将细胞裂解液充分混匀,加入细胞裂解液,冰上孵育5 min,充分裂解细胞。10 000 ~ 16 000 r/min离心1 min,取上清。(2)取20 μL细胞裂解液,加至黑色酶标板中。加入100 μL萤火虫荧光素酶反应液,震板混匀,检测萤火虫荧光素酶的活力,检测尽量在30 min内完成。
1.3.6 Trans well法检测干扰和过表达LOX胶质瘤细胞的克隆形成能力将转染LOX过表达或敲除的U87⁃2M1、SW1088胶质瘤细胞胰酶消化、离心,弃上清液,重悬于无血清培养基中,再将细胞置于含有Matrigel侵袭室内,在下室中加入有血清的培养基,于培养箱中诱导培养。次日用4%低聚甲醛室温固定30 min,结晶紫染色15 min,弃小室内液体,用棉签轻轻擦干,并置于显微镜下拍照。
1.3.7 细胞划痕实验检测干扰和过表达LOX胶质瘤细胞的转移能力将LOX过表达或敲除的U87⁃2M1胶质瘤细胞接种于6孔板中,置于培养箱中培养。次日观察细胞,待铺满培养板后,用200 μL枪头垂直画线,形成间隙。PBS重复洗3遍,再加入不含血清的培养基,放入培养箱中培养,分别于0、24 h显微镜下观察并拍照。
1.4 统计学方法应用SPSS 12.0统计分析软件,统计学处理采用单因素方差分析进行检验。P<0.05视为差异有统计学意义。
2 结果
2.1qRT⁃PCR检测长非编码RNAH19和LOX在正常及胶质瘤100例临床标本中进行qRT⁃PCR检测,发现随着转移程度异常表达量越高。见图1。
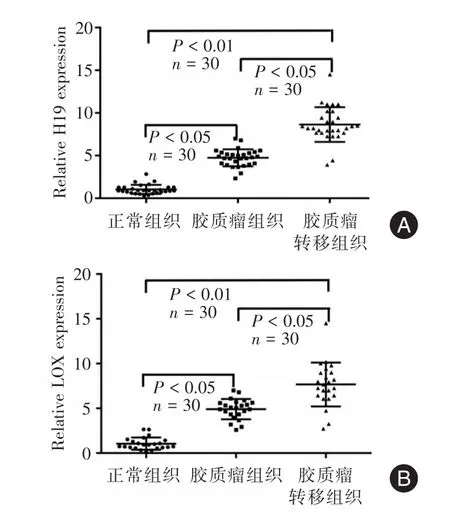
图1 qRT⁃PCR检测临床正常及胶质瘤样本中H19、LOX表达差异Fig.1 qRT⁃PCR results assessed the H19 and LOX expressions in clinical normal cells and glioma cancer cells
2.2 在胶质瘤细胞系中干扰和过表达H19能够影响细胞的克隆形成能力在U87⁃2M1、SW1088胶质瘤细胞中干扰H19降低细胞的克隆能力,过表达H19增加细胞的克隆能力。见图2。
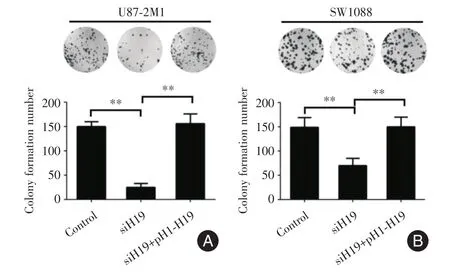
图2 胶质瘤细胞系U87⁃2M1、SW1088中干扰和过表达H19对细胞克隆形成能力的影响Fig.2 The colony formation ability was examined after intervening or over⁃expressing H19 in U87⁃2M1 and SW1088 glioma cancer cell lines
2.3 在胶质瘤细胞系中干扰和过表达H19能够影响细胞的转移能力在U87⁃2M1胶质瘤细胞中干扰H19降低细胞转移能力,过表达H19增加细胞的转移能力。见图3。

图3 胶质瘤细胞系U87⁃2M1中干扰和过表达H19对细胞转移能力的影响Fig.3 The investigation of invasiveness of U87⁃2M1 cells afterintervening or over⁃expressing H19
2.4 生物信息学预测miR⁃29b的靶基因利用生物信息学软件Starbase、TargetScan,发现H19能够结合miR⁃29b(图4),而且miR⁃29b能够潜在靶向LOX、COL1A1、COL5A1、COL3A1、COL4A5基因。见图5。

图4 LncRNA⁃H19 靶向miR⁃29b预测分析Fig4 The impact of LncRNA⁃H19 on miR⁃29b expression
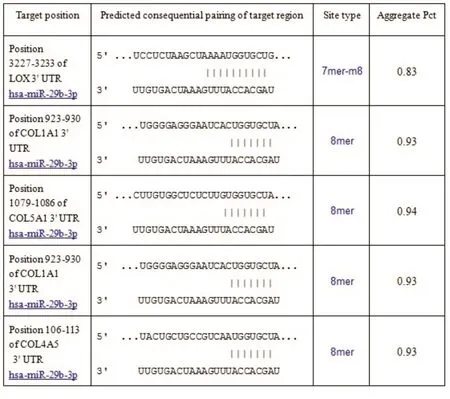
图5 miR⁃29b靶向基因预测Fig.5 The prediction of miR⁃29b targeted gene sequences
2.5 在胶质瘤细胞中干扰和过表达H19能够影响miR⁃29b的表达荧光素酶实验检测发现在胶质瘤细胞中干扰H19增加miR⁃29b的表达,过表达H19降低miR⁃29b的表达。见图6。
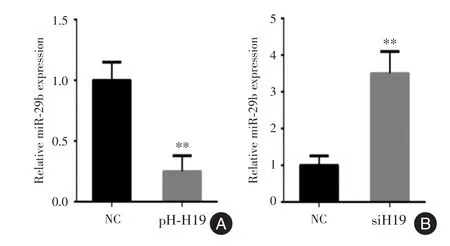
图6 过表达和干扰H19后miR⁃29b表达情况Fig.6 The expressions of miR⁃29b after overexpressing or intervening H19
2.6 在胶质瘤细胞系中干扰和过表达LOX能够影响细胞的克隆形成能力U87⁃2M1、SW1088胶质瘤细胞中干扰LOX降低细胞的克隆能力,过表达LOX增加细胞的克隆能力。见图7。
2.7 在胶质瘤细胞系中干扰和过表达LOX能够影响细胞的转移能力U87⁃2M1胶质瘤细胞中干扰H19降低细胞转移能力,过表达H19增加细胞的转移能力,见图8。
3 讨论
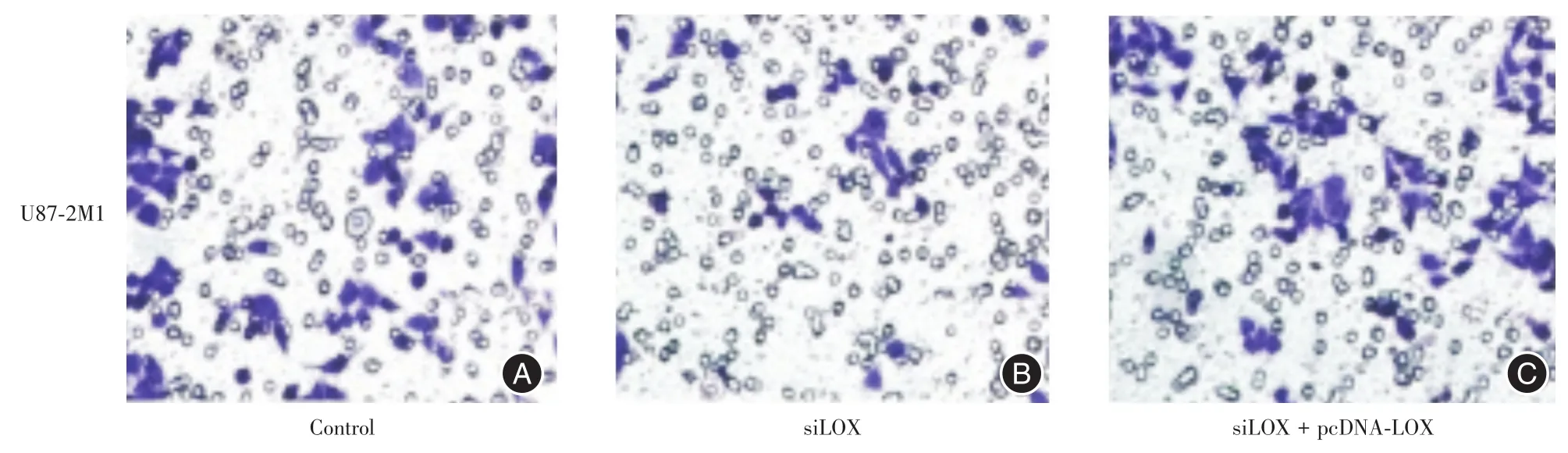
图8 胶质瘤细胞系U87⁃2M1中干扰和过表达LOX,检测细胞的转移能力Fig.8 The impact of overexpression or knockdown of LOX on the transformative ability of U87⁃2M1 glioma cancer cells

图7 胶质瘤细胞系U87⁃2M1、SW1088中干扰和过表达LOX,检测细胞的克隆形成能力Fig.7 The influence of overexpression or knockdown of LOX on the colony formation of U87⁃2M1 and SW1088 glioma cancer cells
据文献报道,中国脑胶质瘤年发病率为3~6人/10万人,年死亡人数达3万人,手术加放化疗的平均生存期仅为8~11个月[10]。根据世界卫生组织的分类系统及恶性程度,脑胶质瘤可分为Ⅰ~Ⅳ4个等级。Ⅰ和Ⅱ级胶质瘤恶性程度较低,Ⅲ和Ⅳ级胶质瘤恶性程度很高,平均生存期仅1年左右,是威胁人类生命健康最严重的恶性肿瘤之一[11-13]。目前对于胶质瘤的治疗方法包括手术治疗、化学药物治疗、放射治疗、生物治疗等。然而,预后的改善仍然较为有限[14-15]。寻找有效的神经胶质瘤分子诊断标记和分子靶点,阻断肿瘤细胞的恶性增殖和转移,提升治疗效率一直是迫切需要解决的临床课题。
本研究对临床胶质瘤标本进行检测,发现随着胶质瘤转移程度异常高表达长非编码RNA⁃H19、LOX。继而,本研究发现在U87⁃2M1、SW1088细胞系进行干扰和过表达H19、LOX,能够影响细胞的克隆形成及转移能力。表明LncRNA⁃H19、LOX在胶质瘤发生发展中发挥重要的作用。通过生物信息学预测发现H19可能直接结合miR⁃29b,LOX为miR⁃29b的潜在靶基因。同时H19能够负调控miR⁃29b的表达。本研究从临床组织水平入手,将阐明LncRNA⁃H19和miR⁃29b在正常及胶质瘤中的表达水平及相互关系,拟构建一个LncRNA⁃H19、miR⁃29b和靶基因LOX信号通路调控网络,拟揭示对胶质瘤转移的作用机制,同时过表达和敲除H19的稳定胶质瘤细胞株,可用于小鼠模型治疗实验,为胶质瘤靶点治疗提供依据。基于以上理论和前期实验结果笔者提出下面几个假设:(1)H19促进胶质瘤的发生发展和侵袭是通过结合miR⁃29b;(2)miR⁃29b靶向调节LOX基因使细胞外基质改变;(3)细胞外基质的改变介导EMT信号通路影响脑胶质瘤侵袭转移。
为了进一步验证该假设的正确性,在今后研究中深入探讨LncRNA H19/miR⁃29b/LOX信号通路调控网络在胶质瘤侵袭转移中的功能作用,并阐明其详细分子机制。本研究能进一步丰富长非编码RNA的功能作用和分子机制,为胶质瘤生物治疗提供新的理论依据和新的治疗靶点。

