瞬时受体电位离子通道A1对慢性偏头痛大鼠模型的作用及氟桂利嗪对其影响
偏头痛是临床上常见的神经系统疾患,以发作性、搏动样、单侧(或双侧)中-重度疼痛为典型临床特征,全球发病率12%左右[1]。根据其发作频率,偏头痛分为发作性偏头痛(Epidemic Migraine,EM)和慢性偏头痛(Chronic Migraine,CM)。资料显示,原发性CM罕见,多是由EM转化而来,年转化率3%左右[2]。研究证明[3],与EM相比,CM给患者本人、家庭及医疗带来更加沉重的精神和经济负担。目前关于CM的发病机制尚不十分明确。多数学者认为CM的病理生理与疼痛调节异常、中枢敏化、皮质兴奋性增高以及神经源性炎症等有关[4]。国内外研究表明[5],降钙素基因相关肽(Calcitonin gene-related peptide,CGRP)作为调节伤害性信息传导的神经活性物质之一,在疼痛调控过程中发挥重要作用,通过三叉神经血管系统参与CM的病理生理过程。CM发作期,血浆CGRP水平较正常对照组显著升高[6]。注射外源性CGRP能够诱发偏头痛发作,注射CGRP拮抗剂后可很大程度上缓解偏头痛临床症状[7,8]。近年来研究证实,瞬时受体电位离子通道A1(Transient receptor potential ankyrin,TRPA1)在痛觉产生及维持中起重要角色[9]。TRPA1可介导神经源性炎症和疼痛,诱发CGRP等物质的释放,从而引起血管通透性增加、血浆外渗及肥大细胞脱颗粒等一系列炎症反应,形成一种正反馈调节[10]。目前有关TRPA1与CM的相关性研究不足。本实验采用炎性汤(Inflammatory Soup,IS)反复刺激大鼠上矢状窦区建立CM大鼠模型,初步探讨TRPA1参与CM发生过程中的可能作用以及氟桂利嗪对其影响。
1 资料与方法
1.1 实验动物及分组 清洁级SD雄性大鼠48只(体重250~300 g),购于济南朋悦实验动物繁育有限公司。按随机数字法将SD大鼠分为正常组(A组,n=12)、假手术组(B组,n=12)、CM模型组(C组,n=12)、药物干预组(D组,n=12)。饲养于滨州医学院SPF级动物房,给予紫外线消毒后的标准颗粒和高压蒸汽灭菌水喂养,室温18~25 ℃。相对湿度50%。
1.2 主要试剂及仪器
1.2.1 主要试剂 复方致炎剂(Inflammatory Soup,IS)所含药物:5-HT、组胺、缓激肽及PGE2(美国SIGMA公司),TRPA1抗体,CGRP抗体(美国ABcam公司),对应辣根过氧化物酶标记的羊抗兔IgG抗体(博士德生物公司),Western Blot试剂盒(碧云天生物技术有限公司),Real-Time PCR试剂盒(大连宝生物技术公司),TRPA1、CGRP、GAPDH引物(上海生工生物公司)、盐酸氟桂利嗪胶囊(西安杨森制药有限公司)。
1.2.2 主要仪器 ZHRXZ柔性颅骨钻及ZH蓝星脑立体定位仪(安徽正华生物仪器设备有限公司)、低温高速离心机(德国Eppendorf公司)、酶标仪、电泳仪、湿转转膜仪(美国Biorad公司)、实时荧光定量PCR仪(罗氏公司)、微量注射器20 μl(上海高鸽工贸有限公司)、PE-10软管(浙江宁波安来软件科技有限公司)。
1.3 方法
1.3.1 慢性偏头痛大鼠模型制备 将SD大鼠用10%水合氯醛按体质量0.4 ml/100 g腹腔注射麻醉后固定于立体定位仪上,头顶正中去毛、皮肤消毒,“+”字逐层切开皮肤、肌肉,直至暴露颅骨。脑立体定位仪下定位前囟1 mm、旁开1.5 mm处钻孔,暴露上矢状窦区(Superior Sagittal Sinus,SSS),颅骨下深1 mm置入PE-10软管至SSS,牙托水泥封闭周围。经PE-10管注入5 μl灭菌生理盐水,确定药物有无外渗,然后用镊子封闭管口,逐层缝合软组织、肌肉与皮肤。术后青霉素预防感染并单笼饲养。术后恢复4 d,5 d始经PE-10软管脑膜给药。C组、D组大鼠参考Oshinsky[11]法给予IS,20 μl/次,3次/w,共9次,联合硝酸甘油(GTN)10 mg/kg皮下注射,1次/w,共3次复制慢性偏头痛大鼠模型。D组大鼠术后4 d始腹腔注射氟桂利嗪1次,术后5 d~3 w每日依次给予氟桂利嗪及IS(注射氟桂利嗪30 min后再注射IS),氟桂利嗪溶解在生理盐水中,现用现配,10 ml/kg腹腔注射。B组大鼠以0.01 mol/L灭菌生理盐水代替IS及GTN。A组大鼠不做任何处理,自由饮食。注:以上所有操作均在无菌环境中进行,操作环境安静、动作轻柔、避免强光刺激,室温保持在25 ℃左右。
1.3.2 行为学观察及疼痛阈值测定 行为学观察:注射IS或灭菌生理盐水后将大鼠置于安静环境,1 h后观察并记录大鼠挠头、打转、及爬笼次数。评分标准如下:挠头(10次记1分,每增加1次加0.1分)、打转(2次记1分,每增加1次加1分)、爬笼(3次记1分,每增加1次加1分)。注:1 h内评分≥6为成功模型。
疼痛阈值测定:参照Oshinsky[11]法测定大鼠机械刺激缩足反应阈值(Paw withdrawal mechanical threshold,PWMT)。各组大鼠分别在注射IS 1 d后测定PWMT。安静环境中,用电子Von Frey测痛仪刺激大鼠足底部,记录引出大鼠缩足反应的刺激强度,重复测量3次,每次间隔15 s,取其平均值作为所测PWMT。注:以埋管前1 dPWMT作为基础值。
1.3.3 Elisa检测CGRP水平 颈外静脉取血2 ml注入预冷的试管中,每毫升血液加入10%Na EDTA15 μl并混合均匀,3000 r/min离心10 min后取上清液置于冰箱保存。按照Elisa试剂盒说明检测各组大鼠血清中CGRP水平,再根据标准品的浓度及对应的吸光度(OD)值在回归方程上计算出对应的样品浓度。
1.3.4 Western Blot测定蛋白浓度 大鼠给药1.5 h过深麻醉后冰上处死取硬脑膜、TG及TNC组织,分别置于玻璃匀浆器中,加入裂解液和蛋白酶抑制剂研磨均匀,将裂解的液体以12000 r/min 4 ℃离心5 min,取上清,放入-80℃冰箱保存备用。按照BCA法测定蛋白浓度,加蛋白上样缓冲液,100 ℃煮沸5 min,-80 ℃冰箱保存。配置SDS-PAGE胶。每个样孔中加入40 μg蛋白样品,同时加低分子量标准蛋白Marker5μl为对照进行电泳,电泳结束转到PVDF膜,200 mA 2 h后转膜结束。TBST洗膜后,5%脱脂奶粉封闭液37 ℃下封闭2 h。弃封闭液后TBST洗膜,加一抗稀释液(TRPA1 1∶2000,CGRP1∶500)和GAPDH(1∶3000)作为内参对照,4℃孵育过夜。TBST洗膜后加二抗(1∶5000),37 ℃恒温孵育2 h。TBST洗膜,显影、定影、曝光,Image J软件分析可视带的吸光度值(A值),结果以目的蛋白A值与内参蛋白A值的比值表示。
1.3.5 Real-Time PCR检测TTPA1、CGRP表达 大鼠给药1.5 h过深麻醉后冰上处死取硬脑膜、TG及TNC组织。将组织分离干净后置入-80 ℃冰箱保存备用。按照试剂盒说明提取总RNA,进行RNA沉淀清洗及溶解。然后进行逆转录成cDNA:在20 μl的反应体系中,加入4 μl 5×PrimeScript Buffer,1 μl PrimeScript RT Enzyme Mix I,1 μl Oligo dT Primer(50 μmol/L),1 μl Random 6 mers(100 μmol/L),每个反应体系用RNase Free d H2O补足至20μl,在反转录条件下(37 ℃,15 min;85 ℃,5 s) 完成后置于-20 ℃冰箱保存备用。参考大鼠TRPA1、CGRP受体cDNA序列进行特异性引物设计,选用GAPDH作为内参对照。TRPA1上游引物序列:5’-CTC CCC GAG TGC ATG AAA GT-3’,下游引物序列:5’-TGC ATA TAC GCG GGG ATG TC-3’;CGRP上游引物序列:5’-TCC TGG TTG TCA GCA TCT TG-3’,下游引物序列:5’-CTC AGC CTC CTG TTC CTC CT-3’;GAPDH上游引物序列:5’-GTT CCT ACC CCC AAT GTG TCC-3’,下游引物序列:5’-TAG CCC AAG ATG CCC TTC AGT-3’。PCR扩增:在25 μl的反应体系中加入SYBR®Premix Ex TaqII(Tli RNaseH Plus)(2×),PCR Forward Primer(10 μmol/L),PCR Reverse Primer(10 μmol/L),DNA模板(<100 ng),dH2O。每个基因做三个复孔,放入扩增仪中进行扩增。以GAPDH作为内参对照,采用2-△△CT法进行相对定量分析。

2 结 果
2.1 行为学观察 行为学评分结果示:A、B组大鼠行为学评分均 <6分,前后差异无统计学意义(P>0.05);C组大鼠行为学评分≥6分,表示CM大鼠模型建立成功。与A、B组大鼠相比,大鼠挠头、打转及爬笼次数明显增多,差异有统计学意义(P<0.05);与C组相比,D组大鼠行为学评分降低,差异有统计学意义(P<0.05)。各组行为学评分(见图1)。
2.2 疼痛阈值测定 相同条件下测定PWMT,结果显示:各组大鼠PWMT基础值无明显差异,差异无统计学意义(P>0.05)。与A、B组相比较,C组大鼠PWMT测定值明显降低,差异有统计学意义(P<0.05);D组大鼠较C组大鼠PWMT测定值增高,差异有统计学意义(P<0.05)。各组大鼠PWMT测定结果(见图2)。
2.3 各组织CGRP表达 通过Elisa技术检测大鼠颈外静脉血中CGRP表达,采用PCR、Western-Blot技术检测大鼠硬脑膜、TG及TNC组织部位中CGRP表达。结果显示:与A、B组相比较,C组大鼠CGRP表达量明显上调,差异有统计学意义(P<0.05);与C组相比较,D组大鼠CGRP表达下调,差异有统计学意义(P<0.05)。各组CGRP表达情况(见图3~图5)。
2.4 各组织TRPA1表达 采用PCR、Western-Blot技术检测大鼠硬脑膜、TG及TNC组织部位TRPA1表达情况。结果显示:与A、B组相比,C组大鼠各组织部位TRPA1表达均上调,差异有统计学意义(P<0.05);与C组大鼠相比,D组大鼠各组织部位TRPA1表达均下调,差异有统计学意义(P<0.05)。各组织部位TRPA1表达情况(见图6、图7)。

与A、B组相比较,C组P<0.05

与A、B组相比,C组P<0.05;与C组相比,D组P<0.05
图2 大鼠机械刺激缩足反应阈值(n=12)

与A、B组相比,C组P<0.05;与C组相比,D组P<0.05
图3 各组大鼠CGRP血浆含量(n=12)
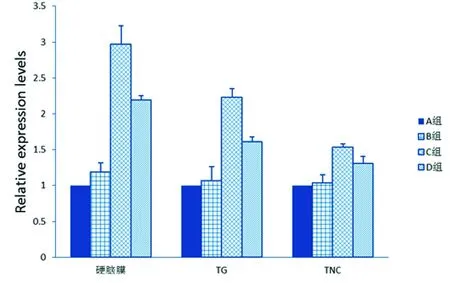
与A、B组相比,C组P<0.05;与C组相比,D组P<0.05
图4 各组大鼠硬脑膜、TG及TNC部位CGRP基因的相对表达量(n=12)
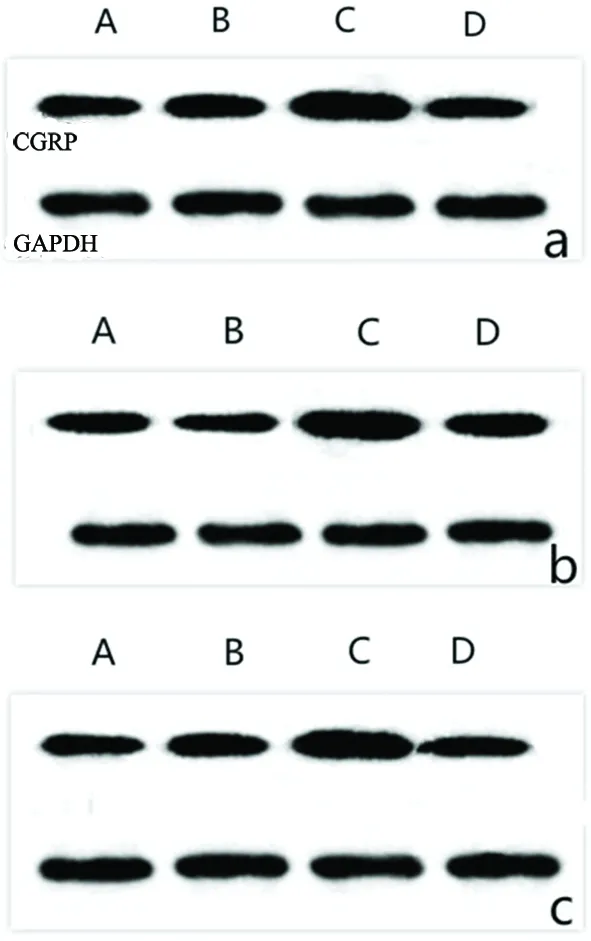
图5 WB检测各组大鼠硬脑膜、TG及TNC部位CGRP表达变化(a:硬脑膜b:TG c:TNC)

图6 各组大鼠硬脑膜、TG及TNC部位TRPA1表达(a:硬脑膜b:TGc:TNC)

图7 WB检测各组大鼠硬脑膜、TG及TNC部位TRPA1表达(a:硬脑膜b:TG c:TNC)
3 讨 论
流行病学显示,CM在偏头痛人群中占比8%,普通人群患病率1%~3%[2,12]。临床上原发性CM罕见,多由EM转化而来。关于CM的发病机制尚不明确,故针对于CM有效的预防和治疗方法暂缺。
目前,多数研究认为CM涉及三叉神经血管系统(trigenmi-novascular system,TVS),三叉神经初级传入神经支配脑膜血管,其传出投射纤维与TNC的二级神经元联系,TNC的传出纤维投射到中脑导水管周围灰质,可通过上行纤维投射到丘脑的三级神经元,也可通过下行纤维调控伤害性痛觉信息的传递[13]。临床研究表明,偏头痛发作期间血清CGRP水平升高,且发作持续时间和疼痛程度与血清CGRP水平呈正相关关系[14]。研究发现CGRP可作为CM生物标记物之一[15]。CGRP是目前最为强大的内源性舒血管物质,是CM发作的关键因素。CGRP可引起血管通透性增加、血浆蛋白外渗以及肥大细胞脱颗粒等一系列炎症反应,同时刺激各种炎症介质释放和聚集,形成一种正反馈调节机制,最终诱发偏头痛发作,随着偏头痛反复发作,发作间期逐渐缩短,头痛愈演愈烈并慢性转化为CM[16]。
近年来,瞬时感受器离子通道蛋白(Transient receptor potential ion channel protein,TRPs)在化学感受纤维中的作用备受国内外学者关注。TRPA1是TRPs家族中的一员,主要存在于脊髓背根神经、三叉神经及迷走神经的初级神经元[9]。TRPA1受到低温、化学物质刺激后,离子通道开放,Ca2+电流形成内向电流,引发一系列反应,参与温度及化学所致的痛觉形成[17,18]。研究表明,TRPA1可介导由细菌内毒素导致的急性神经源性炎症和疼痛,该研究显示,急性神经源性炎症致使CGRP释放增多,由于TRPA1通道激活所致[19]。TRPA1通道在炎症中起“增效剂”作用,免疫组化及原位杂交研究证实,36%的三叉神经细胞表达TRPA1,且多数TRPA1同时也表达CGRP和P物质[20]。Bautista[21]用基因敲除法证明TRPA1在疼痛中占主导地位,对于野生型大鼠和TRPA1剔除的幼鼠进行疼痛行为学测试发现,TRPA1剔除的幼鼠在注射TRPA1后疼痛反应明显降低。综上可知,TRPA1受体参与疼痛的感受和传递,在疼痛的产生和维持中扮演重要角色,在痛觉敏感性增强的病理过程中发挥作用。最新研究发现[22],TRPA1激活后导致偏头痛主要血管活性物质CGRP的释放。TRPA1通道敏化,在GTN作用后活化促进神经元去极化,引起CGRP、缓激肽及5-羟色胺等神经肽的合成和释放;另一方面,促炎性因子通过TRPA1通道激活和/或敏化痛觉感受器,从而引起神经肽的释放[23,24]。TRPA1通道激活诱导CGRP从三叉神经细胞和硬脑膜释放,刺激脑膜血管扩张。此外,TRPA1激动剂引起三叉神经核二级神经元激活,表明其在诱发疼痛中起作用[25,26]。
本实验通过观察大鼠挠头、打转及爬笼等行为学表现进行评分(行为学评分≥6)来评定CM大鼠模型建立成功。结果显示:与正常组和假手术组相比,CM大鼠挠头、打转及爬笼次数明显增多,评分明显升高,同时PWMT测定值明显降低,表明CM模型建立成功。氟桂利嗪干预组大鼠挠头、打转及爬笼次数减少,行为学评分减少,同时PWMT测定值升高,我们推测氟桂利嗪在CM的预防治疗中起作用。本实验研究结果显示:与正常组和假手术组相比,CM组大鼠硬脑膜、TG及TNC组织中CGRP表达量明显上调;氟桂利嗪干预组大鼠受到药物作用后,硬脑膜、TG及TNC组织中CGRP表达量下调,差异有统计学意义。我们推测CGRP在大鼠CM发作期间表达水平升高,氟桂利嗪可影响其表达。同时实验显示,与正常组和假手术组大鼠相比,CM组大鼠硬脑膜、TG及TNC组织中TRPA1表达量上调。氟桂利嗪干预组大鼠硬脑膜、TG及TNC中TRPA1表达下调,差异有统计学意义。我们推测TRPA1受体参与CM发生发展过程,氟桂利嗪可下调其表达,从而在CM预防治疗中发挥作用。综上,大鼠CM发作期间,CGRP及TRPA1表达均上调,氟桂利嗪干预后表达均下调,CGRP与TRPA1表达变化一致,我们分析TRPA1受体与CGRP之间存在重要联系,可能存在共同通路参与CM的发生和维持。我们推测,在炎性介质作用下,TRPA1通道开放,诱导CGRP这一强有力舒血管物质释放,从而引起一系列炎症反应,最终导致CM发作且愈演愈烈。
氟桂利嗪是唯一一个能够通过血脑屏障的L型钙离子拮抗剂,在偏头痛预防治疗方面具有肯定疗效。研究表明,氟桂利嗪可通过阻断三叉传入感觉神经元电压门控钠、钙电流,从而抑制其兴奋性,可能是预防偏头痛机制之一[27]。从本实验结果看来,与CM大鼠相比,氟桂利嗪干预组大鼠挠头、打转及爬笼次数减少,行为学评分降低,PWMT测定值升高。从CGRP与TRPA1表达变化情况来看,该组大鼠硬脑膜、TG及TNC组织中CGRP和TRPA1表达均下调。我们分析氟桂利嗪可能是通过影响TRPA1受体表达,导致大鼠硬脑膜、TG及TNC中CGRP释放减少,从而在CM的预防治疗中发挥作用。本实验以TRPA1受体及CGRP为契机进行CM相关研究,可能会对CM领域提供新的实验依据和靶点。

