镉暴露上调HMOX1表达的启动子相关活化区域鉴定
时红杰,薛 洁,时志康,王传付,芈 静
(1.蚌埠医学院 流行病与卫生统计学教研室;2.蚌埠医学院第二附属医院 检验科,安徽 蚌埠 233040;3.蚌埠医学院 安徽省感染与免疫重点实验室,安徽 蚌埠 233030)
微量元素镉(Cd,cadmiumCd)广泛存在于土壤和水体中,高水平的Cd主要存在于锌矿和磷矿中.Cd2+易从土壤和水中吸收而蓄积在动植物中,人通过食物而摄入重金属Cd2+.一项针对具有吸烟史女性的研究发现Cd2+可以蓄积在女性子宫内膜而导致女性生殖系统疾病[1].低水平Cd2+长期暴露是细胞形成肿瘤的原因之一[2].
HMOX1是亚铁血红素代谢为胆绿素、CO和Fe2+的限速酶.通过其代谢产物胆绿素、CO和Fe2+的作用,HMOX1起到抗炎、抗氧化、抗增殖和抗凋亡的保护作用[3].本文着重研究Cd2+处理HeLa细胞中,鉴定调控HMOX1转录的启动子活化区域,为后续鉴定调控HMOX1表达的转录因子及其信号通路提供基础,以期为子宫细胞相关疾病发病机制的理解提供理论依据.

表1 引物序列
1 材料和方法
1.1 材料
HeLa为本实验室保存的细胞.PGL6(D2102),pRL-SV40-N(D2762)购自碧云天生物.β-Actin(13E5)和 HMOX1(P249)购自Cell Signaling.
1.2 报告基因的构建及鉴定
具有共同下游3'末端和不同5'末端的启动子序列克隆进报告基因载体PGL6,双酶切初步鉴定后测序鉴定.
1.3 实验方法
1.3.1 细胞培养、处理和转染:用含10%胎牛血清的DMEM培养基,于 37℃、5%CO2培养箱中 HeLa.用 50μM Cd2+处理细胞:用脂质体共转染报告基因和内参基因.
1.3.2 RT-PCR和免疫印迹:提取总RNA并逆转录成cDNA,按下面的循环条件做RT-PCR:94℃预变性2min,94℃变性 30s,60℃退火 5s,72℃延伸 30s,共 30 个循环,72℃延伸10min.提取总蛋白进行SDS-聚丙烯酰胺凝胶电泳,经转膜后封闭,4℃过夜孵育一抗,洗涤后孵育二抗,洗涤后显影.
1.3.3 报告基因测定:HeLa转染目的和内参报告基因24h后,用50μM Cd2+处理12h,用室温PBS洗一遍,按照双荧光报告基因测定试剂盒的说明测定报告基因活性.
1.4 统计学分析
应用spss16.0进行统计分析,组间比较用方差分析LSD法,检验水准α=0.05.
2 结果
2.1 Cd2+上调HeLa细胞HMOX1基因表达
和对照组相比,50μM Cd2+处理的 HeLa显著上调HMOX1 mRNA的表达(图1A、B).免疫印迹显示,和HMOX1 mRNA的变化趋势相一致,Cd2+处理的HeLa细胞HMOX1蛋白水平显著上调(图1 C、D).

图1 Cd处理HeLa细胞HMOX1表达变化
2.2 HMOX1系列启动子报告基因的构建和鉴定
设计HMOX1特异性引物扩增启动子-846~+92片段,以此片段为模板扩增具有相同3'末端而5'末端不同的启动子片段,克隆到报告基因载体pGL6,酶切和测序鉴定HMOX1启动子序列的正确性(图2 A、B).
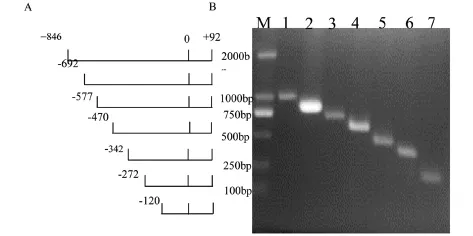
图2 HMOX1启动子构建策及PCR电泳图
2.3 HMOX1启动子活化区域
HMOX1系列启动子报告基因分别和内参报告基因共转染HeLa细胞24h后,50μM Cd2+处理12h后测启动子片段相对荧光素酶活性(图3).和HMOX1-272~+92启动子相对活性相比,HMOX1-120~+92片段相对活性显著降低,说明HMOX1启动子片段-272~-120区域存在激活性转录因子结合位点;和 HMOX1-577~+92启动子活性相比,HMOX1-692~+92和 HMOX1-470~+92活性显著升高(P<0.05),说明HMOX1启动子片段-692~-577和-577~-470分别存在激活性和抑制性转录因子结合位点.
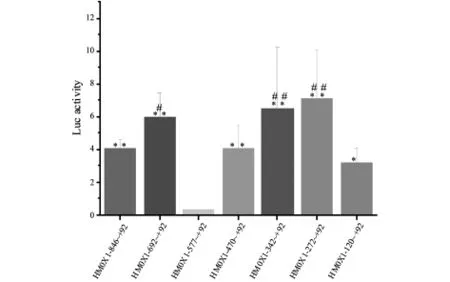
图3 Cd2+处理的Hela细胞中HMOX1启动子活性 2次独立实验,每次3个重复的相对荧光素酶活性的均数±标准差
3 讨论
Cd是人体非必需重金属,通过置换蛋白质的结合金属离子,一方面使蛋白质失去金属辅酶而失去正常功能,另一方面通过Fenton反应间接产生活性氧自由基而损伤细胞;而且,Cd2+也能直接结合蛋白质的巯基导致蛋白质功能异常[4].Cd2+处理HeLa细胞中,HMOX1 mRNA和蛋白表达水平均显著上调,与其他组的研究结果相一致[5,6].
多种因素通过不同的机制调控抗氧化酶HMOX1的转录调控.牛磺酸氯胺通过激活巨噬细胞系RAW264.7转录因子Nrf2核转位,促进抗氧化酶HMOX1表达[7].静息状态下,转录因子Bach1/Maf复合物结合HMOX1增强子Maf识别元件MARE而抑制HMOX1基因转录;亚铁血红素heme和Bach1结合使Bach1从Bach1/Maf复合物中解离,激活性转录因子Nrf2和Maf的复合物Nrf2/Maf促进HMOX1基因转录[8].内皮细胞中,miR-155通过抑制转录抑制因子Bach1的翻译而抑制HMOX1的表达.
HMOX1启动子微卫星序列(GT)n二核苷酸重复序列调控启动子活性,短(GT)n比长(GT)n活性更高,短(GT)n是吸烟者慢性肺气肿发生的重要危险因子[9].HMOX1启动子SNP-413A>T显著降低 HMOX1启动子活性,HMOX1-413A/A基因型和女性高血压高发生率相关[10].但Ono等人发现HMOX1-413A/A基因型降低缺血性心脏病发生率[11].
为了鉴定HeLa细胞中HMOX1基因Cd2+刺激特异性的转录因子及其结合位点,我们构建HMOX1基因具有共同下游末端的系列启动子载体.报告基因结果显示,和HMOX1-272~+92 相对荧光活性相比,HMOX1-120~+92 相对荧光活性显著降低,说明HMOX1启动子-272~-120片段存在激活性转录因子结合位点.序列分析发现,HMOX1-272~-120 片段内存在一个(GT)n,可能该序列是HMOX1-272~-120片段内激活转录因子结合位点,该特异性转录因子有待进一步鉴定.
和HMOX1-577~+92相对荧光活性相比,HMOX1-470~+92相对荧光活性显著升高,说明HMOX1-577~-471片段内存在抑制性转录因子结合位点;和HMOX1-692~+92相对荧光活性相比,HMOX1-577~+92相对荧光活性显著降低,说明HMOX1-692~-578片段内存在激活性转录因子结合位点.用gene-regulation.com网站的Patch 1.0程序的默认设置预测转录因子及其结合位点,发现HMOX1-577~-471片段上有c-Maf结合位点,没有Nrf2和Bach1结合位点;HMOX1-692~-578片段上没有 Maf、Nrf2和 Bach1结合位点.
总之,在Cd2+处理HeLa细胞模型中,HMOX1 mRNA与蛋白水平显著上调;HMOX1 启动子 -692~-577、-577~-470和-272~-120片段内存在调控HeLa细胞HMOX1基因转录的特异的抑制性或激活性转录因子结合位点.后续我们用实验并结合转录因子预测进一步鉴定调控HeLa细胞HMOX1基因转录的特异启动子结合模序及其转录因子.

