黄芩苷铬(Ⅲ)配合物稳定常数的测定
张换平,杜 慧,刘香健,王 芳,李安林
(安阳工学院 化学与环境工程学院,河南 安阳 455000)
0 引言
黄芩苷是中药黄芩的有效成分之一,具有清热、解毒、抗菌、利胆等药理作用[1,2].其5位酚羟基和4位羰基具有很强的螯合能力, 可与金属离子形成稳定的配合物.有关黄芩苷与金属离子配位作用的研究工作,主要以药理学、生物手段为主[3],关于黄芩苷与金属离子配合物的理化性质方面的研究则是鲜见报道,本文以黄芩苷与铬离子反应为例,对黄芩苷配合物的稳定性进行研究.在测定中主要借助pH电位滴定法描述黄芩苷-Cr(Ⅲ)配合物的配位反应过程,通过生成函数的截距法计算该配合物的逐级条件稳定常数,自2006年邓毅等[4]首次合成黄芩苷-铬(Ⅲ)配合物并对其进行表征以来,对于该配合物的稳定常数的报道至今仍是缺憾,因此采用一定的方法对该配合物的条件稳定常数进行测定,将对类似于黄芩苷-Cr(Ⅲ)配合物的配合物的各级条件稳定常数的测定,本文的测定方法有一定的借鉴作用,可为以后研究黄芩苷金属离子配合物的理化性质提供一定的理论依据.
1 实验部分
1.1 仪器与试剂
离子计,雷磁PXSJ-216型 精度0.005;pH玻璃电极,雷磁231-01型;饱和甘汞电极,雷磁232-01型;蠕动泵,BS100-1AQ;双壁恒温滴定仪,自制;C8H5KO4、CrCl3·6H2O、KNO3:分析纯;实验用水为Ⅰ级纯水;5.6 mmol/L氢氧化钾标准溶液,邻苯二甲酸氢钾标定;5.0 mmol/L Cr3+溶液;1.6 mmol/L黄芩苷溶液,生化试剂配制,氢氧化钾溶液标定.
1.2 实验方法
实验前,首先将玻璃电极进行活化,然后再用标准缓冲溶液进行校正.
准确吸取10 mL黄芩苷溶液,8 mL KNO3溶液,用纯水定容至50 mL,均匀混合,在温度为30 ℃,高纯N2环境下,用已知浓度的KOH标准溶液通过蠕动泵控制滴定速度(0.33 mL/min)对该溶液进行滴定,滴定采用REXDC1.1雷磁数据采集软件,每5 s自动记录实验数据,平行测定3次,取平均值.
准确吸取10 mL黄芩苷溶液,8 mL KNO3溶液,0.64 mL Cr3+溶液,用纯水定容至50 mL,均匀混合后重复前边的滴定操作.
2 方法原理
从分子结构上分析,黄芩苷为多元酸,但采用pH电位在滴定分析时只能检测到前两二步解离:
在滴定分析中黄芩苷可按二元酸处理(H2A),其分子结构见图1.
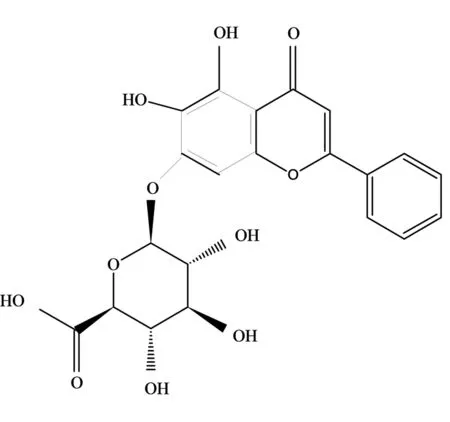
图1 黄芩苷分子结构示意图Fig. 1 Structure of baicalin
当向黄芩苷溶液中加入一定量的铬离子溶液,则会有下列配位反应发生:
Cr3++HA-=CrA++H+,
通过配位反应的进行,HA-中的H+被释放出来,其量与生成的黄芩苷铬配离子的量相当.当用碱标准溶液分别滴定黄芩苷溶液及其和铬离子的混合溶液时,对于滴定过程中相同的溶液pH值,黄芩苷和铬离子混合液要比黄芩苷溶液消耗氢氧化钾溶液多,消耗多的原因是由于中和配位反应释放出的氢离子的缘故,在该pH值下已发生配位反应的黄芩苷的物质的量可用多消耗的氢氧化钾的物质的量表示[6,7].即
(1)
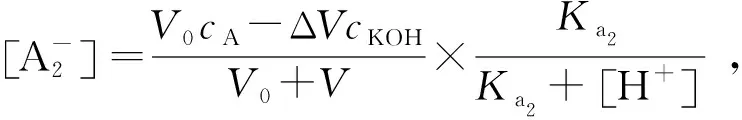
(2)
其中:V0是黄芩苷与铬离子构成的混合溶液的初始体积,mL;cKOH是加入前氢氧化钾溶液的浓度,mol/L;V是加入的氢氧化钾溶液的体积,mL;[H+]是相对应溶液的氢离子浓度,mol/L;ΔV是在相同的溶液pH值,黄芩苷与铬离子混合溶液多消耗的碱溶液的体积;
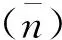
(3)
其中:TCr是指碱标准溶液加入V体积时Cr3+总浓度.
根据生成函数与配合物各级累积稳定常数之间的数学关系及黄芩苷与铬离子配位的最大配位数为2[4],则存在
(4)
则有
整理后可得到
(5)
令
则上式可转化为
y=KCrA1KCrA2x-KCrA1.
(6)
3 结果与讨论
3.1 电位滴定曲线
在滴定过程中,溶液的pH值读数稳定且溶液澄清透明,说明在操作过程中Cr3+未水解发生.实验测得黄芩苷及其与铬离子体系的电位滴定曲线如图2所示,曲线A为黄芩苷的滴定曲线,曲线B为黄芩苷与Cr3+的混合溶液的滴定曲线,从图中可以看出,随着滴定加入的KOH溶液量的增加,A、B曲线的pH值都发生了变化,且曲线B的pH变化量小于曲线A,说明黄芩苷与铬离子发生了配位反应,当加入的KOH溶液到一定体积时,两溶液的pH值均不发生显著的变化,出现这种现象的原因可能是两溶液的酸性被完全中和的缘故[8].

图2 滴定曲线(曲线A为黄芩苷的滴定曲线,曲线B为黄芩苷与Cr3+的混合溶液的滴定曲线)Fig. 2 The titration curve(The curve A is the titration curve ofbaicalin, and the curve B is the titration curve ofmixed solution of baicalin and Cr3+)
3.2 生成函数的截距法
y=1.85×1015x-2.32×108,R=0.9902.
由y轴及x轴截距可以求出:
KCrA1=2.32×108,KCrA2=7.97×106.

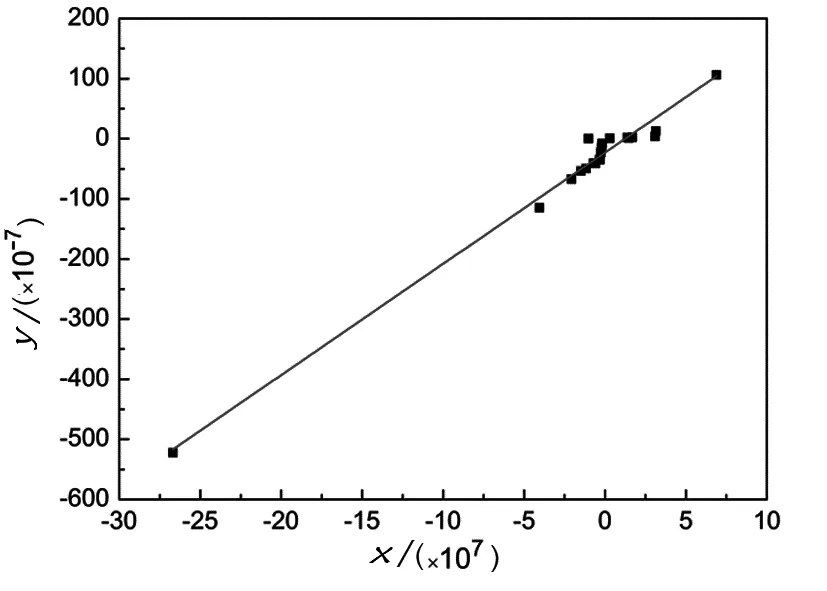
图3 截距法作图Fig. 3 The graphical of intercept method
3.3 黄芩苷与Cr3+配合物的物种分布
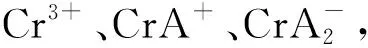

图4 不同pH值下黄芩苷与Cr3+配合物形态分布图Fig. 4 The species distributions of the Cr(III)-complexeswith baicalin under different pH value
4 结论


