黄酒中生物胺对小鼠胺类氧化酶和免疫功能的影响
周玮忻,伍梓汐,万 群,程如越,沈 曦,李 鸣,张 明,陈历水,刘 蕾,何 方*
(1.四川大学 华西公共卫生学院,四川 成都 610041;2.北京工商大学 食品学院,北京 100048;3.中粮营养健康研究院 食品研发中心,北京 100020)
黄酒是我国特有的低度饮料酒,距今已有5 000多年的历史,与啤酒、葡萄酒统称为世界三大酿造酒。黄酒中有丰富的氨基酸、多酚和低聚糖等活性物质,能增强机体免疫力、抗氧化、保护心血管等,但大量的氨基酸可能导致发酵过程微生物作用而产生生物胺(biogenic amine,BA)[1-2]。
生物胺是一类含氮碱性化合物,黄酒中的生物胺主要包括酪胺、组胺、腐胺、尸胺、β-苯乙胺、色胺、精胺等[3]。少量生物胺具有一定的生理功能,但机体摄入高生物胺含量的食品或不充分代谢会导致生物胺积累,引起血压升高、头痛、心悸等毒性作用[4-5]。发酵食品中的生物胺主要由某些微生物产生的氨基酸脱羧酶而成,正常情况下,哺乳动物肠道内有单胺氧化酶(monoamine oxidase,MAO)、二胺氧化酶(diamine oxidase,DAO)和多胺氧化酶等代谢生物胺的解毒酶系统,但遗传导致胺类氧化酶缺乏或外界因素引起胺类氧化酶活性降低,均会增加人体对生物胺的敏感性。有研究称低于10%的乙醇含量可以增加脱羧酶的活性,而12%的乙醇还会抑制91%的胺类氧化酶活性[6-8],同时乙醇还会增大小肠壁吸收生物胺的通透性,所以酒精饮料中更应注重生物胺的含量及其毒性作用。黄酒中生物胺含量远高于葡萄酒和啤酒[9-10],虽然有很多关于黄酒中生物胺含量的测定研究,但由于不同生物胺有不同的毒性以及它们之间的相加和协同作用、机体解毒酶活性、个体差异等,生物胺的毒性阈值很难确定[11],目前还没有国家出台黄酒中生物胺的限量标准。
随着生活水平的提高和消费者自我保护意识的增强,人们对食品安全的要求越来越高。通过对受试小鼠单胺氧化酶、二胺氧化酶活性的测定和免疫因子的检测,对黄酒及生物胺的安全性进行探讨,初步评估黄酒及其生物胺对机体产生的影响,为规范黄酒生产工艺和生物胺含量提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
黄酒由北京中粮集团有限公司提供,酒精度为19.55%vol,总生物胺含量为106.24 mg/L,最高的三种分别是腐胺45.62 mg/L、色胺33.81 mg/L、酪胺15.79 mg/L,-4℃保存。
1.1.2 实验动物
无特定病原体(specific pathogenfree,SPF)级雄性昆明种小鼠,60只,4周龄(体质量18~20 g),购于四川省医学科学院/四川省人民医院实验动物研究所[许可证号:SCXK(川)2013-15]。昆明小鼠于本校动物实验中心适应性喂养一周,标准环境喂养,自由饮水和摄食。
1.1.3 主要试剂
腐胺、色胺、酪胺标准品:美国Sigma公司;单胺氧化酶、二胺氧化酶、蛋白定量测试盒均来自南京建成生物工程研究所;免疫因子检测试剂盒:R&D公司Luminex Assay系列(96孔)。
1.2 仪器与设备
Chemray 240全自动生化分析仪:深圳雷杜生命科技有限公司;752型紫外可见分光光度计:上海光谱仪器有限公司;VCX 130超声波细胞破碎仪:SONICS公司;CX31光学显微镜:日本OLYMPUS公司;Luminex LX-200分析仪:R&D公司。
1.3 实验方法
1.3.1 动物分组及给药方法
实验动物随机分为3个对照组(空白对照组、酒精对照组、BA对照组)和3个实验组(黄酒组、黄酒+9倍BA组、黄酒+99倍BA组),每组10只。每日每只的灌胃量如下:
空白对照组灌胃0.2 mL生理盐水;酒精对照组的灌胃量根据中国居民膳食营养素参考摄入量(2016版)中成人(60 kg)每日最高可摄入的酒精量(30 g)换算,以0.5 mg/g小鼠体质量(以下表示为mg/g)的酒精进行灌胃;黄酒组与酒精对照组具有相同的酒精灌胃量,以2.56 mg/g的黄酒进行灌胃;BA对照组与黄酒组具有相同的腐胺、色胺、酪胺灌胃量,以腐胺1.23×10-4mg/g+色胺8.86×10-5mg/g+酪胺4.29×10-5mg/g进行灌胃;黄酒+9倍BA组是以9倍BA对照组的生物胺剂量添加到与黄酒组同剂量的黄酒中;黄酒+99倍BA组是以99倍BA对照组的生物胺剂量添加到与黄酒组同剂量的黄酒中。
小鼠每周称质量一次,根据体质量变化每周更换一次灌胃试剂量,以水为溶剂,保证灌胃量均为0.2 mL/(只·d),连续灌胃30 d。
1.3.2 取材及检测
受试小鼠于第30天灌胃后,禁食不禁水。12h后用眼球摘除法取血,置于离心管,室温静置1 h后,3 000 r/min离心10 min分离血清,取上清液,再以3 000 r/min,1 min进行二次离心,收集上清液于-80℃冰箱保存备用。小鼠脱颈处死后,迅速解剖腹部和头部,取肝大叶中心部位,用生理盐水冲洗,放入4%中性多聚甲醛固定24 h,制作石蜡切片,并用苏木精-伊红(HE)染色,在光学显微镜下观察;同时将大脑、小肠和剩下的肝脏冻存于-80℃冰箱待检。
根据二胺氧化酶测试盒的说明书进行操作,用全自动生化分析仪检测血清和小肠组织中DAO活性;参照蛋白定量测试盒和单胺氧化酶测试盒的说明书操作,用紫外可见分光光度计检测肝脏和大脑中MAO活性。参照Luminex Assay免疫因子测试盒操作,用LuminexLX-200分析仪测定血清的白细胞介素(interleukin,IL)-12、IL-1β、IL-2、IL-4、IL-6、IL-10、IL-17A、肿瘤坏死因子(tumor necrosis factor,TNF)-α和干扰素(interferon,IFN)-γ。
1.3.3 数据处理与分析
采用SPSS 22.0对数据进行统计分析,对于符合方差分析条件的数据,结果用x¯±s表示,多组间比较采用单因素方差分析(两两比较采用SNK法或LSD法);对于分布不明的数据,结果用中位数(四分位数间距)表示,多组间比较采用非参数检验Kruskal-Wallis单因素方差分析。当P<0.05时,差异有统计学意义。
2 结果与分析
2.1 小鼠的胺类氧化酶活性
2.1.1 小鼠大脑、肝脏MAO活性
正常情况下,单胺氧化酶是一类黄素蛋白,主要分布于肝、脑等器官的线粒体中,能够选择性催化生物胺和神经递质的代谢[12]。MAO在脑神经组织中积累过多,就会产生过量的胺代谢产物,而这些产物被认为是引起各类精神疾病的重要原因[13]。早有报道[14-15]指出,MAO可作用于中枢系统和神经末梢组织,其活性异常可能与帕金森氏病、抑郁、阿尔茨海莫氏症等疾病相关,所以MAO活性可反映机体生理状态。各组小鼠大脑和肝脏MAO活性的测定结果见表1。
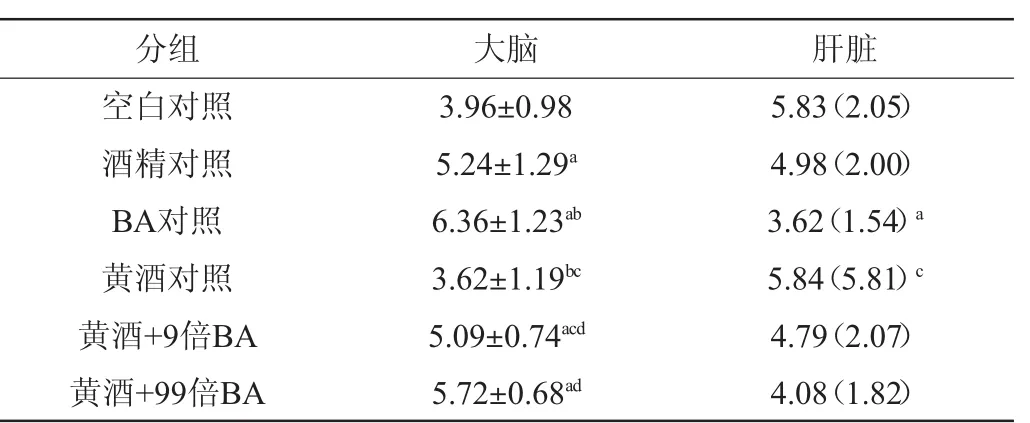
表1 各组小鼠大脑和肝脏单胺氧化酶活性的测定结果Table 1 Determination results of monoamine oxidase activities of brain and liver in the tested mice U/mg
由表1可知,酒精对照组和BA对照组的大脑MAO活性均高于空白对照组(P<0.05),黄酒+9倍BA组和黄酒+99倍BA组大脑MAO活性均高于黄酒对照组(P<0.05),而黄酒对照组与空白对照组大脑MAO活性的差异无统计学意义(P>0.05);黄酒对照组大脑MAO活性低于酒精对照组(P<0.05),而黄酒+9倍BA组和黄酒+99倍BA组与酒精对照组的大脑MAO活性差异无统计学意义(P>0.05),推测酒精和生物胺单独作用均引起大脑MAO升高,黄酒可能对低剂量生物胺和酒精引起的大脑MAO活性升高具有一定的保护作用,当黄酒中生物胺含量达到10倍和100倍时,能明显引起大脑MAO活性的升高,同时指出黄酒的保护作用随生物胺含量不同是有限度的。BA对照组的肝脏MAO活性低于空白对照组(P<0.05),而3个实验组与空白对照组的肝脏MAO活性差异无统计学意义(P>0.05)。提示生物胺单独作用能引起肝脏MAO活性略微降低,但与黄酒共同作用时(100倍剂量为止),未引起肝脏MAO活性的明显变化。大脑、肝脏的测定结果说明适量饮用该黄酒不会引起机体MAO活性明显的变化,同时本次实验中酒精未表现出抑制肝脏MAO活性,可能是因为实验投用酒精量较少,尚不足以引起MAO活性改变。
2.1.2 小鼠血清、小肠DAO活性
DAO在体内主要分布于小肠粘膜,血清中含量极少,主要作用于外源性或内源性组胺的氧化脱氢[16]。当小肠粘膜受到损伤或屏障功能衰退时,胞内释放DAO增加,进入血液、肠间隙等,引起血清DAO升高;其次,坏死肠粘膜细胞会脱落从而引起小肠粘膜组织DAO下降[17-18],故小肠和血清DAO活性可反映小肠粘膜完整性和功能性。各组小鼠血清和小肠DAO活性的测定结果见表2。
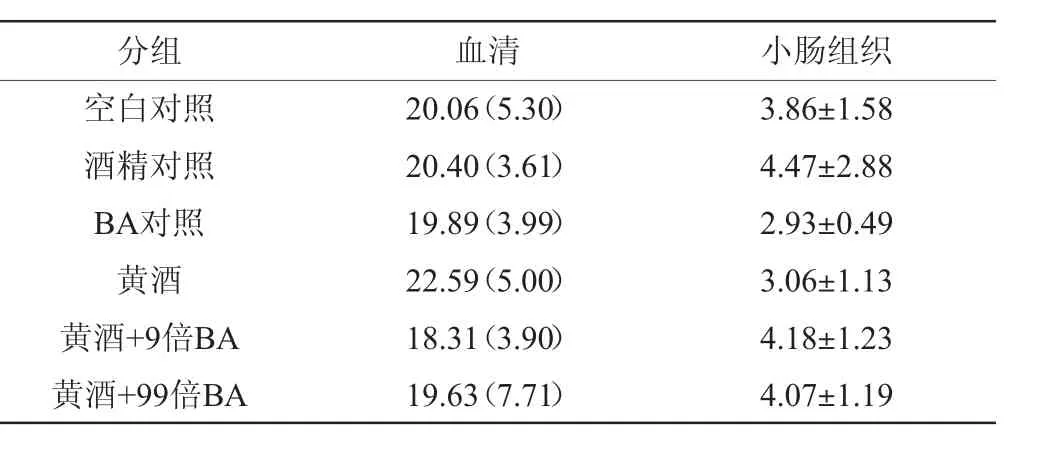
表2 各组小鼠血清和小肠二胺氧化酶活性的测定结果Table 2 Determination results of diamine oxidase activities of blood serum and small intestine in the tested mice U/L
由表2可知,与空白对照组相比,本实验中各组间受试小鼠的小肠组织和血清DAO活性的差异无统计学意义(P>0.05)。说明黄酒中的生物胺(100倍剂量为止)未对受试小鼠肠粘膜造成严重的刺激。
2.2 小鼠的肝脏病理形态
病理形态观察是动物实验中为了观察组织是否病变的一种常用手段,有研究表明[19-20],长期过量饮酒对多种器官,特别是肝脏有直接的毒性作用,其主要机制是氧化应激和炎症。不同处理组的小鼠肝脏病理形态观察结果见图1。
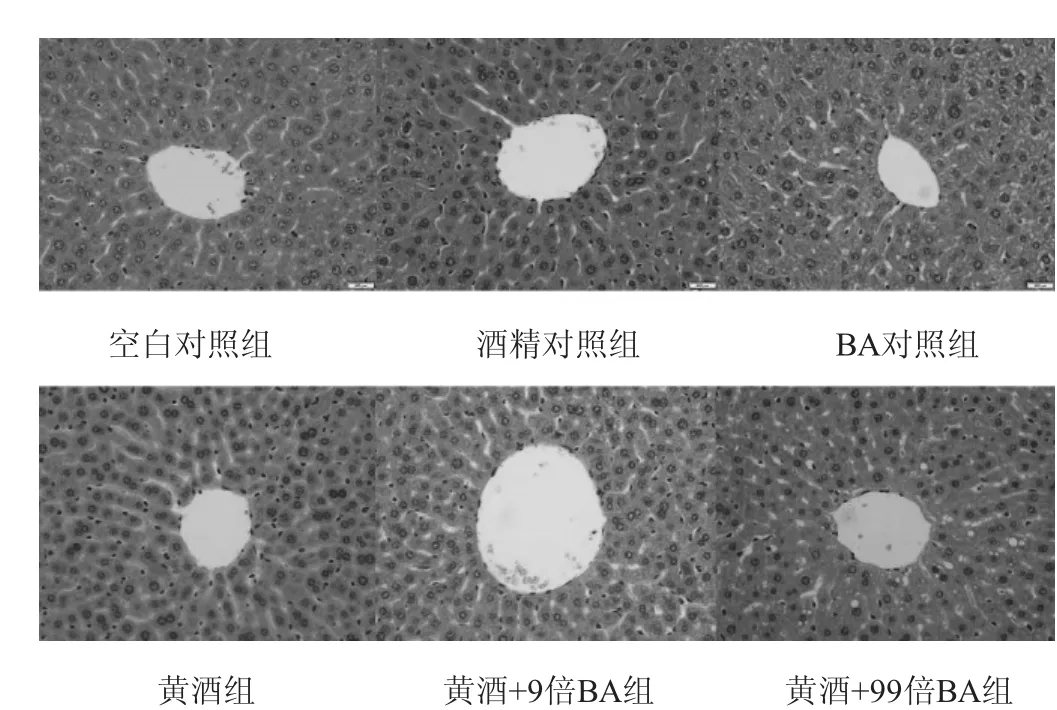
图1 各组小鼠肝脏病理形态Fig.1 Pathomorphology of liver of the tested mice
光镜下观察可见,空白对照组小鼠肝细胞核大而圆,胞质均匀,细胞间联系紧密;肝细胞索以中央静脉为中心呈放射状排列;汇管区无炎性细胞浸润;未见细胞变性、肿胀;肝窦和肝细胞均未见异常。其他各组小鼠肝细胞、肝细胞索、肝窦、中央静脉、汇管区的细胞形态正常,排列整齐,和对照组比未见明显异常病理改变。提示生物胺或者黄酒的干预未对小鼠肝脏造成明显的伤害,这与以往酒精损伤肝脏的研究不同,可能原因有:一是酒精对照组的酒精投用剂量是按照膳食营养素参考摄入量(dietaryreference intakes,DRIs)中健康推荐量计算的,含量在安全范围内;二是研究对象原料不同,前者研究的是纯酒精,而实验组用的黄酒,黄酒含有酚类、谷胱甘肽等活性成分,具有抗氧化作用[21],能减缓酒精对肝脏的损害;三是可能与实验周期有关。
2.3 小鼠的免疫因子水平
免疫系统细胞的增殖、分化和功能受到一系列细胞因子的调节。根据功能细胞因子可分为白细胞介素、干扰素和肿瘤坏死因子等,它们通过合成、分泌及基因表达来相互作用、相互影响,从而发挥免疫功能[22]。各组小鼠血清白细胞介素的测定结果和TNF-α、IFN-γ的测定结果分别见表3和表4。

表3 各组小鼠血清白细胞介素的测定结果Table 3 Determination results of serum interleukin level in the tested mice
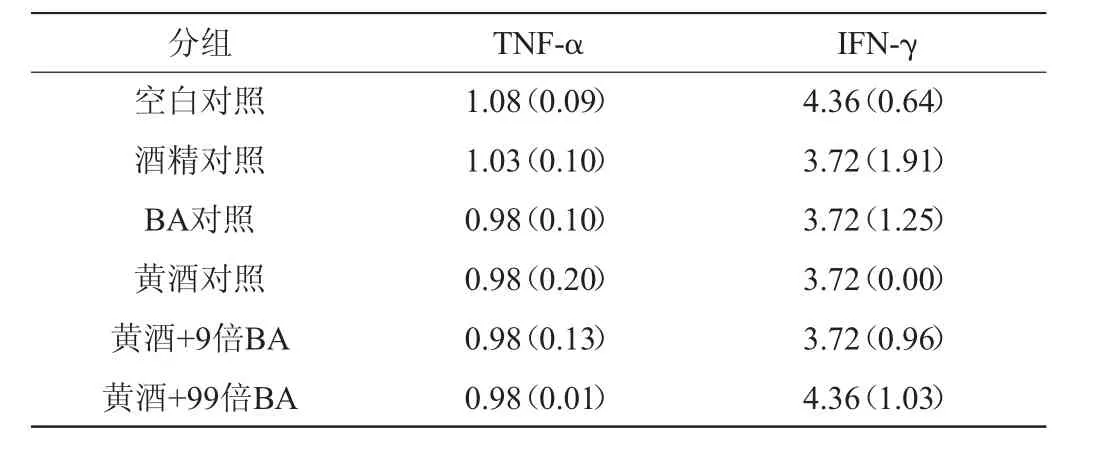
表4 各组小鼠TNF-α、IFN-γ的测定结果Table 4 Determination results of TNF-α and IFN-γ levels in the tested mice pg/mL
由表3、表4可知,实验中黄酒+外源性生物胺(100倍剂量为止)未对除IL-1β外的其他免疫因子指标造成明显影响。IL-1在机体炎症、感染、损伤及免疫调节等方面扮演重要角色,主要包括IL-1α和IL-1β两种形式,IL-1α是炎症发生的始动因子,而IL-1β作为其主要活动形式则主导炎症反应的传播,维持正常内环境稳态[23]。BA对照组IL-1β含量低于空白对照组(P<0.05),黄酒+99倍BA组IL-1β含量比空白对照组、酒精对照组和黄酒+9倍生物胺组低(P<0.05),而黄酒组IL-1β含量与空白对照组、酒精对照组的差异无统计学意义(P>0.05),推测生物胺单独作用能引起小鼠血清IL-1β含量失调,引起机体免疫系统功能紊乱,而当外源性生物胺与黄酒共同作用时,生物胺剂量达到100倍时才会引起IL-1β含量明显变化。
3 结论
本次实验发现,外源性生物胺会引起大脑MAO活性升高、肝脏MAO活性下降、IL-1β水平失调,指出外源性生物胺可能具有影响机体生理及免疫系统功能的风险。但是当外源性生物胺与黄酒共同作用时,这些情况会有所变化。当黄酒中的生物胺浓度达到10倍剂量,就可以引起大脑MAO活性升高,当黄酒中的生物胺浓度达到100倍剂量,才出现明显的IL-1β水平失调,但肝脏MAO活性无明显变化,结果表明黄酒可能具有对生物胺保护作用。限量饮用该黄酒不会引起大脑、肝脏MAO活性和血液、小肠组织DAO活性的变化和免疫功能失调,同时肝脏的病理形态结果也辅助证明了其安全性。虽然该黄酒在限量范围内未表现出毒性作用,但生物胺含量的多少会影响黄酒对机体的健康,所以如何降低生物胺含量仍是未来黄酒发酵工艺需要克服的一大难点。

