浓香型白酒窖泥中乳酸菌的分离鉴定及其在柑橘酒中的应用
沈 馨,马佳佳,刘文汇,杨少勇,张振东,郭 壮*
(1.湖北文理学院 食品科学技术学院 鄂西北传统发酵食品研究所,湖北 襄阳 441053;2.湖北古襄阳酒业有限公司,湖北 襄阳 441100)
作为柑橘深加工的重要领域,以柑橘为原料进行果酒酿制,不仅促进了柑橘产业的多元化发展,而且提高了农产品的附加值[1]。虽然柑橘酒富含有机酸和维生素等多种营养成分,但其存在酸味和苦味偏重的不足[2],在一定程度上降低了消费者对产品的喜好程度,因而积极寻求改善柑橘酒口感的方法是极为必须的。
果酒发酵过程中适当的有机酸可平衡酒中的苦涩味,而有机酸含量过高亦会导致果酒口感酸涩[3]。目前研究人员多采用工艺优化的方法,通过添加蔗糖[4]和糯米粉[5]的方式改善柑橘酒的风味。通过将苹果酸分解为乳酸同时引起其他有机酸的变化,在果酒发酵过程中添加乳酸菌亦可显著改善果酒的口感[6]。作为浓香型白酒窖泥中的重要功能菌群,适当的乳酸菌产生的乳酸除具有调和酒味的缓冲功能外,亦可与酒精生成乳酸乙酯,具有提升浓香型白酒品质的作用[7]。除此之外,窖泥中的乳酸菌具有较强的酒精耐受性[8],因而从浓香型白酒窖泥中分离乳酸菌并对其在柑橘酒中的应用潜力进行评价是较为可行的。
在对浓香型白酒窖泥中乳酸菌进行分离鉴定的基础上,将其与酵母菌联合发酵进行柑橘酒制备,采用电子舌对柑橘酒滋味品质进行评价的同时,使用高效液相色谱法(high performance liquid chromatography,HPLC)对柑橘酒中有机酸的种类和含量进行了解析,通过本研究的实施以期为后续柑橘酒相关产品的开发提供数据支撑和理论支持。
1 材料与方法
1.1 材料与试剂
柑橘(品种为宫川)、白砂糖:市售;果胶酶(50000U/g):和氏壁生物技术有限公司;偏高活性葡萄酒果酒干酵母(其中菌株为酿酒酵母):安琪酵母股份有限公司;牛肉膏、酵母膏、柠檬酸铵、吐温-80、琼脂、葡萄糖、乙酸钠、磷酸氢二钾、七水硫酸镁、一水硫酸锰、蛋白胨、柠檬酸二铵、十二烷基硫酸钠、十六烷基三甲基溴化铵、氯化钠、酚、异戊醇、氯仿、乙酸钠、乙醇、乙二胺四乙酸、碳酸钠和碳酸钙:国药集团化学试剂有限公司;MRS培养基:青岛海博生物技术有限公司;溶菌酶、蛋白酶K、脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)、脱氧核糖核酸(deoxyribonucleicacid,DNA)聚合酶、2×聚合酶链式反应(polymerase chain reaction,PCR)mix、10×PCR buffer和T-载体:北京全式金生物技术有限公司;引物(27F/1495R):武汉天一辉远生物科技有限公司合成;内部液、参比溶液、阴离子溶液和阳离子溶液:日本Insent公司;草酸、乙酸、乳酸、苹果酸、琥珀酸、柠檬酸和酒石酸标准品(纯度>98%):西陇科学股份有限公司。
1.2 仪器与设备
UV-1100紫外可见分光光度计:上海美谱达仪器有限公司;250B数显生化培养箱:金坛市荣华仪器制造有限公司;BXM-30R立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;DG250厌氧工作站:英国DWS公司;DYY-12电泳仪:北京六一仪器厂;ECLIPSE Ci生物显微镜:日本Nikon公司;vetiri梯度基因扩增仪:美国AB公司;FluorChem FC3化学发光凝胶成像系统:美国FluorChem公司;LC-20ADXR高效液相色谱仪及Inertsil ODS-SP C18色谱柱(150 mm×4.6 mm,5μm):日本岛津公司;SA-402B电子舌(配置CA0、C00、AE1、CT0和AAE测试传感器):日本Insent公司。
1.3 试验方法
1.3.1 样品的采集
从湖北古襄阳酒业的窖泥车间随机选取3个窖池,编号分别为A、B和C,从每个窖池的上层(距地面20 cm)、中层和底层分别挖取100 g左右窖泥,同一窖池的窖泥混合均匀后装入样品瓶中,置于冰盒中运回实验室进行乳酸菌的分离。
1.3.2 窖泥乳酸菌的分离纯化及DNA提取
将窖泥样品10倍梯度稀释后,取3个适宜的梯度涂布于含有1%碳酸钙的MRS固体培养基中,37℃厌氧培养2 d,选取菌数在30~300之间的梯度进行菌落形态记录。取有透明圈的单菌落划线,纯化3次之后,进行过氧化氢酶试验和革兰氏染色。将过氧化氢酶试验结果为阴性和革兰氏染色结果为阳性的纯菌株暂定为疑似乳酸菌[9]。使用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法对菌株基因组DNA进行提取[10],并进行琼脂糖凝胶电泳检测。
1.3.3 16S rDNA的PCR扩增
扩增体系:正反向引物各0.5μL,模板0.5μL,dNTP2μL,10×PCRbuffer 2.5μL,Taq酶0.2μL,超纯水18.8μL。其中正反向引物为27F:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物为1495R:5'-CTACGGCTACCTTCTTACGA-3'[11]。
扩增程序:94℃预变性4 min;94℃变性45 s,55℃退火45 s,72℃延伸90 s,循环30次;72℃延伸10 min;4℃保温[11]。用1.0%的琼脂糖凝胶电泳进行检测。将扩增成功的聚合酶链式反应(PCR)产物进行纯化、连接、转化以及鉴定,并将鉴定出的阳性克隆子的菌液寄往南京金斯瑞生物科技有限公司进行测序。将测出的序列与NCBI数据库进行BLAST同源性比对[12],以确定其分子学地位,并使用MEGA7.0软件构建系统发育树。
1.3.4 菌株乙醇耐受性的测定
将活化3代的菌株分别接种于乙醇含量分别为0、3%、5%、7%的MRS液体培养基中,在37℃的条件下培养48 h后,在波长600 nm处测定其OD600nm值。
1.3.5 柑橘酒的制作
将成熟的柑橘去皮、分瓣和打浆装入1 L玻璃瓶中→添加偏重亚硫酸钾(90 mg/L)→添加100 mg/L果胶酶→用碳酸钠调pH值为6.0,用白砂糖调整糖度为20°Bx→常温放置12 h→添加200 mg/L干酵母→控温发酵(22℃,6 d)→酒渣分离→按照5×106CFU/mL柑橘酒的接种量接种乳酸菌→后发酵(18℃,20 d)→陈酿→澄清→过滤→杀菌→装瓶
1.3.6 柑橘酒滋味品质的评价
参照郭壮等[13]的方法进行测定。传感器CAO、AE1、COO、AAE和CTO首先测得参比溶液电势Vr,然后测得柑橘酒的电势Vs,在参比溶液中洗涤后,传感器COO、AE1和AAE测得参比溶液电势Vr'。Vs-Vr即为酸、苦、涩、咸和鲜味5个基本味的相对强度;Vr-Vr'即为柑橘酒后味A(涩的回味)、后味B(苦的回味)和丰度(鲜的回味)的相对强度。
1.3.7 柑橘酒有机酸的测定
将乳酸、草酸、酒石酸、乙酸、柠檬酸和苹果酸的标准样品用超纯水配制成0.001~3 g/L的梯度,根据有机酸浓度和色谱峰峰面积进行线性拟合。
样品处理:取2 mL样品加200 μL磷酸,流动相定容至10 mL,混匀后用0.22 μm水相滤膜过滤备用。
色谱条件:流动相为0.01 mol/L磷酸二氢钾(pH2.9),柱温为30 ℃,流速为1.0 mL/min,进样体积为10 μL,色谱柱为C18柱(150 mm×4.6 mm,5 μm),检测器为紫外检测器,检测波长为215 nm[14-15]。
1.3.8 柑橘酒理化指标的评价
使用Mega7.0 软件(http://www.megasoftware.net/)绘制系统发育树,其他图均使用Origin 8.6软件(OriginLab Corp,MA,USA)绘制。
2 结果与分析
2.1 乳酸菌形态学观察及16S rDNA同源性分析
从窖泥样品中共分离出15株疑似乳酸菌菌株,显微镜下观察均为短杆,所有菌株的菌落均为圆形、颜色为乳白色且边缘光滑整齐。所有菌株过氧化氢酶均为阴性,革兰氏染色均为阳性。在提取疑似乳酸菌菌株DNA基础上,本研究通过16S rDNA同源性分析对15株疑似乳酸菌菌株进行了鉴定,进而确定了其分类学地位,15株菌16S rDNA序列分析结果如表1所示。
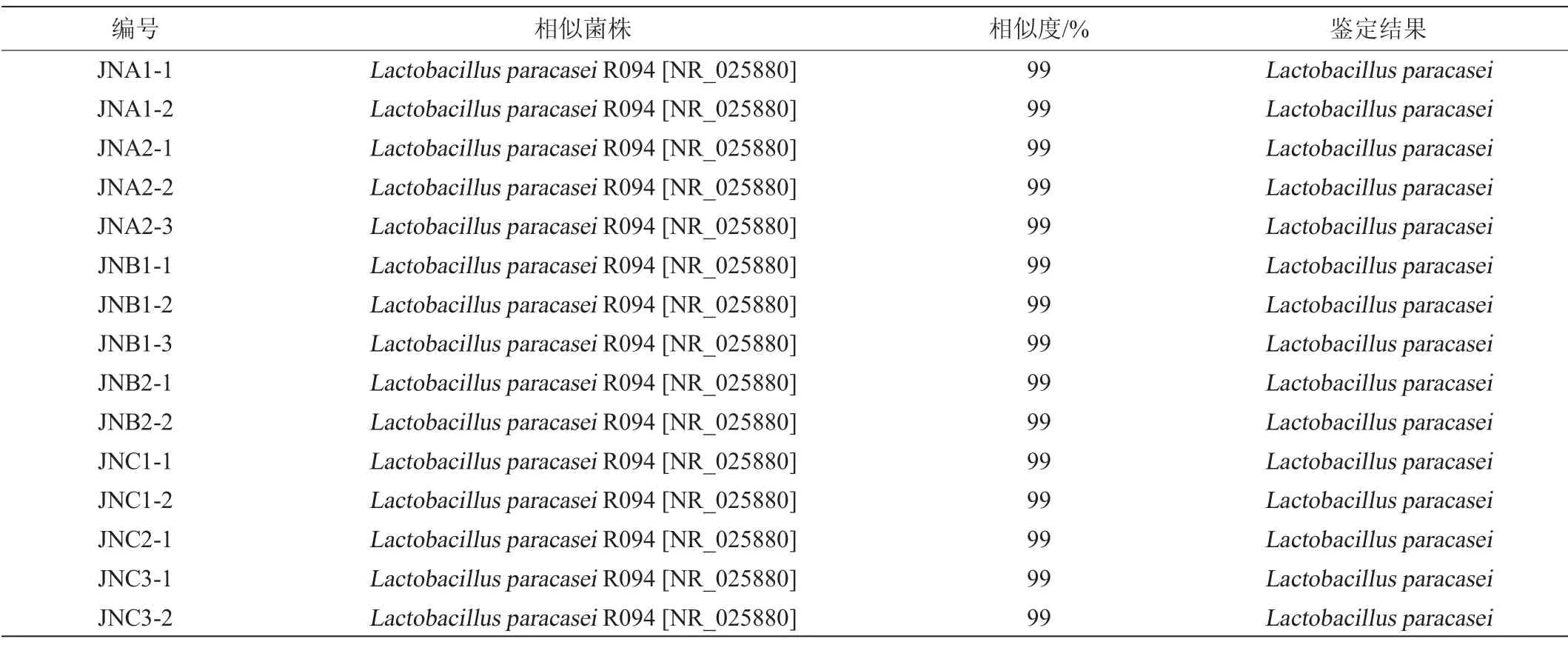
表1 15株菌的16S rDNA序列分析结果Table 1 16S rDNA sequence analysis of 15 strains
由表1可知,15株疑似乳酸菌均被鉴定为副干酪乳杆菌(Lactobacillus paracasei),且与L.paracaseiR094 16S rDNA序列同源性均为99%,由此可见,L.paracasei是古襄阳窖泥中的优势乳酸菌。
在已知同源性比对结果的基础之上,本研究进一步使用MEGA7.0软件以邻接(neighbor-joining,NJ)法构建系统发育树,标准序列中包括作为系统发育树外群序列的L.brantaeSL1108和L.curvatusJCM 1096以及系统发育树外群序列的L.zeaeRIA 482和L.rhamnosusNBRC 3425,系统发育树如图1所示。

图1 15株乳酸菌的系统发育树Fig.1 Phylogenetic tree of 15 lactic acid bacteria strains
由图1可知,15株菌株和2株内群菌株形成了第一类群,而外群菌L.brantaeSL1108和L.curvatusJCM1096分别形成了第二类群和第三类群,且15株菌株的16S rDNA序列同源性均为99%,均鉴定为副干酪乳杆菌(Lactobacillus paracasei)。
2.2 窖泥乳酸菌菌株乙醇耐受性的测定
在明确各菌株分类学地位的基础之上,本研究评价了15株乳酸菌的乙醇耐受性,结果如图2所示。
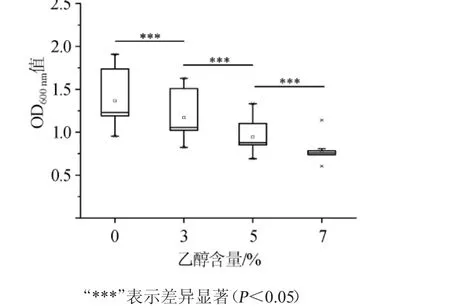
图2 乳酸菌菌株酒精耐受试验结果Fig.2 Alcohol tolerance test results of lactic acid bacteria strains
由图2可知,15株乳酸菌在含7%乙醇的MRS培养基中仍然可以生长,说明其具有较好的乙醇耐受性。随着乙醇含量的升高,乳酸菌的生长受到了明显的抑制(P<0.05)。
2.3 柑橘酒滋味品质的评价
为了进一步研究添加乳酸菌对柑橘酒滋味品质的影响,本研究采用电子舌技术对果酒各滋味指标的相对强度值进行了测定,结果如图3所示。
由图3可知,添加乳酸菌后柑橘酒苦味、咸味、鲜味和丰度(鲜味的回味)相对强度呈现下降趋势,涩味相对强度呈现上升趋势,而酸味、后味A(涩味的回味)和后味B(苦味的回味)因使用菌株发酵特性的不同呈现出不同的变化趋势,这说明在后发酵过程中添加乳酸菌会显著影响柑橘酒的滋味品质。值得一提的是,酸味是15株乳酸菌发酵而成的柑橘酒样品间差异最大的指标,这可能与乳酸菌菌株产酸和苹果酸-乳酸发酵能力不同有关。为了进一步探讨添加乳酸菌对柑橘酒酸味的影响,采用HPLC技术对柑橘酒中的有机酸含量进行了测定,结果如图4所示。
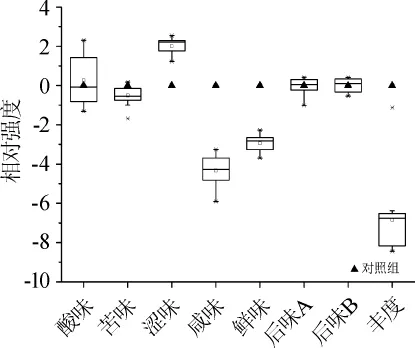
图3 柑橘酒各滋味指标的相对强度值Fig.3 Relative intensity of each taste index in orange wine
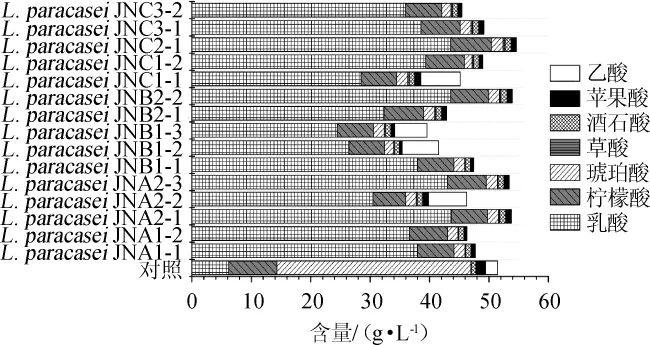
图4 柑橘酒有机酸的种类和含量Fig.4 Types and contents of organic acids in orange wine
由图4可知,柑橘酒中的有机酸主要是乳酸、柠檬酸和琥珀酸,添加乳酸菌可明显提升果酒中乳酸的含量,并降低琥珀酸的含量。除此之外,添加乳酸菌的果酒中苹果酸的含量也较对照组低,说明苹果酸-乳酸发酵过程可以将苹果酸转为乳酸。L.paracaseiJNC1-1、L.paracaseiJNB2-1、L.paracaseiJNB1-3和L.paracaseiJNB1-2可明显降低7种有机酸的总含量,而L.paracaseiJNC2-1、L.paracaseiJNB2-2、L.paracaseiJNA2-3和L.paracaseiJNA2-1可提高果酒中乳酸菌的含量。由此可见,不同乳酸菌菌株的发酵特性是具有较大差异的。
在解析果酒各滋味指标相对强度和有机酸差异的基础之上,本研究采用主成分分析(principalcomponentanalysis,PCA)对果酒滋味品质进行了进一步评价,柑橘酒滋味品质的因子载荷图如图5所示。

图5 柑橘酒滋味品质的因子载荷图Fig.5 Factor loading graph of taste quality in orange wine
由图5可知,第一主成分由咸味和鲜味2个指标组成,其贡献率为88.95%;第二主成分由丰度(鲜的回味)、涩味、后味A(涩的回味)、后味B(苦的回味)、苦味和酸味6个指标所组成,其贡献率为8.50%。柑橘酒滋味品质的主成分1与主成分2因子得分图如图6所示。

图6 柑橘酒滋味品质的因子得分图Fig.6 Factor score graph of taste quality in orange wine
由图6可知,在水平方向上,相对于对照组而言,添加乳酸菌的样品在因子得分图上的分布整体偏右,结合因子载荷图可知,添加乳酸菌发酵后柑橘酒的鲜味和咸味减弱。L.paracaseiJNB1-3在空间排布上较之其他添加乳酸菌的样品偏左上,结合因子载荷图可知,添加该株菌可明显降低柑橘酒的酸味和苦味。由此可见,L.paracaseiJNB1-3在后续柑橘酒发酵中可能具有一定的应用潜力。
3 结论
从浓香型白酒窖泥中共分离出了15株乳酸菌,经鉴定均为副干酪乳杆菌(Lactobacillus paracasei),为古襄阳酒业窖泥中的优势乳酸菌。柑橘酒中的有机酸主要为乳酸、柠檬酸和琥珀酸,酸味是15株乳酸菌发酵而成的柑橘酒样品间差异最大的指标。在后发酵过程中添加乳酸菌会显著影响柑橘酒的滋味品质,L.paracaseiJNB1-3可明显降低柑橘酒的酸味和苦味,在后续相关产品开发中可能具有一定的应用潜力。

