MicroRNA-181b及Toll样受体4在新生大鼠神经元缺氧缺血损伤中的作用机制研究
阎雯,齐薛浩
(陕西省西安市儿童医院 1.新生儿一科,2.NICU科,陕西 西安 710003)
缺血缺氧性脑病(hypoxia-ischemic encephalopathy,HIE)是新生儿较为常见的疾病之一,其临床病死率高达75%,是目前新生儿早期死亡及小儿智力发育障碍、癫痫、小儿脑性瘫痪及其他中枢神经系统损害的主要原因,缺血缺氧性脑损伤(hypoxic-ischemic brain damage, HIBD)后的炎症反应是新生儿HIE的特征性反应之一[1]。MicroRNA(miRNA)是真核生物中参与基因转录后调控非编码单链的小分子RNA,miRNA虽然仅占人类基因约1%~5%,却能调控人类大约60%的mRNA和30%的蛋白编码[2]。既往有报道指出,miRNA-181b在中枢神经系统的急性炎症反应中通过对炎症因子肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),白介素 6(interleukin 6, IL-6)、IL-1β、IL-8及高迁移率族蛋白1(high mobility group box-1 protein,HMGB-1)表达的调控发挥重要神经保护作用[3]。最近研究显示,miRNA-181能够通过靶向Toll样受体4(Toll like receptor 4, TLR4)通路,调控促炎症因子的分泌,在烧伤、银屑病患者表皮细胞的过度增殖及肺脏的纤维化过程中发挥一定的保护作用[4-6]。然而,miRNA-181b能否在新生儿HIE的进展中发挥保护作用尚未见报道,本文通过原代培养新生大鼠神经元细胞HIBD,体外模拟新生儿缺血缺氧的病理生理反应,观察miRNA-181b在HIE中的作用,并进一步探讨其可能的作用机制,以期为新的靶点的寻找提供实验依据和理论支持。
1 材料与方法
1.1 材料
Neurbasal培养液、B27培养基添加剂、0.25%胰酶及胎牛血清(美国Gibco公司),CCK-8(Cell Counting Kit-8)细胞活性检测试剂盒(日本同仁公司),Annexin V/PI凋亡检测试剂盒(美国BD公司),总mRNA提取(美国Invitrogen公司),逆转录试剂盒及实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR)试剂盒(美国Roche公司),特异性引物合成[生工生物工程(上海)股份有限公司],兔抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)及TLR4单克隆抗体(英国Abcam公司),细胞转染试剂LipofectamineTM2000和miRNA第1链合成试剂盒(美国Invirogen公司),miRNA-181b模拟物(miRNA-181b mimic),miRNA-181b无关序列(miRNA-181b negative control, miRNA-NC) 及miRNA-181b抑 制剂(anti-miRNA-181b)(Ribobio公司),si-NC(nontargeting)及si-TLR4试剂盒(美国Ambion公司)。
1.2 方法
1.2.1 原代细胞培养及分组 新生1~2日龄无特定病原体(SPF)斯泼累格多雷(SD)大鼠3只(购自北京维通利华实验动物技术有限公司)常规消毒后置于超净工作台断头取脑,在预冷的D-Hank's液中分离大脑皮层,预冷的D-Hank's液洗净后迅速剪成1 mm×1 mm×1 mm左右的小块,胰酶37℃下消化20 min,每5分钟轻轻摇晃或吹打1次,使用预冷的含10%胎牛血清的DMEM培养基和Ham's F-12营养混合物DMEM/F12培养液终止反应。200目筛网过滤,4℃,1 000 r/min离心5 min,弃上清液,再用含20%胎牛血清的DMEM/F12新鲜培养液洗1次,调整细胞悬液浓度为1×106个/L,接种于经0.01%多聚赖氨酸浸泡过夜的6孔板中,放入37℃恒温5%二氧化碳CO2培养箱内培养。4~8 h后neurbasal+B27营养因子培养液换全液1次,接种第4天,加入终浓度为5 mol/L的阿糖胞苷作用24 h,抑制胶质细胞的增殖,以后每4天半量换液1次。取培养7 d的原代神经元细胞,吸去培养液,随机分为对照组和HIBD组,其中对照组用含糖DMEM洗2次,再加入含糖DMEM置于37℃、95%空气孵箱中继续培养4 h。HIBD组用无糖DMEM洗2次,加入无糖DMEM培养液后,置于37℃、95% N2的密闭缺氧室中培养4 h。
1.2.2 CKK-8法检测细胞活性 将各组细胞以2×103个/孔密度接种于96孔板中,培养箱内培养24 h,随后向各孔中加入10 μl CCK-8溶液,轻晃混匀后置于培养箱中培养1 h后,酶标仪490 nm 波长处测光密度(optical density, OD)值。取3个复孔的OD值均数,根据公式计算细胞的相对增殖率(P%):P%=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3 细胞转染 神经元细胞分别以2×105个/孔密度接种于6孔板中,培养24 h后换新鲜培养液,按操作手册说明书以等量DMEM双无培养基分别稀释适量的miRNA-181b mimic和脂质体LipofectamineTM2000,混匀后各自室温静置5 min,后将两者混匀室温下共培养20 min,加入培养板中,轻轻混匀,放入培养板中继续培养,隔8 h后换完全培养基继续培养,同法转染miRNA-181b阴性对照(miRNA-NC)以及miRNA-181b抑制剂(anti-miRNA-181b)。TLR4 siRNA的转染,当接种到6孔板中原代培养的神经元细胞融合达60%左右时,弃完全培养基,PBS洗1次,加入1.5 ml无抗DMEM培养基。5 μl LipofectamineTM2000及5 μl siRNA分别与250 μl双无DMEM培养基混匀后,室温培养5 min。将上述溶液混匀后室温放置20 min,获得siRNA转染液。将siRNA转染液加入已换成双无DMEM培养基的6孔板中,混匀,继续培养4~6 h后,更换为无抗DMEM培养基培养。24 h后更换为含10%胎牛血清的完全DMEM培养基。
1.2.4 双荧光素酶报告检测 PCR扩增TLR4 mRNA 3'-UTR并克隆至pMD18-T载体,构建野生型TLR4基因载体(TLR4-WT),利用点突变方法构建TLR4 3'-UTR突变载体(TLR4-Mut)。将构建的TLR4-WT、TLR4-Mut基因载体进行XhoI和NotI双酶切,将野生型及含有突变位点的TLR4-3'-UTR克隆置于psiCHECKTM-2载体的海肾荧光素酶开放读码框架的下游,构建含该野生及突变载体的双荧光素酶报告载体。将所构建的荧光素酶报告载体与miRNA-181b mimic表达载体或者阴性对照miRNA-NC载体共转染至HEK-293细胞,转染后24 h收集细胞进行双荧光素酶报告基因测定。计算公式:相对荧光值=萤火虫荧光素酶荧光值/海肾荧光素酶荧光值。
1.2.5 Western blot检测TLB4蛋白表达 将各组原代培养的神经元细胞用0.05%胰蛋白酶消化后PBS洗涤3次,加入450 μl蛋白裂解液裂解细胞,BCA法测定蛋白浓度,10% SDS聚丙烯酰胺凝胶电泳后,转至聚偏氟乙烯(PVDF)膜,封闭后兔抗小鼠一抗GAPDH(1∶2 000)及兔抗鼠TLR4(1∶500)4℃过夜,HRP标记山羊抗兔二抗(1∶2 000),常温下作用1 h,Western blot检测TLR4蛋白表达,Fluor Chem Q凝胶成像系统(美国Alpha Innotech公司)显影,Scion Image图像分析系统对条带进行分析,目的蛋白的相对含量以目的蛋白与GAPDH条带光密度的比值表示。
1.2.6 SYBR Green qRT-PCR检测miRNA-181b和TLR4 mRNA表达 Trizol抽提法提取细胞总RNA,紫外分光光度计测吸光度值确定RNA的浓度和纯度。Quantscript RT kit逆转录合成cDNA,PCR扩增引物采用Oligo 6.0设计,引物及其序列分别为(5'-3'):miRNA-181b,正向AACATTCATTGCTGTCGGT,反向CCGCCTAACGTACCGCGAATTT;U6,正向GCTTCGG CAGCACATATACTAA,反向AACGCTTCACGAATTTG CGT;TLR4,正向GGCATCATCTTCATTGTCCTTG,反向AGCATTGTCCTCCCACTCG;GAPDH,正向GGAG CGAGATCCCTCCAAAAT,反向 GGCTGTTGTCATACTT CTCATGG。采用SYBR Green Ⅰ(美国Roche公司)荧光染料嵌合法20 μl反应体系,即10 μl SYBR Green real-time PCR Master Mix,1 μl 0.2 μmol/L引物,2 μl cDNA及7 μl无菌双蒸水。避光置于qRT-PCR仪(ABI 7500 Fast PCR)采集荧光信号检测miRNA-181b及TLR4 mRNA表达,U6及GAPDH分别作为miRNA-181b及TLR4 mRNA内参,ABI7500配套软件采用 2-ΔΔCt处理数据。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,采用方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 HIBD组神经元细胞中miRNA-181b的表达
新生大鼠神经元细胞培养8 d后,HIBD组与对照组比较,差异有统计学意义(0.64±0.08 vs 1.01±0.14,t=3.974,P=0.017)。HIBD 组神经元细胞中miRNA-181b表达量降低。见图1A。anti-miRNA-181b及miRNA-181b mimic的转染效率,见图1B,方差分析结果显示各组间miRNA-181b表达量有差异(F=50.365,P=0.000),其中,与对照组比较,miRNANC和anti-NC组神经元细胞miRNA-181b表达量均无明显变化,miRNA-181b mimic组较miRNA-NC组神经元细胞miRNA-181b表达增高(4.42±0.83 vs 1.06±0.17,P<0.05),anti-miRNA-181b 组较 anti-NC组神经元细胞miRNA-181b表达降低(0.53±0.09 vs 1.02±0.13,P<0.05)。
2.2 miRNA-181b过表达对新生大鼠神经元细胞缺血缺氧损伤的影响
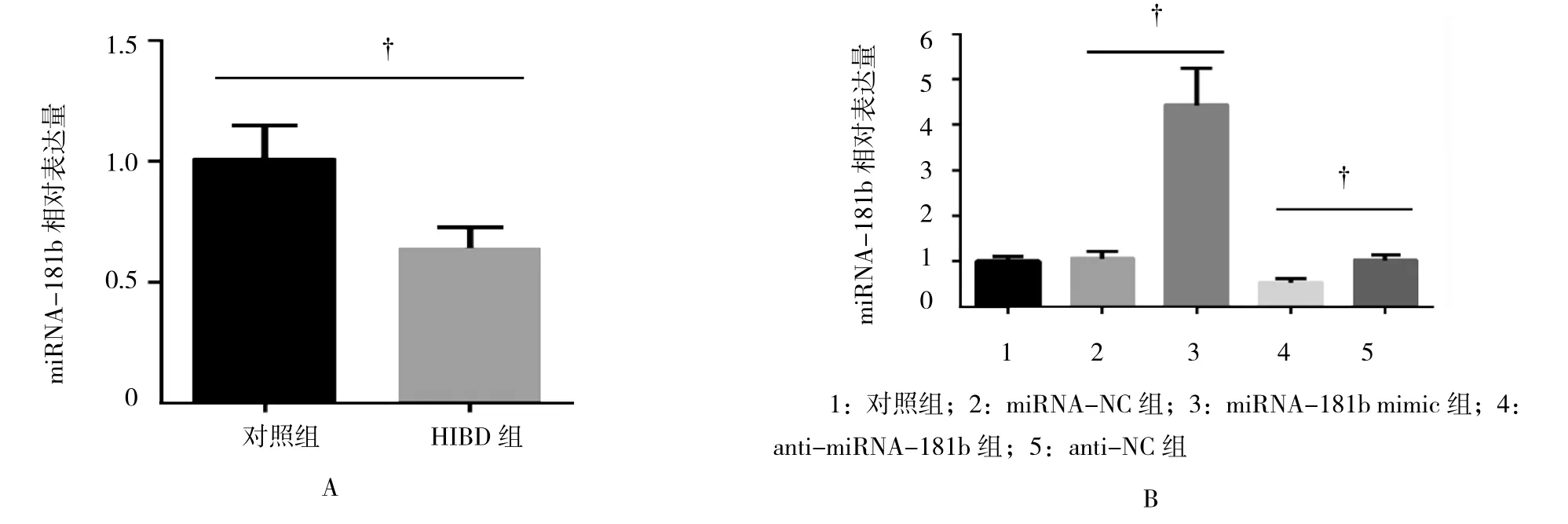
图1 不同处理组神经元细胞中miRNA-181b表达水平比较
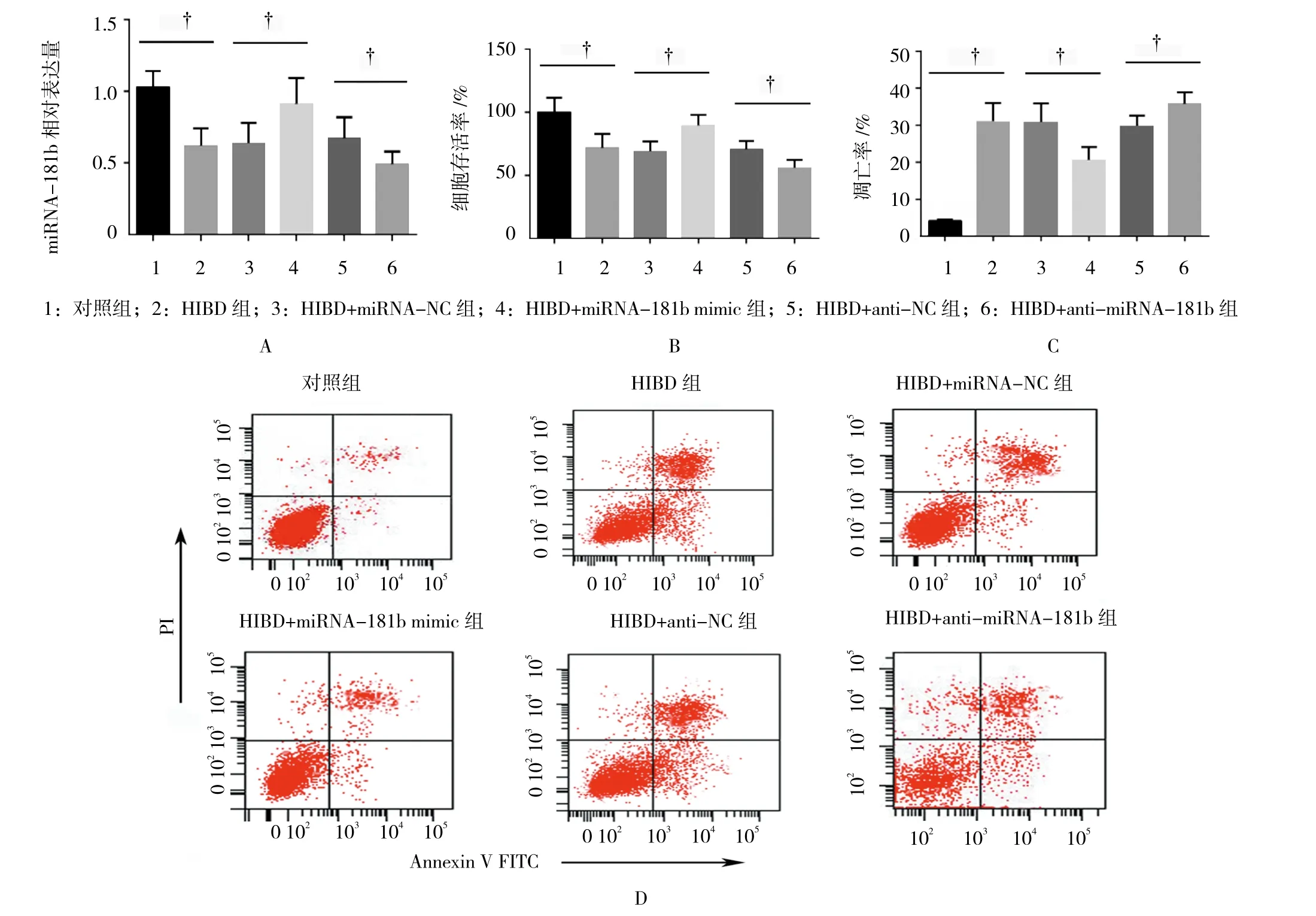
图2 miRNA-181b过表达对新生大鼠神经元细胞缺血缺氧损伤的影响
miRNA-181b在各组神经元细胞中的表达水平有差异(F=15.322,P=0.000)(见图2A),流式细胞仪及CKK-8检测结果(见图2B、2C及2D)显示,细胞存活率及凋亡率在各组间有差异(F=11.496和32.312,均P=0.000)。其中与对照组比较,缺血缺氧能增加神经元细胞凋亡(31.20±4.90 vs 3.99±0.54,P=0.001),降 低 细 胞 活 性(71.50±11.20 vs 100.15±11.50,P=0.037)。miRNA-181b mimic转染后,部分逆转缺血缺氧所诱导的神经元细胞凋亡(20.60±3.50 vs 30.90±5.01,P=0.043),增加细胞活性(89.50±7.20 vs 69.00±6.45,P=0.021)。此外,anti-miRNA-181b转染后抑制神经元细胞中miRNA-181b表达会进一步加重缺血缺氧对新生大鼠神经元细胞的损伤,增加细胞凋亡(35.80±3.00 vs 29.90±2.10,P=0.049),降低细胞活性(55.90±4.72 vs 70.4±4.93,P=0.021)。
2.3 miRNA-181b在新生大鼠神经元细胞中靶向调控TLR4表达
应用http://www.microrna.org及http://www.target scan.org对miRNA-181b进行在线分析预测,发现miRNA-181b与TLR4 mRNA的3'-UTR存在结合序列(见图3A)。双荧光素酶报告检测结果显示各组间荧光素酶活性有差异(F=4.810,P=0.034),其中与miRNA-NC组比较,miRNA-181b mimic转染组能抑制TLR4 mRNA的3'-UTR载体的相对荧光素酶活性(0.62±0.07 vs 0.97±0.19,P=0.040)。而对TLR4 mRNA该段序列进行突变(TLR4-Mut)后,该抑制作用消失(见图3B)(1.03±0.11 vs 0.90±0.17,P=0.329),本结果提示miRNA-181b对TLR4存在直接的靶向关系。此外,在原代培养的新生大鼠神经元细胞中转染miRNA-181b mimic后降低TLR4的表达(0.62±0.09 vs 1.09±0.16,P=0.011),各组间 TLR4表达水平有差异(F=15.721,P=0.004)(见图3C)。

图3 miRNA-181b在新生大鼠神经元细胞中靶向调控TLR4表达
Western blot检测结果显示,各组细胞TLR4表达水平有差异(F=11.820,P=0.003),其中HIBD组神经元细胞中TLR4表达增加(2.26±0.43 vs 1.01±0.12,P=0.008),si-TLR4转染后48 h,TLR4表达降低(1.48±0.26 vs 2.35±0.39,P=0.032)(见图 4A)。CKK-8检测结果发现不同处理组细胞存活率有差异(F=22.859,P=0.000),TLR4成功敲减能增加缺血缺氧下新生大鼠神经元细胞的活性(88.5±7.2 vs 65.7±6.1,P=0.014)(见图 4B)。
进一步研究结果显示,不同处理组TLR4表达水平及神经元细胞活性有差异(F=22.693和6.648,均P=0.015),anti-miRNA-181b转染后TLR4蛋白表达增加(3.27±0.42 vs 1.06±0.09,P=0.001)并伴随细胞活性的降低(71.5±13.1 vs 100.2±9.2,P=0.036),anti-miRNA-181b与si-TLR4共转染逆转TLR4表达的增加(1.96±0.33 vs.3.36±0.57,P=0.013),同时部分恢复缺血缺氧下神经元细胞的活性(94.2±11.2 vs 66.1±11.1,P=0.037)(见图 4C、4D)。
2.4 TLR4介导缺血缺氧下的神经元损伤
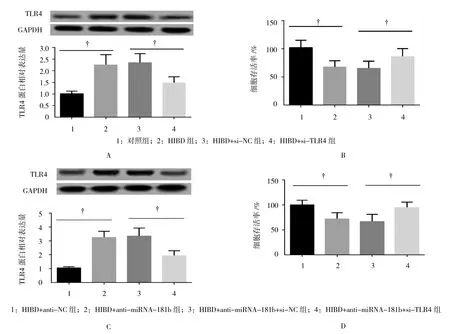
图4 TLR4介导缺血缺氧下的神经元损伤
3 讨论
既往研究显示,新生儿HIBD可引起不可逆的脑损伤,导致一系列的神经系统后遗症,发生过HIBD而存活的新生儿中约25%出现脑性瘫痪、癫痫及智力落后等永久性神经精神缺陷,给社会和家庭带来沉重的经济精神负担[7]。新生儿HIBD的发病机制复杂,临床疗效差,至今尚无统一、有效的治疗方案能防止神经系统后遗症的发生。因此,深入研究新生儿HIBD分子生物学机制,寻找新生儿HIBD治疗的新靶点是医学专业者亟待解决的问题。有文献报道指出miRNA-181b能通过调控NF-κB信号通路在急性肺损伤中发挥一定的抗炎作用[8]。与该研究类似,本研究中发现,miRNA-181b在新生大鼠神经元细胞HIBD模型中表达降低,双荧光素酶报告结果显示miRNA-181b能靶向作用于TLR4,通过调控TLR4的表达,在新生大鼠神经元细胞缺血缺氧时发挥抑制细胞凋亡,增加细胞活性的保护性作用。
miRNAs是一类含有约22个核苷酸序列组成的内源性非编码单链RNA,广泛参与细胞的分化、免疫、炎症及慢性疼痛等过程的调制[9]。最近研究报道发现,在肿瘤,神经系统及心血管疾病领域中有多个miRNA与缺血缺氧密切相关,其中miRNA-181b是1个多次出现而又倍受关注的miRNA,研究中发现,miRNA-181b不仅能够通过对调节热休克蛋白A5以及泛素型羧基末端水解酶L1表达的调控在缺血缺氧性脑卒中病程进展中发挥一定的神经保护作用,还可通过对巨噬细胞中IL-6的调节改变细胞对内毒素的耐受性[10-12]。本研究中发现,miRNA-181b转染后过表达miRNA-181b可减轻缺血缺氧下神经元细胞的凋亡,增加细胞活性。因此,可以推断缺血缺氧后神经细胞中miRNA-181b的表达下调可能是缺氧缺血性脑组织病理损伤的分子机制之一,miRNA-181b表达增加可能改善缺血缺氧下的脑损伤,为新生儿缺氧缺血性损伤的治疗提供一个新的研究方向。
TLRs是I型跨膜受体超家族,广泛分布于中枢神经系统,在免疫炎症反应的诱导和调节中起重要作用[13]。既往有研究指出,小鼠在缺失TLR4后炎症因子表达减少,从而避免脑部缺血再灌注损伤,提示TLR4可参与缺血再灌注损伤过程中的炎症反应。此外,有研究证实早产儿与TLRs多态性存在密切关系,且胎鼠及新生鼠中TLR4的过度激活与脑损伤的关系确切[14-15]。然而,关于TLR4在新生儿脑损伤中作用机制,尤其是与miRNAs相互作用的研究尚未见报道,本研究中发现缺血缺氧下miRNA-181b的表达下调,负性调控TLR4蛋白表达增多,促进神经元细胞死亡,TLR4敲减后逆转缺血缺氧下神经元细胞的凋亡,提示TLR4介导新生大鼠神经元细胞缺血缺氧损伤在脑损伤,在新生儿HIBD过程中可能发挥神经毒性作用。
综上所述,本研究发现在新生儿HIBD中miRNA-181b能通过负性调控TLR4表达缓解缺血缺氧下的脑损伤。本研究阐述miRNA-181b及TLR4在新生儿HIBD过程中的意义,证实miRNA-181b与TLR4靶向关系,补充新生儿HIBD过程的细胞分子生物学机制。值得注意的是新生儿HIBD机制复杂,涉及多种细胞因子、炎症介质、受体以及离子通道,且病情变化迅速,后遗效应严重,在以后的研究中,希望能够进一步多角度明确参与新生儿HIBD的miRNAs及其各分子靶标,阐明其作用机制,为新生儿HIBD的治疗提供有效的药物合成新的靶点。

