碘125粒子植入治疗与立体定向放射治疗肠癌术后反复复发肺转移瘤的临床效果比较
李杰 谢其根 孙宗琼 王卫国 华燕艳
在中国,癌症是导致死亡的第二大原因。中国国家癌症登记中心2011年的统计结果显示结直肠癌患者的致死率在癌症中排在第五位[1]。结直肠癌患者中至少有50%会出现远处转移,其中5%~25%的转移灶位于肺[2]。肺内转移瘤的出现提示着肿瘤全身控制的失败,患者预后不良。以往的外科反复手术切除治疗结直肠癌肺转移反复复发患者取得了一定的疗效[3-4],随着微创治疗方法的不断成熟,目前临床上出现的反复复发的肺转移瘤患者,可以通过局部治疗的方法有效控制,延缓终末期症状的出现。近年来三维立体定向引导下的局部治疗手段,例如:射频消融、立体定向放疗和/或碘125粒子植入治疗肺转移取得了较好的局部控制[5-12]。
经典的立体定向放射治疗(stereotactic body radiation therapy,SBRT)在肿瘤的局部控制中起到比较重要的作用,但是在肺内应用中易出现明显的放射性肺炎反应,而且还受到短期内无法重复治疗的限制[13]。碘125粒子植入治疗通过精准穿刺植入放射源,自病灶内部持续照射杀灭肿瘤的同时,对邻近肺组织的放射性损伤也较小,而且短时间内可以反复植入治疗[14],还不影响正常的肺功能。所以,比较来看,粒子植入治疗肺转移瘤安全、高效,但是肺内转移瘤粒子植入治疗与SBRT治疗的临床疗效和预后的差别目前研究尚少。本研究通过比较碘125粒子植入与SBRT治疗结肠癌术后肺转移瘤的临床疗效,以及对邻近肺组织的放射性肺损伤情况,并分析影响生存预后的因素。
资料与方法
一、临床资料
选取2013年6月至2016年12月在我院接受治疗的肠癌术后肺转移患者36例,男22例,女14例,年龄 16~81岁,平均(58.3±14.5)岁。具体纳入标准:结肠癌切除术后反复多次(≥2次)出现的肺内转移瘤,拒绝行肺转移瘤切除手术治疗,且未发现其他脏器存在转移灶。排除标准:有慢支肺气肿或邻近转移灶附近存在肺大泡患者;有凝血功能障碍或ECOG评分≥3分者。碘125粒子植入治疗组(A组,20例)和SBRT组(B组,16例)。两组的基线情况详见表1。

表1 两组肺转移瘤患者的基线情况
二、碘125粒子植入治疗
1.仪器与设备:碘125粒子(Model-6711型)、枪式粒子植入器购自原子高科股份有限公司,放射性粒子治疗植入计划系统(TPS,规格型号KLSIRPS-3D)购自北京航空航天大学北京天航科霖科技发展有限公司。18G穿刺针(COOK公司),德国西门子16排螺旋CT。粒子送达医院后由核医学科专人负责检测活度,合格后封装入粒子弹夹中,经过高温高压灭菌后使用。碘125粒子吸附有碘-125的Ag棒装在钛管中,两端焊封的密封源。外型尺寸:长(4.5±0.3)mm;外径(0.80±0.03)mm。核性质:T1/2=59.6 d,电子俘获衰变伴随有特征X射线和内转换电子。电子被碘-125密封籽源的Ti壁所吸收,碘-125的组织穿透能力为1.7 cm。
2.治疗过程:粒子植入术前将常规CT检查资料传输入TPS,利用TPS系统勾画靶区,给出处方剂量和穿刺针数量,规划穿刺路径,测量穿刺针植入深度,根据粒子活度得出需要植入的总粒子数量。治疗计划由一名肿瘤放疗科医师和一名放射科医师共同完成,共同负责勾画每一层CT图像上的GTV、PTV和邻近需要规避的重要器官(如脊髓、肺动脉、支气管),PTV一般外扩5 mm。
所有的粒子植入操作均有固定的两名具有10年以上经验的放射介入科医生在CT引导下完成。粒子植入时根据肺内转移灶的位置安排患者在CT检查床上的体位,嘱患者平静呼吸。根据术前的CT检查结果做好体表定位标记,固定好患者后开始行肺转移瘤靶区范围3 mm层厚容积扫描,CT检查参数:结合体表标记和CT扫描定位线确定穿刺针排布的范围和各个进针点,各进针点间距1 cm。应用2%的利多卡因局部麻醉,根据术前计划插入18G穿刺针长度20 cm直至PTV的最远端后再次进行CT扫描,验证穿刺针插入的深度和位置,根据术前计划结合实际情况调整穿刺针插入的角度和深度。采用逐步退针的方式植入粒子,粒子间隔0.5~0.8 cm。植入的粒子之间应等距离分布,原则上要使放射剂量分布与靶区一致,尽可能达到三维立体均匀分布。粒子植入后将CT扫描图像传入计划系统进行剂量验证,评估肿瘤区的剂量分布和周围正常组织的受量。植入粒子的总活度达到治疗计划处方剂量的要求,给出等剂量曲线,匹配周缘剂量(MPD)平均为135 Gy(130~145 Gy)。处方剂量90%的体积内计划植入100~160 Gy活度为25.9×106Bq的碘125粒子。如果没有达到剂量应立即补充。
三、SBRT
1.仪器与设备:瑞典医科达公司的Synergy医用直线加速器(配备CBCT)和XIO治疗计划系统(TPS)4.7版本,日本东芝公司的LX-40A医用模拟定位机,德国IBA公司的二维电离室矩阵Matrix X剂量验证系统,比利时的ORFIT固定架。
2.治疗过程:患者双手上举,使用胸部网格型体膜固定,使用模拟机测量肺转移瘤随患者平静呼吸的三维活动度,然后使用双能减影技术测量肺转移瘤活动度,如任意一个方向肺转移瘤活动度大于5 mm,即进行平静呼吸状态下的屏气训练,准备使用呼吸门控ABC。肺转移瘤区域的CT扫描层厚2.5 mm,层间距2.5 mm。扫描的CT图像经过网络传送至TPS系统。根据肺转移瘤的活动度左右方向外扩5 mm,腹背方向外扩6 mm。
所有的放射治疗计划均由固定的两名具有10年以上经验的放疗科医生完成。计划统一采用5野的静态 IMRT,DT 50 Gy/4fx/2W,2~3 次/周,95%以上的PTV满足处方剂量,90%处方等剂量线完全覆盖PTV,最大剂量点在靶区内,并控制在10%以内,严格控制肺V5<55%,V20<20%,使心脏和脊髓等危及器官的受量被控制在正常范围。所有患者的计划在剂量通量验证通过后才能实施。
四、疗效评价及随访
生存期的计算方法为患者首次接受肺转移瘤治疗至末次随访或死亡,研究终止时间为2017年3月。治疗后第1、3、6、12个月随访,均常规行胸部增强CT检查,评价肺内转移瘤的最大直径变化情况和放射性肺损伤,检查有无新发病灶。
依据CT检查结果,遵照“改良的实体瘤评价标准”计算肺内转移瘤的局部控制率[15],依据CTCAE4.0标准评价放射性肺损伤。本组患者共随访 7~23个月,平均(12.90±4.42)个月。
五、统计学方法
数据应用SPSS16.0软件进行分析,计量资料如年龄、转移瘤直径、肺转移时间、转移瘤个数用均数±标准差表示,比较采用成组t检验,分类资料比较采用非参数秩和检验(Mann-Whitney U检验)或卡方检验。采用Kaplan-Meier法计算生存率和绘制生存曲线,两组生存率的比较采用Log-Rank χ2检验。预后的多因素回归分析采用Cox回归模型,以P<0.05为差异有统计学意义。应用Graph-Pad Prism软件进行制图。
结 果
一、碘125粒子植入治疗情况
本研究植入的碘125粒子剂量平均为135 Gy(120~150 Gy),碘125粒子植入治疗组20位患者共52枚转移灶,共经过44次粒子植入治疗。共植入粒子数1310粒,平均每一个转移灶26粒(10~50粒)。
二、两组生存和肿瘤控制情况
A组的中位生存时间为15个月,大于B组的13 个月,差异无统计学意义(Log-Rank χ2=1.131,P=0.440),见图 1。两组第 1、3、6、12 个月的局部控制率均达到80%以上,差异无统计学意义(P=0.897),见表2。
三、疗效及预后的影响因素分析
A组肺转移瘤的治疗次数多于B组,差异有统计学意义(P=0.001);治疗后随访,B组肺炎、肺纤维化的损伤程度重于A组,差异有统计学意义,见表2。经多因素Cox回归分析结果显示,放射性肺炎分级较高为预后的独立危险因素(HR=2.213,95%CI:1.013~4.834,P=0.046)。
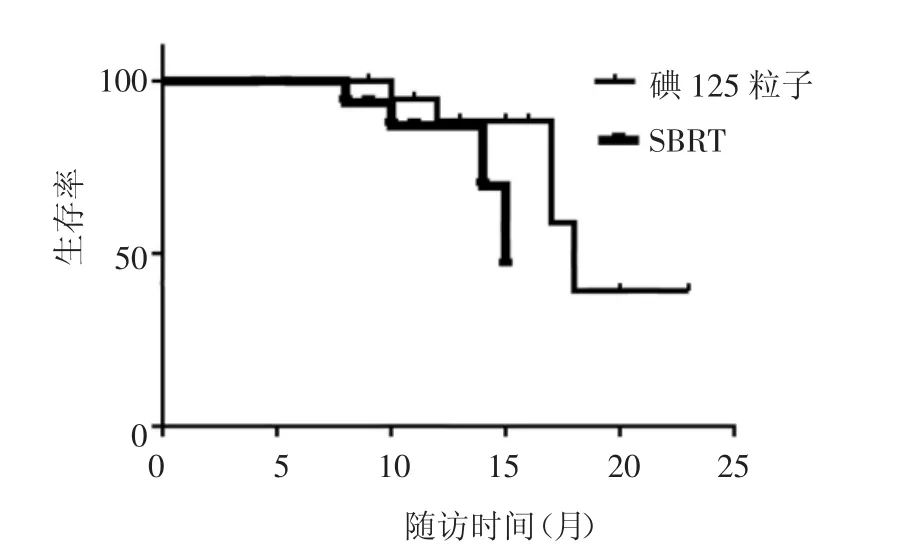
图1 两组生存曲线比较
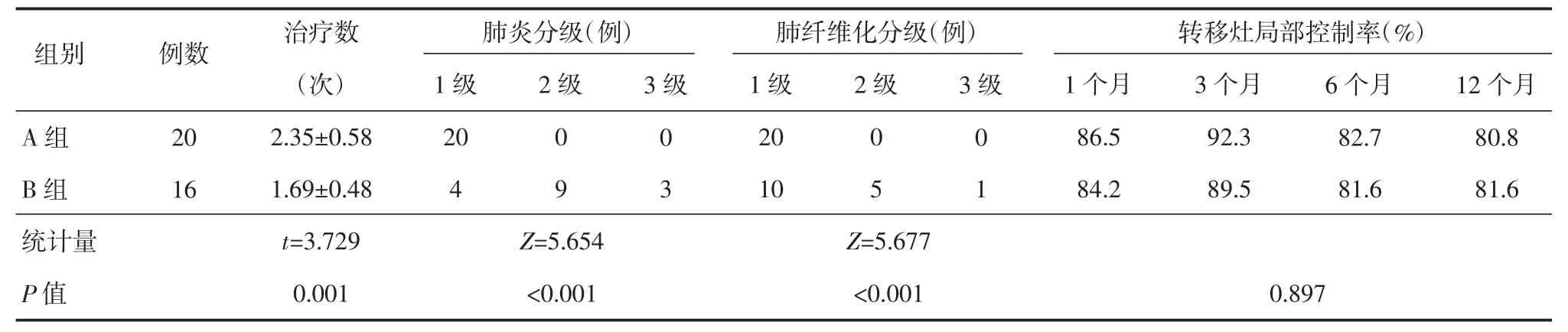
表2 两组的治疗情况及结果
四、术后主要并发症
36例患者均顺利完成治疗,A组穿刺过程中肺内产生少量渗出,可以通过尽量减少穿刺次数减少渗出。术后有8例出现气胸,肺压缩在30%以内,予以卧床、吸氧治疗后好转。术后3 d有13例患者出现咳嗽、咳痰,痰中带血,予以药物止血联合抗感染治疗后好转,见图2。未发现纵膈、皮下及血管内移位的粒子。B组患者放疗后3个月有12例患者出现咳嗽、咳痰,6个月后8例咳喘加重,予以地塞米松针联合预防感染支持治疗后好转,见图3。术后定期复查血常规、心肝肾功能均无异常。
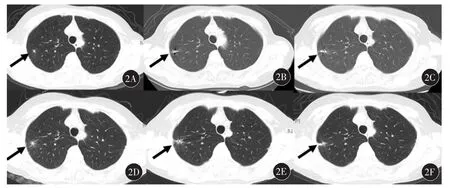
图2 典型病例(女性,66岁,结肠癌切除术后1年余右上肺转移瘤,直径约0.9 cm)行碘125粒子植入治疗前后
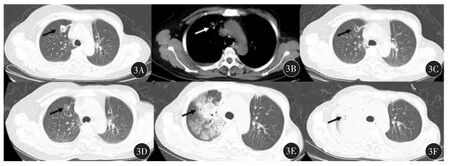
图3 典型病例(女性,51岁,结肠癌切除术后5年右上肺转移瘤,直径约1.8 cm)行局部SBRT放疗(DT 50 Gy/10Fx)前后
讨 论
目前,微创的治疗方法逐渐替代既往外科的毁损性治疗,尽量保留器官的理念为广大医生和患者普遍接受。Filippi等[16]研究认为SBRT治疗肠癌肺转移的疗效优于外科的肺转移灶局部切除术,可以替代外科治疗。Trakul等[17]总结重复照射局部复发的肺内肿瘤只能降低放射剂量和牺牲局部控制率。在肺内反复复发的病灶局部控制方面,Tochio等[18]和Crombé等[19]在应用射频消融治疗上均有比较成功的经验。Agolli等[20]研究SBRT治疗肠癌肺转移1年的局部无进展生存率为68.8%,本研究中发现不论是碘125粒子植入还是SBRT的1年局部控制率均达到80%以上。但是对于位于同一肺叶内反复复发的病灶来说,SBRT因为放射性肺损伤恢复时间较长,短期内无法反复多次进行局部放疗,而粒子植入治疗恢复快,放射性肺损伤轻微,短期内即可以反复进行植入治疗,两组比较有显著性的差异。可见因为肺损伤的不同,粒子植入有可以短期内重复治疗反复复发肺内转移瘤的优势。
本研究中两组肺内转移瘤的直径及肺转移再次出现的时间差异均无统计学意义。在两组肺内转移瘤的治疗过程中均发现对于肺内转移瘤及早干预治疗更易于控制,随着转移瘤直径的增大,不管是内照射还是外放疗,均会出现局部放射性肺损伤。而且随着肺内转移瘤直径的增大,治疗后引起的肺损伤将会更加严重。Owen等[21]研究发现对于反复复发的肺内转移瘤患者51%出现急性放射性肺炎,46%出现放射性肺纤维化。本研究发现SBRT组患者发生放射性肺炎和放射性肺纤维化的程度重于碘125粒子植入治疗组,且回归分析结果显示放射性肺炎分级较高为预后的独立危险因素。
粒子植入治疗肺内转移瘤的疗效在于一次性瘤内植入大剂量的放射源持续照射治疗[14,22]。本研究A组粒子植入的处方剂量平均为135 Gy(120~150 Gy),粒子植入的匹配周缘剂量(MPD)平均为135 Gy(130~145 Gy),B 组中 SBRT 的放射总剂量50 Gy,分4次在2周内完成,相比粒子植入的处方剂量明显偏低,而且没有做到对肺内转移瘤的持续治疗作用。虽然在局部控制率和中位生存时间方面两组无统计学差异,可能是因为入组病例数较少和随访的时间不够长。事实上按照计划植入粒子的病灶均能得到有效控制,而且半年内不会复发[14]。
本组患者术后的痰血、气胸虽然不严重,但是发生率高,穿刺的时候尽量沿着血管气管束的走行进行穿刺,不切割血管、气管,可以减少这些并发症。笔者以往的治疗经验是禁止同时治疗两侧肺叶,以避免同时发生两侧气胸事件[14]。为了避免双侧肺同时发生气胸,建议每次治疗单侧肺内的多发转移灶,而且尽量减少穿刺同一肺叶的次数。
综上,碘125粒子植入与SBRT均能有效控制肺转移瘤,对于肺内反复复发转移瘤,SBRT的应用受到肺组织内放射性肺损伤的限制,碘125粒子植入治疗可以短时间内反复应用,肺组织的放射性反应轻微,治疗肺转移瘤安全且高效。

