γ氨基丁酸(GABA)形成机理及富集方法的研究进展
王凯凯,孙 朦,宋佳敏,王鸿飞,邵兴锋,李和生,周文化,许 凤,*
(1.宁波大学食品科学与工程系,浙江宁波 315211;2.特医食品加工湖南省重点实验室,湖南长沙 410004)
γ-氨基丁酸(γ-aminobutyric acid,GABA)分子式为C4H9NO2,相对分子量103.2,是一种四碳、非蛋白氨基酸,在脊椎动物、植物和微生物中广泛存在[1]。GABA作为一种抑制性神经递质起到分子信号的作用,具有多种生理功能[2]。研究表明,GABA不仅具有降低神经元活性、防止神经细胞过热以及降低血压的作用,还具有防止动脉硬化、调节心律失常、降低血脂、增强肝功能等生理功效[3]。而且,GABA对癫痫、惊厥、亨廷顿病和帕金森病等多种精神疾病具有一定的疗效作用[1,4-5]。尽管GABA具有重要的生理功能,但随着人们压力的增大和年龄的增长,人体中的GABA含量日益减少。因此,从食物中补充GABA对人体健康意义重大。植物组织中GABA的含量极低,通常在0.3~32.5 μmol/g之间[6],不能满足人体的生理需求。已有文献报道,植物中GABA富集与植物所经历胁迫应激反应有关,在受到缺氧、热激、冷激、机械损伤、盐胁迫等胁迫压力时,会导致GABA的迅速积累[7-11]。对植物性食品原料采用某种胁迫方式处理后,或通过微生物发酵作用使其体内GABA含量增加,用这种原料加工成富含GABA的功能产品已成为研究热点[12]。近年来,GABA作为一种新型功能性因子,已被广泛应用于食品工业领域。利用富含GABA的发芽糙米[13]、大豆[14]和蚕豆[15]等原料开发的食品已面市。本文对GABA形成机理及富集方法的研究现状进行综述,为富含GABA产品的开发研究提供参考。
1 GABA形成机理
1.1 植物本身代谢途径
在植物体中有两条GABA合成和转化途径:一条是谷氨酸经谷氨酸脱羧酶(glutamic acid decarboxylase,GAD)催化谷氨酸脱羧合成GABA,称为GABA支路(GABA shunt)(如图1)[16];另一条是由多胺降解产物转化形成GABA,称为多胺降解途径(polyamine degradation pathway)(如图2)[17]。
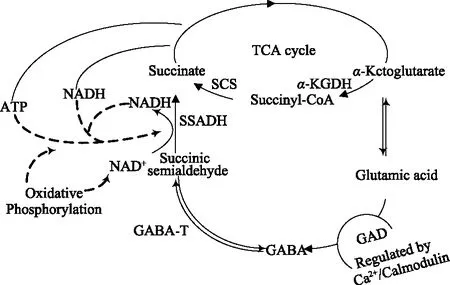
图1 GABA支路Fig.1 GABA shunt

图2 多胺降解途径Fig.2 Polyamine degradation pathway
1.1.1 GABA支路 在高等植物中,GABA的代谢主要由三种酶参与完成,首先在GAD作用下,L-谷氨酸(glutamic acid,Glu)在α-位上发生不可逆脱羧反应生成 GABA,然后在GABA 转氨酶(GABA transaminase,GABA-T)催化下,GABA与丙酮酸和α-酮戊二酸反应生成琥珀酸半醛,最后经琥珀酸半醛脱氢酶(succinic semialdehyde dehydrogenase,SSADH)催化,琥珀酸半醛氧化脱氢形成琥珀酸最终进入三羧酸循环(krebs circle)。这条代谢途径构成了TCA循环的一条支路,称为GABA支路[17]。Ludewig等[18]敲除拟南芥中调控琥珀酸半醛脱氢酶表达的基因后再对其进行光线和热激处理,结果发现,拟南芥中活性氧和GABA得到了显著提高,此结果进一步证实植物中GABA支路的存在。在植物中,存在于细胞质中GAD和线粒体中的GABA-T、SSADH共同调节GABA支路代谢,其中GAD是合成GABA的限速酶[19]。植物GAD含有钙调蛋白(CaM)结合区,GAD活性不仅受Ca2+和H+浓度的共同调控[20],还受到GAD辅酶-磷酸吡哆醛(PLP)以及底物谷氨酸浓度的影响[21]。这种双重调节机制将GABA的细胞积累与环境胁迫的性质和严重程度联系起来。冷激、热激、渗透胁迫和机械损伤均会提高细胞液中Ca2+浓度,Ca2+与CaM结合形成Ca2+/CaM复合体,在正常生理pH条件下能够刺激GAD基因表达,提高GAD活性;而酸性pH刺激GAD的出现是由于应激降低细胞的pH,减缓细胞受到酸性危害[22]。植物中GABA支路被认为是合成GABA的主要途径[23]。目前,大多数研究集中在如何提高GAD活性实现GABA富集。
1.1.2 多胺降解途径 多胺(polyamine,PAs)包括腐胺(putrescine,Put)、精胺(spermine,Spm)和亚精胺(spermidine,Spd),其中以腐胺作为多胺生物代谢的中心物质[24]。多胺降解途径是指二胺或多胺(PAs)分别经二胺氧化酶(diamine oxidase,DAO)和多胺氧化酶(polyamine oxidase,PAO)催化产生4-氨基丁醛,再经4-氨基丁醛脱氢酶(4-amino aldehyde dehydrogenase,AMADH)脱氢生成GABA的过程,多胺降解途径最终与GABA支路交汇后参与TCA循环代谢[16]。其中二胺氧化酶和多胺氧化酶是分别催化生物体内Put和 Spd、Spm降解的关键酶。蚕豆发芽期间,厌氧胁迫可诱导多胺合成的关键性酶活性的提高,促进多胺的积累,同时多胺氧化酶活性也随之提高,通过多胺降解途径促进了GABA的合成与积累,提高了蚕豆的抗逆境能力[15]。研究表明,大豆根中游离多胺含量在盐胁迫下增加,DAO活力提高,GABA富集量增加11~17倍[25]。尽管多胺降解途径被认为是合成GABA的另一条重要途径,但其在单子叶植物中合成GABA的能力远低于GABA支路。目前,对于多胺降解途径的研究多集中在豆类等双子叶植物上,且其贡献率在30%左右[26]。
1.2 微生物代谢途径
在微生物中,GABA代谢是通过GABA支路完成的,利用微生物体内较高的GAD活性,将Glu脱羧形成GABA,然后在GABA-T、SSADH作用下,GABA进入下游的分解过程生成琥珀酸半醛、琥珀酸参与微生物的生理代谢[26]。微生物富集GABA就是通过对培养基的优化以及菌株的改良使其具有较高的GAD活性,增加GABA合成率,降低分解率来实现的。目前,大量研究已证明GAD在原核到真核微生物中都有存在,此外,利用微生物中GAD脱羧形成GABA不受资源、环境和空间的限制,与其他方法相比具有显著的优势[27]。
2 GABA富集方法
2.1 植物富集法
在高等植物中,GABA富集与逆境条件下应激反应有关,包括机械损伤、低温胁迫、高温胁迫和盐胁迫等。实验表明,不同逆境胁迫条件引起植物体中GABA达到最大值所需要的时间以及含量的增加程度均会有所不同[22,26],这表明不同逆境胁迫诱导GABA积累机制有所不同。Kinnersley[22]认为,外界胁迫处理引起植物组织中GABA积累的可能机制主要有三方面:Ca2+的作用,H+的作用以及底物水平的变化。盐胁迫,低温和高温胁迫等逆境条件通过增加Ca2+的浓度,进而影响GAD活性,从而导致GABA在植物体内富集;而机械损伤和低氧胁迫积累GABA的机制可能是通过增加细胞质中H+浓度,激活GAD从而达到GABA富集;在三羧酸循环过程中,会导致有机酸的积累,提高了谷氨酸等底物的含量,进而导致GABA含量的增加。在逆境胁迫下,植物通过调节相关基因的表达水平使细胞对其所处的胁迫环境迅速产生感应,同时其相关酶的活性发生变化,除此之外,植物内源性渗透调节物质(GABA、Glu和PAs等)含量也会增加,以应对胁迫环境,提高植物的抗逆性[28]。
2.1.1 盐胁迫 盐胁迫条件下植物除提高可溶性物质含量以及抗氧化酶活力用以抵抗盐的渗透胁迫外,还会提高GABA代谢水平以此提高植物的耐盐性[28]。玉米幼苗经200 mmol/L NaCl处理,其GAD活性得到了明显提高,导致GABA的积累。此外,研究发现玉米幼苗根中GABA富集不仅早于茎和叶且含量也显著高于茎和叶,这说明在NaCl胁迫条件下通过提高GAD活性促进GABA的积累,且玉米幼苗的不同部位对盐胁迫感受强度也有所不同,影响GABA富集水平和富集时间[29]。对发芽过程中的五种小麦(Hurani 75、Sham I、Acsad 6、Um Qayes 和Nodsieh)进行NaCl处理,结果表明,在盐胁迫条件下,五种小麦中的gad基因表达量均有所增加,GABA含量得到提高,其中Um Qayes 在NaCl胁迫下GAD表达量最多,GABA积累最多[30]。番茄果实经50、100 mmol/L NaCl处理后,GABA含量分别是对照组的1.4、1.7倍,其果实重量降低,这表明植物可以通过GABA代谢增强其对盐胁迫的抗性[31]。Akcay等[32]在研究野生型、突变体烟草(CMSII)经盐胁迫处理后GABA代谢变化时发现,野生型烟草在盐胁迫下,gad基因表达量显著提高,GAD活性增强,GABA含量显著增加,CMSII中无显著变化,而两种烟草经长期(7~21 d)盐胁迫其GABA含量均显著提高,表明GABA富集受到盐胁迫处理时间的影响。目前,大多数研究主要分析在盐胁迫条件下,GABA支路与GABA富集之间的关系,而对此条件下多胺降解途径对GABA富集的作用缺乏系统性研究。
2.1.2 低氧胁迫 溶液中氧气浓度与空气中相比较低,将植物样品浸泡在溶液中可以形成一个低氧环境,从而以达到富集GABA的目的。在低氧条件下,植物的电子传递链被抑制,糖类物质主要通过糖酵解途径大量生成丙氨酸,进而积累乙醇和乳酸,导致细胞质酸化。细胞质中参与GABA合成限速酶GAD可在酸性环境下激活,GAD催化谷氨酸脱羧生成GABA的过程需H+参与,最适pH一般为5.5~6.0[28]。对采后草莓“Jewel”进行CO2(20%)处理,结果表明,草莓受到CO2胁迫压力后,其代谢产物(乙醇和乙酸乙酯)含量增加,GAD活性无明显差异,但GABA-T活性低于对照组,GABA降解率降低,导致GABA含量增加[33]。西红柿进行CO2(10%)处理,结果表明,经CO2处理gaba-t和ssadh基因表达量没有显著性差异,gad2和gad3基因表达量得到了显著性提高,而GABA-T活性降低,导致GABA分解率较低,GABA含量增加;且未完全成熟的西红柿经CO2处理,GAD活性高于成熟组,而GABA-T低于成熟组,其GABA含量高于成熟的西红柿,这表明在缺氧条件下GABA富集与果实的成熟度有关[34]。沈强等[35]对新鲜茶叶先采用真空氮气厌氧处理然后再进行除氮充氧,茶叶中GABA含量达到1.86 mg/g,但茶叶中的香气成分少于对照样,品质有所下降。Liao等[36]在对野茶树的鲜茶叶进行缺氧处理时发现,缺氧环境提高了腐胺和精胺含量,GAD基因(CsGAD1 和CsGAD2)表达出现上调,GAD和DAO活性得到提高,GABA含量达到0.73 mg/g FW,是对照组的20倍。蚕豆在发芽期间进行缺氧处理,豆胚中Glu和多胺含量显著性增加,GAD和DAO被激活,GABA含量达到了16 mg/g DW,是对照组的8.26倍,且多胺降解途径合成GABA的贡献约为30%[15]。低氧联合其他胁迫方式会进一步提高GABA的富集水平,一般低氧条件结合盐胁迫处理会使GABA富集水平进一步提高[29]。对缺氧条件下的发芽大豆分别联合NaCl、CaCl2处理,结果发现,联合处理组与只进行缺氧处理相比,GABA含量得到进一步提高,分别达到4.0、3.3 g/kg DW[26]。在国内,利用缺氧胁迫方式富集GABA的研究多集中在茶叶发酵以及豆类发芽等过程中,且对多胺降解途径不够深入。国外研究者通过气调的方式达到低氧高二氧化碳的环境,既能达到果蔬的保鲜作用又可以实现其体内GABA富集,为果蔬保鲜和GABA富集提供了一种新的思路。
2.1.3 机械损伤 植物受到机械损伤会破坏正常的细胞分区,使细胞质中的H+和Ca2+水平的增加,刺激GABA合成酶的活性,从而实现GABA的富集,抵御细胞所受到的逆境危害[22]。植物遭到植食性昆虫的啃食后可造成一定程度的机械损伤,研究发现,经昆虫啃食后的植物叶片,其中GABA含量显著性增加以抵抗昆虫对植物的进一步啃食伤害[37]。植物遭受昆虫咬伤后,植物防伪系统可通过刺激gad基因超表达,GAD活性提高,GABA合成率大于分解率,实现GABA富集[38]。Petrivalsky等[39]研究发现,当豌豆受到机械损伤后,4-氨基丁醛脱氢酶(AMADH)活性得到提高,且多胺含量、GABA含量增加,这表明AMADH可能对GABA含量增加有直接的贡献。目前,大多数研究主要集中在机械损伤后对产品品质的影响,如鲜切处理对植物中酚类物质含量和抗氧化活性的提高,而对GABA代谢研究鲜有报道。研究机械损伤胁迫下GABA代谢,并从分子角度进一步确定机械损伤胁迫在GABA积累中的作用将成为研究热点。
2.1.4 低温胁迫 低温胁迫条件下植物细胞发生一系列生理变化,包括植物细胞中碳水化合物、氨基酸含量的增加[40]。温度的迅速降低会导致植物细胞内的区室化现象加强,激活细胞质中GAD,从而提高植物中 GABA 含量,增强植物对低温逆境的抵抗作用,保护植物免受低温损害[41]。植物细胞质中有可能存有Ca2+逆境下的专有途径,低温可促使细胞中Ca2+释放,并且低温胁迫会使细胞内产生较大的冰晶体,对细胞膜系统具有显著的损害作用,会使Ca2+、H+等渗入细胞质激活细胞质中的钙调素结合区域,提高钙调蛋白表达水平,从而激活谷氨酸脱羧酶活性催化谷氨酸降解形成GABA,促进GABA积累[42]。菠菜置于低温环境中,其体内的蔗糖、抗坏血酸、脯氨酸、缬氨酸、亮氨酸以及GABA含量增加,提高了菠菜的营养价值[43]。刘畅等[44]选取大豆为原料,利用响应面分析法优化出大豆中GABA最佳的富集工艺条件。结果表明,当冷冻温度为-33.04 ℃、解冻温度为33.02 ℃、冷冻时间为19.08 h、解冻时间为19.70 h时,GABA含量达到11.67 mg/g。对萌发大豆进行冻融培养时发现,经过冻融培养的大豆新芽中GAD、DAO活性提高,GABA含量增加,达到2.34 mg/g DW,是未进行冻融培养嫩芽的7.21倍,这说明低温冻融处理可以激活GABA支路和多胺降解途径中关键酶,使GABA含量增加[45]。马丽等[46]以优质“长粒香”糙米为实验材料,采用正交实验优化出在低温胁迫下发芽糙米中GABA的最佳工艺条件,结果表明,当低温胁迫温度为0 ℃,胁迫时间为2 h,发芽时间为30 h时,GABA含量最高,为0.3516 mg/g。
2.1.5 高温胁迫 高温胁迫是指环境温度高于植物正常生长温度所造成的一种植物应激现象,主要有热激(短时间热处理)和干燥(长时间热处理)。在42 ℃高温诱导下,玉米幼苗内源GABA含量升高,处理48 h时达到最大,且GABA对玉米幼苗抵抗高温环境起着一定作用[47]。芝麻植株在50 ℃热激2 h,其GABA含量与对照组相比提高13%,热激后进行室温培养,其GABA含量增加到21%,这表明植物中GABA富集与其所处环境温度密切相关[48]。将插入T-DNA(影响拟南芥中钙调素基因的表达)的拟南芥置于42 ℃进行热激处理2 h,结果发现,拟南芥突变体cam5-4中GABA含量达到4.96 nmol/mg FW,是野生型的2倍,这可能是由于在高温胁迫下突变体中钙调蛋白的表达量提高,GAD被激活,最终导致GABA的积累[49]。拟南芥突变体pop2和野生型植株在42 ℃热激0.5 h,GABA开始富集,热激2 h,GABA含量得到显著性增加,但突变体pop2中GABA含量低于野生型拟南芥,这可能是由于突变体pop2中的GABA-T功能受到损伤,使得GABA支路受到限制,为了维持细胞中C/N平衡,大量谷氨酸被分解,造成GABA底物浓度降低,从而导致GABA合成量减少[50]。目前,通过高温胁迫方式实现GABA的富集主要是为了研究其与植物抗氧化以及自身保护之间的关系,多集中在植物生理学方面,而利用高温方式对采后植物性原料进行处理从而达到GABA富集的研究鲜有报道。
2.2 微生物发酵法
以谷氨酸及其钠盐(谷氨酸钠)或富含谷氨酸的物质为原料,利用大肠杆菌、曲霉菌、乳酸菌和酵母菌等微生物的发酵作用实现GABA富集的方法称为微生物发酵法。微生物发酵法具有成本低、富集含量高的优点[51]。利用微生物发酵富集GABA的研究己有文献报道,在早期的研究中,以大肠杆菌为生产菌进行微生物发酵富集GABA的研究较多,其原理是利用大肠杆菌体内较高的GAD活性,将谷氨酸脱羧转化为GABA[52]。利用大肠杆菌发酵生产GABA具有发酵速度快、产量高的优点,但其存在一定的安全隐患。近年来,一些安全性高的微生物,如乳酸菌、酵母菌、曲霉菌等用于GABA富集的研究已有报道[53-55]。
2.2.1 乳酸菌发酵法 乳酸菌是动物肠道内正常菌群,对人体安全有利的食品微生物,已被广泛应用于发酵食品的生产[55]。目前,已有文献报道乳球菌属(Lactococcus)、乳杆菌属(Lactobacillus)等一些乳酸菌具有合成 GABA的能力[14,56-57]。林谦等[58]对产GABA的乳酸菌(YS2)发酵条件进行初步优化并对优化条件下的谷氨酸脱羧酶基因(gadB)进行了纯化,结果表明,在初始pH6.0,用牛肉膏和蛋白胨为氮源,用蔗糖为碳源的条件下发酵,GABA含量可达到5.68 g/L,与优化前相比提高了30%,且此条件下纯化后的GAD活性达到1.06 U/mg。利用乳酸菌对经过冷激的红豆进行发酵处理时发现,在37 ℃条件下发酵24 h,红豆中GABA产量达到了682 mg/L,是未进行发酵的20倍[59]。利用乳酸杆菌GABA100和双歧杆菌BGN4对天麻粉进行联合发酵处理并对其发酵条件进行优化,结果表明,在含有3%(W/V)L-谷氨酸、10%(W/V)冷冻天麻粉,初始 pH6.5的培养基中添加0.5%菌液在30 ℃条件下进行联合发酵6天,GABA产量为122.2 mmol/L[60]。夏江等[61]对乳酸菌株hjxj-01进行紫外和γ射线诱变处理得到一株突变菌株 hjxj-08119,在含5%的L-谷氨酸钠的GYP培养基中培养3 d,此菌株的GABA最大积累可达到17 g/L,相对于hjxj-01提高142.9%。吴非等[62]对保加利亚乳杆菌L2进行紫外诱变处理得到高产GABA的菌株L2-4,其在含有1% L-谷氨酸培养基中的GABA产量为4.235 g/L,相对于原菌株的GABA产量提高了25.63%。由此可见,利用乳酸菌发酵生产GABA不仅可以通过优化培养基实现,也可以通过采用诱变育种的技术对菌株进行改性以达到GABA富集目的[63]。利用乳酸菌发酵生产GABA具有产量高,安全性好的优点,但其发酵速度慢,发酵周期比较长,适用于深层发酵。
2.2.2 酵母菌发酵法 酵母菌是一种含有大量氨基酸、蛋白质的兼性厌氧菌,在发酵食品的生产中应用广泛,其安全性较高,且具有较高的 GAD活性,是生产GABA的理想菌株,但目前对利用酵母菌发酵产生GABA的研究比较少。李亚莉等[64]以近平滑假丝酵母(Candidaparapsilosis)GPT-5-11为实验菌株,在初始pH6.5,含有0.5%谷氨酸的培养基中37 ℃发酵48 h,GABA产量最高可达2.58 g/L。以遗传稳定高产GABA的酵母菌株为材料,对其产GABA的发酵条件进行了优化,结果表明,在培养温度为30 ℃,摇床转速为220 r/min,接种量为4%,培养时间为4 d时,发酵液中GABA含量达到了2.588 g/L,比优化前提高了53%,为GABA工业化生产提供参考依据[65]。酵母菌发酵生产GABA具有发酵速度快,安全性高等优点,但其发酵产量相对较低。
2.2.3 曲霉菌发酵法 曲霉广泛分布于谷物、空气、土壤和各种有机物中,是发酵工业的重要菌种之一。Su等[66]选取曲霉CCRC 31615进行固体发酵时发现,向培养基中添加硝酸钠、磷酸氢二钾GABA产量分别达到1267.6、1493.6 mg/kg,这表明培养基中的营养物质会对菌株产GABA能力有所影响。对米曲霉3.800进行紫外诱变处理,得到稳定高产GABA的突变菌株3.800-4,然后分别在含有质量浓度为10 g/L谷氨酸PDA综合培养基和大豆-水的发酵培养基中发酵培养72 h,GABA产量分别达到4.491、0.874 g/L,相对与原菌株提高了23.58%、29.67%[67]。胡珊等[68]对20株产GABA红曲菌种进行了筛选并对高产菌株发酵工艺条件进行了优化,结果表明,高产菌MXL-8在含有2%大米粉、2.0%蛋白胨、1.5%酵母膏、0.15%硝酸钠、0.15%磷酸二氢钾和0.2%硫酸镁的培养基中培养6 d,其GABA 的产量为22.373 mg/mL,为利用红曲发酵生产富含GABA食品提供了实验依据。曲霉发酵法生产GABA,其发酵速度较慢,产量相对较低,但其安全性较高。
2.2.4 混合菌发酵法 将不同种的菌株混合发酵生产GABA的方法称为混合菌发酵法,其可以克服单一菌株发酵的缺点,GABA发酵产量高,具有较好的发展前景。利用红曲菌M1、红曲霉M2、酿酒酵母Sce01和乳酸菌Lac01四种菌株,以萌芽米为原料进行混合发酵,结果表明,M1+M2+Sce01+Lac01组合在发酵温度25 ℃、时间6 d、pH4.0、乳酸添加量为3%时发酵,GABA含量达到13.05 mg/g[69]。刘志强等[70]利用红曲酶SM048、乳酸杆菌Lac.1在pH4~4.5、30 ℃的条件下进行混合发酵,GABA产量为0.52 g/L,比SM048、Lac.1单独发酵分别提高了147.62%和62.5%。
以上可知,不同菌株产GABA能力有所差异,有各自的优缺点,但在实际生产中要求菌株必须满足安全生产标准。大肠杆菌虽然具有生长速度快,产量高等优点,但其存在生产安全隐患故不常用于食品工业;而乳酸菌、酵母菌以及霉菌等一些安全性较高的菌株正逐步应用于食品工业领域。酵母菌和曲霉虽然生产GABA能力低,但其安全性较高,发酵速度快等优点,通过利用现代诱变育种技术对其生产能力进行提高,将会在食品生产得到广泛应用;乳酸菌不仅具有较高的生产安全性与较高GABA生产能力还具有免疫调节,保持肠道菌群平衡等生理功能,因此利用乳酸菌发酵制备GABA还可发挥自身的益生效应。但其发酵周期较长,可以利用基因技术对乳酸菌进行改性克服其发酵周期长的缺点。此外,混合发酵法逐渐受到国内外研究者的关注,混合发酵就是利用多种菌株的相互作用,通过不同代谢途径的组合完成单一菌株不能单独完成的复杂发酵过程。目前,对混合发酵的报道越来越多,混合发酵生产法GABA具有广阔的研究前景。
3 结论与展望
GABA作为一种抑制性神经递质,参与哺乳动物中枢神经系统的调节活动,具有多重生理功能,对人体健康和保健具有积极作用。同时作为一种新型功能性因子,GABA已于2009年被国家卫生部列在新食品原料终止审查名单中,其应用前景受到广泛关注,并已在食品、医药和化妆品得到应用。GABA富集方法主要有植物富集法和微生物发酵法,其有各自的优缺点。植物富集法具有成本高、产率低等缺点,但其安全性较好。微生物发酵法具有成本低、产量高等优点,且不受空间、环境、资源的限制。微生物发酵生产GABA越来越受到国内外学者的重视,其中以乳酸菌发酵研究报道较多,生产技术较为成熟,此外,混合发酵法因其诸多优点将会在今后的微生物发酵生产中广泛应用。目前,GABA形成机理以及影响富集的因素已初步探明,但大多数研究集中在GABA支路及其代谢酶方面,其代谢途径的分子机制值得进一步阐明,且多胺降解途径也需要深入研究。

