响应面优化罗非鱼下脚料发酵制备蛋白肽的工艺
刘唤明,洪鹏志,*,周春霞,杨 萍,陈康健,吴金红
(1.广东海洋大学食品科技学院,广东省水产品加工与安全重点实验室,广东省现代农业科技创新中心,广东湛江 524088;2.广东省水产品深加工及副产物高值化利用工程技术研究中心,湛江恒兴水产科技有限公司,广东湛江 510300)
我国罗非鱼养殖产量和加工产量居于世界首位。冷冻罗非鱼片是罗非鱼加工的主要产品,但在其加工过程中会产生40%~55% 的下脚料[1-2]。罗非鱼下脚料有较高的蛋白质含量,且富含必需氨基酸[3],具有较高的利用价值。然而,目前国内绝大多数罗非鱼下脚料被加工成低级鱼粉出售,其价值并未得到充分利用,因此迫切需要寻找到罗非鱼下脚料的高值化利用途径。水产蛋白水解后可以产生具有抗氧化、抗菌、降血压和免疫调节等多种生理功能的活性多肽[4],因而制备活性肽是水产蛋白高值化利用的研究热点。目前,国内研究人员对罗非鱼下脚料的酶解工艺进行了大量的研究[5-8]。
现在国内多采用酶解法来制备水产蛋白多肽,此方法有工艺程序相对简单、易操作等,但其成本较高,且对水产蛋白固有的腥味没有去除作用。发酵法不但可利用微生物发酵产生的蛋白酶来降低活性肽的生产成本,而且还可通过微生物复杂的生化过程可在一定程度上去除水产蛋白固有的腥味[9],因而,近年来有关发酵法制备水产蛋白肽的研究得到了研究人员的关注[10-14]。
枯草芽孢杆菌是一种传统的发酵食品菌株,早在一千多年前日本利用枯草芽孢杆菌发酵生产他们的传统食品——纳豆。枯草芽孢杆菌具有丰富的产酶能力,其生产的蛋白酶、淀粉酶、糖化酶和脂肪酶等广泛应用于食品工业。目前,研究人员已将枯草芽孢杆菌广泛地应用于发酵法制备乳蛋白肽[15]、大豆肽[16-17]和胶原蛋白肽[12]等多种蛋白肽。本研究以枯草芽孢杆菌为出发菌株,利用响应面实验对其发酵罗非鱼下脚料制备蛋白肽的工艺进行优化,以期进一步提高罗非鱼下脚料蛋白质的水解度,为罗非鱼蛋白肽的发酵制备提供参考。
1 材料与方法
1.1 材料与仪器
罗非鱼下脚料 去除罗非鱼下脚料中的内脏和鱼皮,清洗下脚料中保留的鱼头、鱼骨及其附着的鱼肉,用绞肉机将清洗干净的保留物绞碎,绞碎物置于-20 ℃冰箱中冻藏备用,湛江亚洲水产科技有限公司;枯草芽孢杆菌(Bacillussubtilis)HL-1 广东海洋大学食品科技学院海洋生物制品研究团队;LB液体培养基(%):牛肉膏0.5,蛋白胨1,NaCl 0.5,pH7.2 实验室自制;茚三酮 分析纯,汕头市西陇化工有限公司;甘氨酸 分析纯,山东佰仟化工有限公司。
HZQ-F160型恒温摇床 金坛市万华实验仪器厂;YXQ-SG46-280SA型灭菌锅 上海博讯实业有限公司;CR22G II型高速冷冻离心机 日本日立公司;UV-210PC型分光光度计 上海森超贸易有限公司。
1.2 实验方法
1.2.1 罗非鱼蛋白肽的制备方法 将Bacillus subtilis HL-1菌株接种于LB液体培养基中,并于37 ℃、150 r/min振荡培养(15±0.5) h。培养结束后将培养液用无菌LB液体培养基调整混合液的OD630至1.01~1.05制备种子液备用。将绞碎后一定质量的罗非鱼下脚料解冻后放入到250 mL三角瓶中,加入一定的蒸馏水和葡萄糖,并于121 ℃灭菌20 min。冷却后接入Bacillus subtilis HL-1的种子液,然后将接入种子液的三角瓶置于恒温振荡摇床中,一定温度下,150 r/min培养一定时间发酵结束后于8000 r/min离心10 min,收集上清液;最后将上清液置于95 ℃保温5 min进行灭酶,得到罗非鱼下脚料蛋白肽水溶液。
1.2.2 水解度测定方法 参考刘唤明等[12]的方法测定发酵后罗非鱼下脚料蛋白的水解度。
1.2.3 爬坡实验(Plackett-Burman,PB)设计 分别选取罗非鱼下脚料添加量、培养基装载量、葡萄糖添加量、发酵温度、接种量、发酵时间和接种时间这7个因素的高、低2个水平,采用PB法设计7因素2水平的实验,实验因素及水平编码如表1所示。以罗非鱼下脚料蛋白的水解度为响应值,通过比较各因素的显著性水平,筛选出对罗非鱼下脚料蛋白的水解度的影响较为显著的因素。

表1 Plackett-Burman设计的因素水平及编码Table 1 Factors and levels of Plackett-Burman experiment design
1.2.4 最陡爬坡实验 以罗非鱼下脚料蛋白的水解度变大的梯度方向为爬坡方向,在PB实验及其分析结果的基础上设计最陡爬坡实验,选取对罗非鱼下脚料蛋白的水解度的影响较为显著的因素进行梯度设计,正效应的显著因素其梯度为递增,负效应的显著因素其梯度为递减,具体实验安排见表5。
1.2.5 Box-Behnken实验设计 以最陡爬坡实验的极值点作为响应面设计的中心点,采用Box-Behnke实验设计进行响应面实验,因素和水平见表2。通过实验数据拟合响应面模型,得到二次多项式,据此建立水解度与对其影响较为显著的因素之间的经验模型。

表2 响应面分析实验因素及水平Table 2 Factors and their coded levels tested in response surface analysis
1.2.6 罗非鱼蛋白肽分子量分布的测定 参照陈星等[18]的方法,采用高效体积排阻色谱法(High Performance Size Exclusion Chromatography,HPSEC)分析经响应面优化后制备的罗非鱼蛋白肽的分子量分布情况。罗非鱼蛋白肽水溶液测定前过0.22 μm微滤膜。使用色谱柱:TSKgel G2000 SWXL(300 mm×7.8 mm);柱温:30 ℃,流动相:超纯水∶乙腈∶三氟乙酸=55∶45∶0.1;流速:0.5 mL/min;测定紫外检测波长:220 nm;进样量:10 μL。分子量标准品为:细胞色素C(12500 u);抑肽酶(6500 u);杆菌酶(1450 u);乙氨酸-乙氨酸-酪氨酸-精氨酸(451 u);乙氨酸-乙氨酸-乙氨酸(189 u)。根据出峰时间和分子量大小的对数作分子量标准线性回归方程为 Lg Mr=-0.231x+7.051(R2=0.995),样品的分子量根据其洗脱时间和标准曲线求得。
1.3 数据处理
所有实验做3个平行。用Minitab17.0软件对PB实验进行设计和数据分析,用Minitab17.0软件对Box-Behnken实验进行设计和数据分析
2 结果与分析
2.1 PB实验设计及优化
PB实验设计及结果见表3,其统计分析结果见表4。由表4结果可知:罗非鱼下脚料添加量、葡萄糖添加量和发酵时间对水解度呈正效应,装液量、发酵温度、接种量和接种时间对水解度呈负效应;其中装液量、发酵温度和罗非鱼下脚料添加量罗非鱼下脚料添加量对水解度的影响均显著(p<0.05)。因此选择装液量、发酵温度和罗非鱼下脚料添加量罗非鱼下脚料添加量这3个因素作为主要影响因素进行最陡爬坡实验和响应面实验。

表3 Plackett-Burman实验设计方案与结果Table 3 Plackett-Burman design and results
2.2 最陡爬坡实验结果
由表4结果可知,罗非鱼下脚料添加量是正效应,所以在最陡爬坡实验中它的变化方向是递增的;而装液量和发酵温度是负效应,因而在最陡爬坡实验中它们的变化方向是递减的。由表5结果可知,水解度在第3组达到最大值,因而以罗非鱼下脚料添加量罗非鱼下脚料添加量为12%、装载量为40 mL/250 mL和发酵温度为33 ℃作为响应面实验的中心点。

表4 Plackett-Burman实验结果对水解度影响的统计Table 4 Statistical analysis of the Plackett-Burman experiment results on degree of hydrolysis

表5 最陡爬坡实验安排及结果Table 5 Experimental design and results of steepest ascent
2.3 响应面实验优化发酵工艺
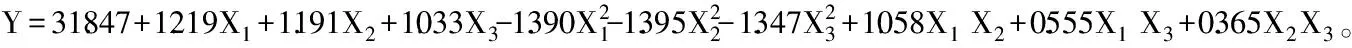

表6 Box-Behnke实验设计及其结果Table 6 Experimental design and results of Box-Behnken experiment


表7 回归方程的方差分析表Table 7 Variance analysis for regression equation
2.3.2 响应面分析和最佳发酵工艺确定 罗非鱼下脚料添加量与装载量、罗非鱼下脚料添加量与发酵温度、装载量与发酵温度之间的交互作用如图1所示。从图1可以看出响应面都为开口向下的凸形曲面,说明实验存在水解度的最大值。装载量与罗非鱼下脚料添加量的响应面图和发酵温度与罗非鱼下脚料添加量的响应面图都比较陡峭,且它们的等高线呈椭圆,这说明它们的交互作用比较显著,这与表7的回归分析结果一致。运用Minitab17.0软件对上面二次回归方程中的响应值求最大值,得出极值点为X1=0.899、X2=0.859、X3=0.677,并由计算得出相应的罗非鱼下脚料添加量为13.8%、装载量为48.6 mL/250 mL、发酵温度为34.4 ℃,预测的水解度最大值为33.26%。

图1 两因素间交互作用对水解度影响的响应面图Fig.1 Response surface plots showing the interaction of parameters on the degree of hydrolysis
2.3.3 验证实验 为了验证预测值的准确性,依照上面响应面分析得到的最佳发酵工艺,并结合实际实验操作的可行性,选取罗非鱼下脚料添加量为13.8%、装载量为48.6 mL/250 mL、发酵温度为34 ℃。并在上述工艺下做了3次重复实验,测定水解度的结果分别为33.15%、33.02%和33.20%,平均值为33.12%,与预测值(33.26%)基本一致,说明该模型可较好地预测实际发酵情况。
2.4 罗非鱼蛋白肽的分子量分布情况
经响应面优化后制备的罗非鱼蛋白肽的分子量分布情况用高效体积排阻色谱法分析测定。由图2结果可知,罗非鱼蛋白肽的出峰时间集中在15~25 min之间。由表8结果可知,罗非鱼蛋白肽的分子量都在5000 u以下,且分子量在231~637 u蛋白肽所占的比例为74.058%。根据海洋鱼低聚肽粉的国家标准[19],分子量在1000 u以下的为低聚肽。因而本研究制备的罗非鱼蛋白肽中低聚肽含量达74.058%。
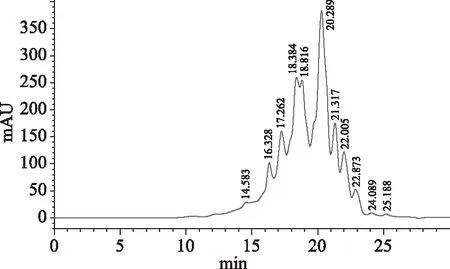
图2 罗非鱼蛋白肽的HPSEC图谱Fig.2 HPSEC chromatogram of peptide from tilapia scraps
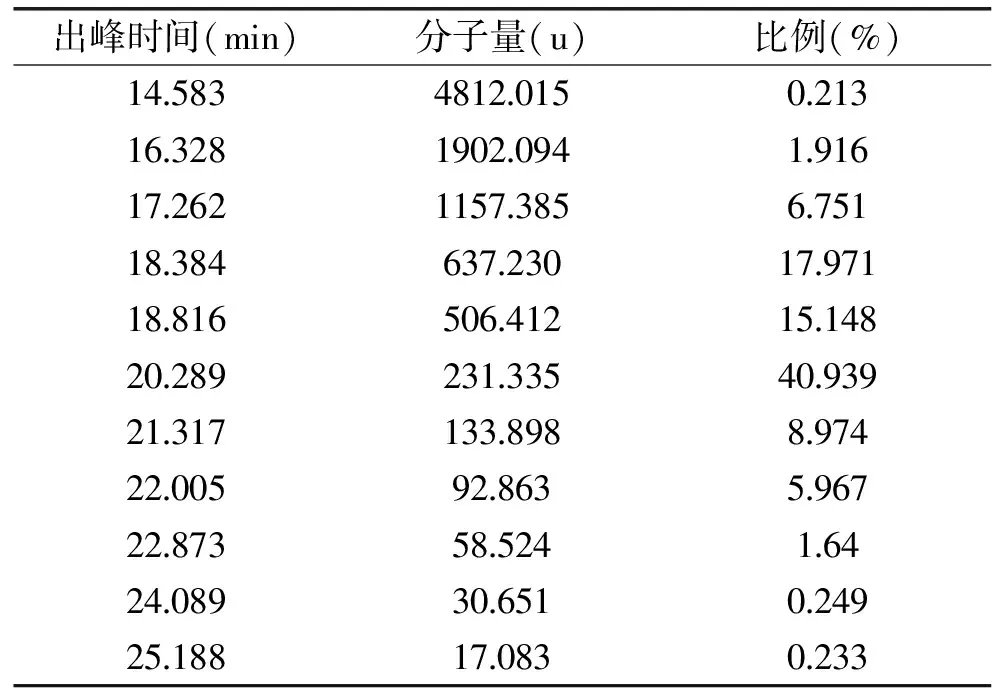
表8 罗非鱼蛋白肽的分子量分布Table 8 Molecular weight distribution of the peptide from tilapia scraps
3 结论
本研究以实验室保藏的枯草芽孢杆菌HL-1为发酵菌株,采用响应面实验对其发酵罗非鱼下脚料制备蛋白肽的工艺进行了优化。首先通过Plackett-Burman实验筛选出影响水解度的显著因素:罗非鱼下脚料添加量、装液量和发酵温度。接着通过最陡爬坡实验逼近最大水解度区域。最后利用Box-Behnken实验进行响应面分析,确定最佳发酵工艺为:罗非鱼下脚料13.8%、发酵温度为34 ℃、装载量为48.6 mL/250 mL。优化后罗非鱼下脚料中蛋白质的水解度高达33.12%,制备的罗非鱼蛋白肽中低聚肽含量高达74.058%。
——以S公司的端材、铜屑管理为例

