融合疏水蛋白在银耳中的异源表达
陈少敏,朱涵予,刘冬梅,许丹云,马爱民
(华中农业大学食品科学技术学院,湖北武汉 430070)
疏水蛋白(Hydrophobins)是目前已知的一类表面活性极强的小分子量两性蛋白,约含有100个氨基酸,分子量约为10 kDa,广泛存在于各种丝状真菌中。根据氨基酸排列方式和性质的不同,疏水蛋白分为Ⅰ型和Ⅱ型两种[1]。I型疏水蛋白自我装配形成的蛋白膜具有高度的不溶解性,即使在100 ℃水浴时也难溶解于2% SDS,只有在强酸如甲酸和三氟乙酸中才可以被解离[2-3]。疏水蛋白一个非常重要的特性就是当它们遇到亲水―疏水界面时就会发生自组装,形成一层两亲性的薄膜,厚度约为10 nm,性质十分稳定,且能改变界面的亲水性和疏水性[4-5]。因此,疏水蛋白在食品、医学、工业等领域具有强大的应用前景,如疏水蛋白的乳化性可以作为许多食品的稳定剂、疏水性可用于食品的保鲜[6-7]以及用作生物材料[8-9]、疏水蛋白SC3在小鼠模型也表现出较强的抗肿瘤作用[10]。
银耳(Tremellafuciformis),又称白木耳、雪耳等,在分类学上隶属于真菌门,担子菌纲,异隔担子菌亚纲,银耳目,银耳科,银耳属[11]。银耳被誉为“菌中之冠”,是一种珍贵的食用药用两用菌。银耳能产生酵母状的单核体芽孢,是一种良好的生物反应器[12-13]。
本实验室前期从平菇菌丝中克隆到Ⅰ型疏水蛋白基因Po.hyd[14],并在银耳芽孢中成功实现了异源表达[15]。为进一步改善疏水蛋白的性质,充分利用疏水蛋白的潜在应用和银耳的可食性优势,本实验试图用分子生物学的方法对疏水蛋白进行改造,将平菇疏水蛋白基因hyd与去除终止密码子的hyd拼接,形成融合疏水蛋白H-H,并导入到银耳芽孢中表达,希望改善疏水蛋白的性质,同时也为其他蛋白质的改性研究提供新思路。
1 材料与方法
1.1 材料与仪器
银耳芽孢32Y、平菇菌丝P739、根癌农杆菌EHA105 本实验室保存;质粒pEGH 由本实验室朱涵予改造pCAMBIA1302质粒并保存[16];大肠杆菌DH5α、pMD18-T克隆载体、限制性内切酶SacⅠ、MluⅠ、BamHⅠ、AsuⅡ、XhoⅠ 大连TaKaRa;T4 DNA Ligase 美国Promega;凝胶纯化试剂盒、回收试剂盒和质粒提取试剂盒 美国Axygen;Southern杂交试剂盒 美国GE;PDA培养基、LB培养基;YEB培基、IM培养基、Co-CM培养基、三氟乙酸(Trifluoroacetic acid,TFA) Sigma公司;低分子量蛋白标准 TaKaRa公司;其他试剂 均为分析纯。
PCR仪 美国Bio-Rad公司;冷冻干燥机 德国Christ公司。
1.2 实验方法
1.2.1 培养基配制 PDA培养基:称取46 g PDA粉末,用蒸馏水定容至1 L,添加1.5% 琼脂粉,121 ℃高压蒸汽灭菌30 min。
YEB培养基:蛋白胨5 g/L,酵母提取物1 g/L,营养肉汤5 g/L,蔗糖5 g/L,七水硫酸镁0.5 g/L,NaOH调节pH至7.2,用蒸馏水定容至1 L,添加1.5%琼脂粉,121 ℃,30 min高温高压灭菌。
MM培养基:葡萄糖20 g,硫酸铵1.32 g(含N 20 mmoL/L),MgSO4·7H2O 0.25 g,kH2PO4·3H2O 0.5 g,VB1 0.2 mg,ZnSO4·7H2O 2 mg,CaCl2·2H2O 0.5 g,钼酸铵 0.02 mg,补足ddH2O定容至1 L,121 ℃高压蒸汽灭菌20 min。
IM培养基:20×磷酸缓冲溶液5 mL,20×盐溶液5 mL,50% 甘油1 mL,1 mol/L葡萄糖溶液1 mL,1 mol/L MES溶液4 mL,200 mmol/L AS溶液0.1 mL,补足ddH2O定容至100 mL。
Co-CM培养基:20×磷酸缓冲溶液5 mL,20×盐溶液5 mL,50%甘油1 mL,1 mol/L葡萄糖溶液0.5 mL,1 mol/L MES溶液4 mL,200 mmol/L AS溶液0.1 mL,补足ddH2O定容至100 mL。
1.2.2 基因的克隆及载体的构建 根据NCBI上发表的Po.hyd(GenBank登录号为No.AF331452.1),利用软件Primer 5.0进行引物设计,如表1所示。

表1 所用引物序列Table 1 Primers used in this study
收集PDA平板上P739平菇菌丝并提取总RNA。以提取的RNA为模板,用Ancheored Oligo(dT)18体系反转录RNA得到cDNA(具体操作步骤参照TransScript®One-Stepg DNA Removal and cDNA Synthesis Super Mix说明书)。以cDNA为模板,H1-F/R和H2-F/R引物,分别扩增平菇疏水蛋白基因hyd与去除终止密码子的hyd。扩增条件:95 ℃ 5 min,95 ℃ 30 s、61 ℃ 30 s、72 ℃ 30 s,循环数为34个,72 ℃ 7 min。分别用BamHⅠ、AsuⅡ和MluⅠ、BamHⅠ双酶切PCR纯化产物,并用Mlu Ⅰ、Asu Ⅱ双酶切pGEH质粒,胶回收双酶切的产物,并通过酶连反应构建H-H的表达载体pEGH-H-H。将pEGH-H-H转化DH5α大肠感受态,用H1-F/R引物进行菌落PCR验证,并对菌落质粒进行Mlu Ⅰ、Asu Ⅱ双酶切验证。pEGH-H-H载体图如图1所示。提取阳性转化子的质粒,将其电击转化A.tumefaciensEHA105,用H1-F/R引物进行菌落PCR检测。

图1 pEGH-H-H载体图Fig.1 pEGH-H-H vector
1.2.3 转化子的筛选及鉴定 通过根癌农杆菌介导转化方法将pEGH-H-H载体质粒导入到银耳的基因组中[17]。将含有pEGH-H-H的根瘤农杆菌接种到含50 μg/mL 卡那和50 μg/mL利福平的YEB,28 ℃ 150 r/min振荡培养24 h,吸取120 μL菌液,接种到12 mL上述液体培养基中,28 ℃ 150 r/min振荡培养至菌液OD600值为0.6~0.8,4 ℃ 5000 r/min离心10 min,弃滤液,用新鲜配制的含有200 μmol/L AS的IM培养基重悬菌体至OD600值约为0.1~0.15,于28 ℃ 150 r/min振荡培养诱导根癌农杆菌毒性,直至菌悬液OD600值为0.6。将银耳芽孢接种于液体MM培养基中7 d,用IM培养基调节孢子浓度为106个/mL。将已诱导根瘤农杆菌菌悬液与银耳芽孢悬液混合后,涂布于铺有无菌滤膜的共培养培养基中,25 ℃培养3 d,将滤膜转接到含有50 μg/mL潮霉素和200 μg/mL头孢平板上筛选转化子,连续筛选3代。将所获得的转化子于无抗PDA培养基中,25 ℃培养7 d,提取DNA,并用H1-F/R和EH-F/R检测。
扩大培养拟转化子,提取其基因组DNA经XhoⅠ酶切过夜,以hyd基因作为杂交探针进行Southern blot检测[18]。并提取阳性转化子和野生型银耳32Y的mRNA交由武汉巴菲尔生物技术服务有限公司进行实时荧光定量PCR分析,检测引物如表1所示。
1.2.4 目标蛋白的提取 按照马爱民等[19]报道的方法提取目标蛋白。将拟转化子接种于PDA培养基中,25 ℃培养20 d后冷冻干燥,并以野生型平菇P739菌丝作为对照组,按照料液比1∶10 (m/v)溶解于抽提液I(2% SDS,0.05 mol/L Tris pH6.8)中,100 ℃保持10 min,4000 r/min 离心15 min。所得沉淀溶解于抽提液II(氯仿∶甲酵=2∶1),65 ℃保持10 min,并过滤收集沉淀。向沉淀中加入三氟乙酸溶解,置于冰上放置6 h。所得的样品经十二烷基磺酸钠―聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分析,并采用硝酸银染色检测[20]。
1.2.5 疏水蛋白的起泡性和乳化性分析 将银耳芽孢转化子5号以及平菇P739的疏水蛋白配制成终浓度为50 μg/mL的样品,分别取600 μL蛋白溶液,用振荡混匀仪处理30 s,并在1、3 h 和7 d后取样进行起泡性和乳化性分析[21]。
1.3 数据处理
每组实验做平行实验三次,数值取平均值表示。数据采用Oligo 8.0软件处理。
2 结果分析
2.1 基因的克隆与序列分析
平菇菌丝总RNA的电泳胶图如图2A所示,条带亮度比表明RNA比较完整,符合要求。疏水蛋白cDNA序列扩增结果如图2B所示,条带大小符合预期且无杂带,结合测序结果表明成功扩增平菇疏水蛋白的两个片段。

图2 平菇总RNA与PCR扩增产物 Fig.2 Total RNA of P. ostreatus and PCR products 注:A:平菇菌丝总RNA;B:平菇疏水蛋白基因两个片段PCR结果,其中1泳道为去除TAA的hyd基因,2泳道为完整的hyd基因;M:Trans 2K DNA marker。
2.2 表达载体pEGH-H-H的构建
将双酶切产物和pEGH进行连接,转化,用H2-F/R进行菌落PCR检测,如图3A所示,在330 bp和660 bp的位置都有带,分别为单一的疏水蛋白基因和融合疏水蛋白基因,与预期相符。对pEGH-H-H进行MluⅠ、AsuⅡ双酶切,如图3B所示,在大约660 bp处有一条明显的带,结果表明,pEGH-H-H载体构建成功。
提取pEGH-H-H质粒,并电转化到根癌农杆菌EHA105,H2-F/R引物进行菌落PCR检测,如图3C所示,在330 bp和660 bp的位置分别有条带,说明pEGH-H-H质粒成功导入根癌农杆菌EHA105中。

图3 菌落PCR与pEGH-H-H质粒双酶切验证结果Fig.3 Colony PCR and digestion of pEGH-H-H plasmid注:M:Trans 2K DNA marker;A:泳道1、2 为随机挑取含pEGH-H-H质粒的大肠杆菌单菌落PCR结果;B:泳道1、2为随机挑取2个含pEGH-H-H大肠杆菌的质粒双酶切结果 C:泳道1~4为随机挑取4个含pEGH-H-H质粒的根瘤农杆菌菌落PCR结果。
2.3 转化子的PCR筛选及验证
通过根癌农杆菌介导转化将pEGH-H-H载体质粒导入到银耳的基因组中。在潮霉素平板上随机挑芽孢转化子,以拟转化子的DNA作模板,分别用EH-F/R和H2-F/R引物进行PCR检测,结果如图4所示。其中EH-F/R引物扩增的带大小约为550 bp,H2-F/R在330 bp,660 bp左右都有带,结果与预期相符,表明融合疏水蛋白成功导入到银耳芽孢中。

图4 转化子PCR验证结果Fig.4 Transformant verification by colony PCR注:A:EH-F/R引物PCR扩增结果,其中泳道1~5为转化子;B:H2-F/R引物PCR扩增结果,其中泳道1为野生型32Y,泳道2~6为拟转化子;M:Trans 2K DNA marker。
2.4 转化子Southern blot分析
选取10个转化子作Southern blot分析,结果如图5所示。5号芽孢为三拷贝,8号为双拷贝转化子,而1、2、10号为单拷贝转化子,3、4、6、7、9号转化子未获得杂交信号,可能为假阳性,也有可能是在第3~5代传代接种的过程中,部分转化子多次传代后出现了抗性基因丢失,有研究表明内源强启动子有助于维持转化子遗传性状的稳定表达[22]。

图5 转化子Southern杂交结果Fig.5 Southern blot analysis of transformants 注:M:λ DNA/HindⅢ marker,CK1为阴性对照32Y芽孢,CK2为阳性对照载体质粒,1~10分别1~10号转化子。
2.5 转化子real-time PCR分析
选取32Y野生型芽孢和1、5、8、10 号转化子芽孢进行Real-time PCR分析,结果如图6所示。其中1、8、5号均有表达,8号和5号表达量较高,分别为野生型对照组的5.071倍、11.406倍,结果与Southern blot分析结果一致,而1号可能为假阳性转化子或单拷贝。
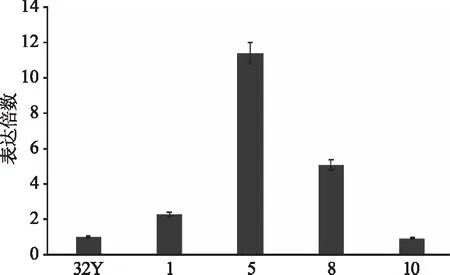
图6 野生型及转化子的实时定量检测结果Fig.6 Real-time PCR of the wild-type and transformants注:32Y为野生型银耳芽孢;1、5、8、10为转化子。
2.6 目标蛋白的提取及电泳检测
选取5号转化子扩大培养,以P739平菇菌丝为对照组,利用三氟乙酸法提取目标蛋白,SDS-PAGE检测,如图7所示。从图中能明显看出5号转化子能提取出目标蛋白(箭头所指),此蛋白的大小与野生型平菇菌丝中的疏水蛋白有明显差异,约为P739平菇菌丝疏水蛋白的二聚体大小类似,表明平菇融合蛋白在银耳芽孢中成功表达。
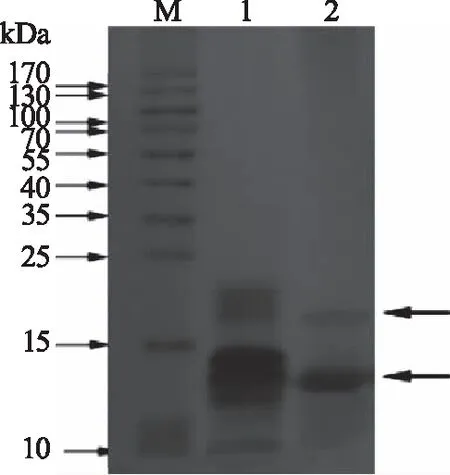
图7 纯化融合蛋白的SDS-PAGE电泳结果Fig.7 SDS-PAGE result of the purified fusion protein注:M为蛋白质分子量marker;泳道1为平菇P739菌丝;泳道2为5号转化子。
2.7 起泡性和乳化性分析
使用振荡混匀仪处理终浓度为50 μg/mL的平菇P739疏水蛋白溶液和银耳芽孢5号转化子的融合疏水蛋白溶液,如表2所示,5号转化子的蛋白溶液泡沫明显高于平菇P739的蛋白溶液泡沫,且在一周后泡沫仍然保持一定高度。从表3可知,5号转化子蛋白溶液的乳化指数(EAI)和乳化稳定性(ESI)均高于SDS。由此可见,5号转化子疏水蛋白溶液的性质比平菇的疏水蛋白溶液有一定程度的提升。

表2 起泡性和泡沫稳定性Table 2 Foamability and foam stability

表3 乳化性及乳化稳定性Table 3 Emulsibility and emulsion stability
3 结论
本研究通过双酶切酶连方法,构建融合疏水蛋白基因H-H,并利用根癌农杆菌介导转化方法将其成功导入到银耳芽孢中。Southern杂交验证发现,转化子中存在单拷贝、双拷贝和多拷贝等不同的插入情况。实时荧光定量PCR显示,高拷贝转化子中的疏水蛋白相对含量要比单拷贝高,该结果与Southern杂交结果一致。
5号转化子疏水蛋白的相对表达量最高,为野生型的11.4倍。蛋白溶液起泡性和乳化性比较发现,5号转化子融合疏水蛋白的性质稍优于平菇疏水蛋白,其原因可能与融合疏水蛋白中二硫键的数量较平菇疏水蛋白提高有关。

