热变性对海参肠酶解物活性的影响
姜 卉,金文刚,许景光,吴海涛,王笑涵,商文慧,韩佳润,唐 越,*
(1.大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁大连 116034;2.陕西理工大学生物科学与工程学院,陕西省资源生物重点实验室,陕西汉中 723001)
海参(Stichopusjaponicas)属棘皮动物门,海参纲,是一类重要的海洋无脊椎动物。海参是一种传统的海洋来源食品,同时也是重要的药物资源,深受亚洲各国消费者的喜爱[1]。相关研究表明,海参体内含有较多如多糖[2]、皂苷[3]、萜甙[4]、脂肪酸[5]、多肽[6]等利于人体健康的成分,具有抗炎、抗过敏[3]、抗真菌[4]、提高免疫力[5]、降血压[6]、延缓衰老和防治肿癌[7]等作用。
海参制品主要以海参体壁为加工对象,海参肠大多数被直接丢弃,不仅对环境造成了污染,还浪费了蛋白质资源,附加值较低[8]。随着人们对海洋生物资源认识的提高,从海洋中获得食品蛋白质和生物活性物质,利用酶制剂加工海产品副产物,制备蛋白质水解产物和多肽,获得功能性食品原料等,已成为各国进行海洋资源开发利用的重要项目[9],例如非洲鲶鱼抗菌肽[10],巴沙鱼皮血管紧张素转化酶抑制肽[11]等,相关研究还讨论了预处理对鳙鱼水解产物抗氧化活性的影响[12],但对于海参肠活性肽的研究仍属少数。
本课题组前期已对海参肠进行了一定的研究,主要集中在对海参肠中各种酶类进行分离纯化,如β-1,3-葡聚糖酶[13],溶菌酶[14],海参自溶酶[15]和组织蛋白酶B[16]等,探究多种海参肠内源酶的特性及其对海参自溶的影响,但并未研究外源酶对海参肠的影响。本研究以海参肠为原料,结合热变性预处理,选用中性蛋白酶对其进行酶解,制备海参肠活性多肽,为海洋来源生物活性物质的进一步扩展研究提供新思路。
1 材料与方法
1.1 材料与仪器
海参肠 大连长兴水产品批发市场;中性蛋白酶(酶活370000 U/g) 南宁庞博生物制药有限公司;Sephadex G-25葡聚糖凝胶 Pharmacia公司;还原型谷胱甘肽(GSH)、肽分子量标准品:18肽(2342 Da) 西安联美生物科技有限公司;维生素B12(1355 Da)、N-Hippuryl-His-Leu(430 Da) Sigma公司;细胞色素C(12500 Da)、抑肽酶(6512 Da) 上海生工生物工程技术服务有限公司;其余试剂 为国产分析纯。
KDN-103F型自动定氮仪 上海纤检仪器有限公司;SZF-106A型粗脂肪测定仪 上海新嘉电子有限公司;pHS-3C型精密pH计 上海雷磁仪器厂;P230p型高效液相色谱 大连依利特分析仪器有限公司;UV2100型紫外可见分光光度计 上海尤尼柯仪器有限公司;SuperdexTM Peptide 10/300GL凝胶柱(10 mm×300 mm) GE Healthcare公司。
1.2 实验方法
1.2.1 海参肠化学组成分析 将海参肠洗净后匀浆,取部分匀浆液冻干,对匀浆液(湿基)和海参肠冻干粉(干基)分别采用常规干燥法、凯氏定氮法、索氏提取法测定海参肠样品的水分、蛋白质以及脂肪含量[17],采用苯酚-硫酸法测定总糖含量[18],参照标准曲线:y=0.0126x-0.0182(R2=0.9928)进行分析;还原糖含量采用DNS法测定,参照标准曲线:y=0.001x+0.001(R2=0.9994)进行分析;绘制标准曲线的标准品均为葡萄糖。
1.2.2 酶解物制备 海参肠经匀浆处理,加去离子水使其质量浓度为4%(w/v),沸水浴10 min(变性处理组),实验中以未经沸水浴处理的样品为对照(未变性处理组)。根据课题组的前期研究[19],选用中性蛋白酶为外源酶,变性处理和未变性处理两组分别用HCl和NaOH溶液调pH至7.0后,加酶(3000 U·g-1pro.)在50 ℃水浴条件下,两组样品均恒温酶解3 h,沸水浴10 min灭酶,4000 r/min离心15 min后取上清液,-25~-50 ℃条件下真空冷冻干燥60~72 h。
1.2.3 水解度测定 参照pH-stat法[20],通过控制标准NaOH溶液的滴加量进行水解度的测定,取水解5、10、20、40、60、80、100、130、160、180 min的样品,记录对应的NaOH溶液消耗量,计算水解度,公式如下:
式中:DH-水解度,%;B-滴定过程消耗碱液量,mL;Nb-碱的当量浓度,mol/L;Mp-底物中蛋白总量,g;htot-底物蛋白质中肽键总数,mmol/g,计算时取值为7.5;α-水解过程中α-氨基的解离度。
1.2.4 酶解液中可溶蛋白、三氯乙酸(TCA)可溶性寡肽含量和肽得率的测定 将经变性预处理和未变性处理的海参肠酶解液去离子水稀释20倍后,选用考马斯亮蓝G-250法对两组海参肠酶解液的可溶性蛋白含量进行测定[18],通过相应标准曲线进行计算。采用TCA沉淀法结合Folin-酚法检测酶解液中TCA可溶性寡肽的含量[21],根据绘制的牛血清白蛋白标准曲线y=0.0035x+0.00128(R2=0.9977),参照文献[21]对肽得率进行计算,公式如下:
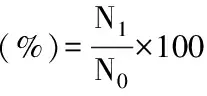
式中:N1-酶解液中TCA可溶性寡肽含量,mg;N0-酶解液总蛋白量,即酶解液中底物蛋白量,mg。
1.2.5 海参肠酶解液层析分离 采用Sephadex G-25凝胶层析柱(1.6 cm×50 cm),海参肠酶解液上样量0.5 mL,用去离子水进行洗脱,流速为0.25 mL/min,采用部分收集器每次收集40管,作为待测样品。
1.2.6 样品蛋白质含量及还原能力的测定 蛋白含量的测定采用紫外分光光度法,测定其在280 nm下的吸光度(OD280)[22]。还原能力的测定参照文献[22]进行:取层析分离收集到的样品溶液1 mL,经过一系列反应后测定OD700,空白组为去离子水。
1.2.7 变性处理组样品分子量分布的测定 将变性处理组海参肠酶解液用去离子水稀释5倍,经0.45 μm微孔膜过滤,采用Superdex Peptide 10/300GL(10 mm×300 mm)凝胶过滤色谱柱进行高效液相色谱法测定分子量分布范围。具体方法参考文献[22]进行:进样量:50 μL;检测波长:220 nm;洗脱流量:0.5 mL/min。分子量标准品分别选用Cytochrome C(12.5 kDa),Aprotinin(6.512 kDa),18肽(2.342 kDa),Vitamin B12(1.355 kDa)和N-Hippuryl-His-Leu(0.43 kDa)和gly-gly(0.132 kDa)。对凝胶过滤色谱而言,分子质量的对数(y)与保留时间(x)呈线性关系,从而得到标准曲线y=-0.0834x+5.7554(R2=0.9944),计算海参肠酶解液的分子量分布。
1.2.8 变性处理组海参肠多肽的ABTS+自由基清除率检测 以Trolox为标准品,绘制标准曲线。具体操作步骤如下:准确称量0.05006 g Trolox,加入40 mL磷酸盐缓冲溶液(0.2 mol/L,pH7.4)。将其用PBS(0.2 mol/L,pH7.4)稀释,使浓度梯度为:0、1、2、3、4、5 mmol/L,分别取10 μL与稀释好的1 mL ABTS+·溶液在30 ℃干浴器中反应6 min,在734 nm下测定吸光值,所得标准曲线为y=19.008x-3.5205。将两组样品的冻干粉用去离子水复溶,配制成浓度为5、10、20、50、100 mg/mL的样液,检测方法同上,样品浓度梯度为5、10、20、50、100 mg/mL,并将结果换算为Trolox当量。以还原型谷胱甘肽(5 mg/mL)为阳性对照。
1.2.9 变性处理组海参肠多肽的DPPH自由基清除率检测 分别取200 μL浓度为5、10、20、50、100 mg/mL的去离子水复溶后的样液与磷酸盐缓冲溶液(0.1 mol/L pH6.0)400 μL、DPPH(0.04 g/L)400 μL混匀后室温避光反应30 min,离心(2000×g,10 min),取上清液测定其在517 nm下的吸光值。以还原型谷胱甘肽(5 mg/mL)为阳性对照。
1.3 数据处理
实验重复3次,数据以平均值±标准差表示。采用SPSS 13.0软件进行显著性分析,p<0.05时具有显著性差异。
2 结果与分析
2.1 海参肠主要化学组成
经测定,海参肠原料水分含量为88.13%±0.06%,干物质中粗蛋白、粗脂肪、总糖、还原糖及灰分含量见表1。

表1 海参肠主要化学组成Table 1 Main chemical composition of Stichopus japonicas guts
由表1可见,海参肠中粗蛋白含量高于其他主要化学成分,所占比例超过干基的70%。其次为粗脂肪与总糖,灰分含量最低。刘小芳等[23]研究表明,乳山刺参体壁和内脏的粗蛋白含量分别为49.75%、34.90%,均低于70%,因此,本研究的海参肠是一种具有开发利用潜力的高价值蛋白资源。
2.2 海参肠酶解物的水解曲线
对海参肠进行变性预处理,以未变性组为对照,在酶解过程中水解度随水解时间的变化如图1所示,在整个水解过程中,两组海参肠在酶解前30 min内水解度上升较快,随后增加趋势平缓,变性组至160 min达到平稳期,随后变化无显著差异,此时其水解度达到37.28%,而未变性处理组的水解度至45 min达到23.76%,且与之后的水解度无显著性差异。由此可知,采用中性蛋白酶水解海参肠效果良好,并且底物经变性处理后,水解度是未变性组的1.57倍,原因可能是经变性处理后,海参肠蛋白的二、三、四级结构被破坏,导致中性蛋白酶与蛋白质酶切位点间相互作用,有利于酶解过程的进行[24],这与金文刚等[21]发现的虾夷扇贝生殖腺经热变性处理后,其水解度增大的结果一致。

图1 海参肠酶解液水解度曲线Fig.1 Hydrolysis degree curve of Stichopus japonicas guts hydrolysates
2.3 海参肠酶解液的可溶蛋白含量、TCA可溶性寡肽含量及肽得率
两组海参肠酶解液中可溶蛋白含量、TCA可溶性寡肽含量及肽得率结果见表2,由表2可知,可溶性蛋白含量均低于TCA可溶性寡肽,这主要是因为考马斯亮蓝G-250法检测到的可溶性蛋白为大分子量体系,海参肠经过酶解后体系中的大分子量蛋白大部分被分解为小分子的可溶性寡肽,从而导致体系中TCA可溶性寡肽含量较多;变性处理组海参肠酶解液中可溶性蛋白含量低于未变性组,这是由于变性处理组海参肠酶解程度比未变性处理组高,蛋白质水解为小分子肽,从而表现为变性处理组TCA可溶性寡肽含量和肽得率均显著高于未变性组(p<0.05)。与未变性组相比,海参肠变性处理后TCA可溶性寡肽含量和肽得率分别提高了95%和80%,表明以中性蛋白酶酶解海参肠,变性处理所得的水解液具有较高的可溶性寡肽含量及肽得率。这与金文刚等[25]发现的虾夷扇贝性腺蛋白经100 ℃加热处理10 min后,更易于酶解的结果一致。

表2 海参肠酶解液中可溶性蛋白、TCA可溶性寡肽含量及肽得率Table 2 Content of soluble protein,TCA-soluble oligopeptide and peptide yield of Stichopus japonicas guts hydrolysates

表3 变性处理组海参肠多肽的分子量分布结果Table 3 Results of molecular weight distribution of Stichopus japonicas guts peptides(denaturated)
2.4 海参肠多肽的分离及还原能力监测
利用Sephadex G-25凝胶柱进一步将海参肠变性处理和未变性处理组的酶解液进行层析分离,并监测其还原能力,结果见图2。两组海参肠酶解液经层析分离后,主要出现两个蛋白峰,都具有一定的还原能力,其中未变性处理组洗脱液在280 nm下吸光值分别在第11、20管出现峰值,而变性处理组洗脱液在第9、16管出现峰值,表明变性处理使海参肠多肽分子量的分布向较小分子量方向偏移,此外,相应峰值的升高表明经热变性后,其对应的蛋白质的回收率提高,并且样品在700 nm下的吸光值表明其同样具有一定的还原能力,其原因可能在于,高温预处理使蛋白质的螺旋结构发生松散,暴露出了更多的蛋白酶结合位点,从而更加利于蛋白质和蛋白酶结合[24],进而得到了更多的小分子肽,影响其还原能力。比较变性与未变性组凝胶分离曲线可见,海参肠变性处理组酶解液组分相对比较均一,分子量比较集中,推测其与蛋白酶的充分结合作用会使海参肠蛋白分子裂解得更为彻底,使整个体系的分子量趋于均一[24]。
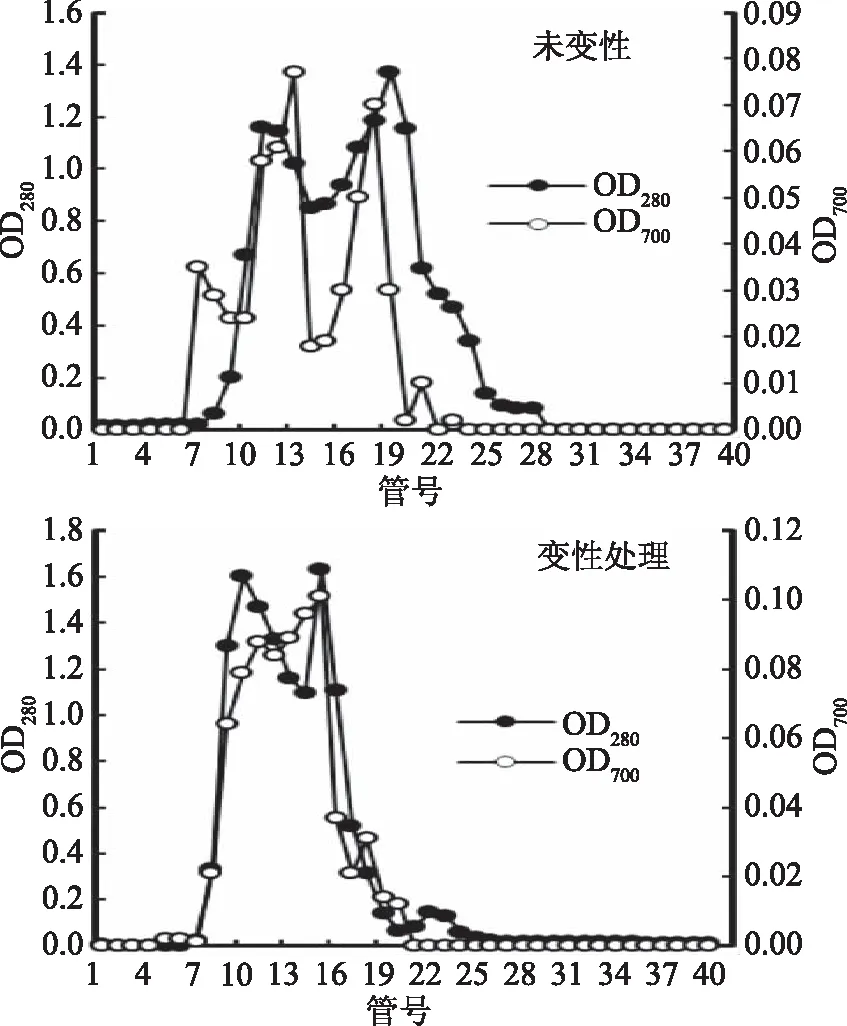
图2 海参肠酶解液经Sephadex G-25凝胶柱层析分离及还原能力Fig.2 Reducing avtivity and separation of Stichopus japonicas guts hydrolysates by Sephadex G-25 chromatography
2.5 变性处理组海参肠多肽的分子量分布
由以上实验结果可知变性处理组海参肠多肽的还原能力较高,因此对其分子量分布进行测定,结果见图3。以标准曲线作为参照,根据变性处理组海参肠多肽的保留时间以及峰面积,分析可知,该组海参肠多肽的分子量分布范围主要集中于0.5~3 kDa,占水解液的57.29%,进一步说明热变性处理能使海参肠更加充分地与酶反应,利于酶解。金文刚等[25]对虾夷扇贝雌性生殖腺进行热变性处理,酶解后分子量集中于0.25~5 kDa,与本实验研究结果相似。

图3 变性处理组海参肠多肽的分子量分布Fig.3 Molecular weight distribution of Stichopus japonicas guts peptides(denaturated)
2.6 变性处理组海参肠多肽的ABTS+自由基清除率检测
检测结果见图4,海参肠多肽的ABTS+自由基清除率呈现明显的剂量依赖性,在浓度低于20 mg/mL时,其对ABTS+自由基的清除效果均随浓度的提高显著增加(p<0.05),最高达到0.51 Trolox equi/μL Sample,与袁坤山等[26]的实验结果相近。但是在5 mg/mL浓度下其清除率为0.25 Trolox equi/μL Sample低于GSH(0.51 Trolox equi/μL Sample)。结果表明,变性处理组海参肠多肽确实具有一定的ABTS+自由基清除能力。

图4 变性处理组海参肠多肽的ABTS自由基清除率Fig.4 ABTS free radical scavenging rate of Stichopus japonicas guts peptides(denaturated)注:小写字母表示两组具有显著差异(p<0.05);图5同。
2.7 变性处理组海参肠多肽的DPPH自由基清除率检测
检测结果见图5,海参肠多肽的DPPH自由基清除率在浓度低于20 mg/mL时呈现明显的剂量依赖性,其对DPPH自由基的清除效果均随浓度的提高显著增加(p<0.05),最高达到90.95%。浓度为5 mg/mL时清除率为62.76%,与曹荣等[27]的研究结果接近,但是低于同浓度的GSH(90.34%)。结果表明,变性处理组海参肠多肽确实具有一定的DPPH自由基清除能力。

图5 变性处理组海参肠多肽的DPPH自由基清除率Fig.5 DPPH free radical scavenging rate of Stichopus japonicas guts peptides(denaturated)
3 结论
利用中性蛋白酶对海参肠进行酶解,可获得低分子量多肽,酶解效果比较好;海参肠经变性预处理后,水解度和肽得率均有显著提高(p<0.05),所得产物分子量集中于0.5~3 kDa,还原能力、ABTS+与DPPH自由基清除率检测结果证明其具有一定的抗氧化能力。上述结果为今后对变性处理后的海参肠水解液中的活性多肽进行分离、纯化以及序列鉴定打下了基础。

