不同浓度EGCG对NaCl胁迫下黄瓜种子萌发及其抗性的影响
李 洋,刘 凯,魏吉鹏,张 兰,李 鑫,*,韩文炎,*,李青云,*
(1.河北农业大学 园艺学院,河北 保定 071000;2.中国农业科学院 茶叶研究所,浙江 杭州310008)
黄瓜(CucumissativusL.)是设施栽培的重要蔬菜之一,在我国各地广泛种植且栽培面积不断扩大。设施内部封闭的种植环境及独特的栽培管理方式,使得设施土壤内盐分逐年积累,土壤次生盐渍化现象越来越严重[1-2],严重影响设施作物的生长发育及产量品质[3]。
类黄酮是植物次生代谢产物,在植物种子萌发、根毛形成、花粉发育等生长发育过程中扮演着重要的角色[4]。近年来研究发现,类黄酮作为一种重要的抗氧化剂,在生物和非生物胁迫下可以清除活性氧,增强植物的抗虫、抗寒及抗病性[5]。儿茶素是茶叶中黄酮类化合物的主体成分,占茶叶干质量的12%~24%。儿茶素主要分为表儿茶素(epicatechin,EC)、表没食子儿茶素(epigallocatechin,EGC)、表儿茶素没食子酸酯(epicatechin gallate,ECG)及表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)4种主要类型[6]。其中以EGCG的含量最为丰富,占儿茶素总量的50%~75%[7]。研究表明,EGCG具有抗菌、抗氧化等生物活性,是儿茶素中抗氧化作用最强的一种成分。
目前有研究报道,不同浓度EGCG能够促进或抑制植物种子萌发,并且对植株生长的影响存在明显的浓度效应[8-9]。为了明确EGCG对NaCl胁迫下黄瓜种子萌发及幼苗生长的影响,本实验以黄瓜为材料,研究了不同浓度EGCG对NaCl胁迫下黄瓜种子萌发、MDA含量及胚根抗氧化酶活性的影响,探讨外源EGCG与黄瓜耐盐性之间的关系,为研究EGCG缓解植物盐胁迫伤害提供理论依据。
1 材料与方法
1.1 材料与处理
供试黄瓜品种为津研四号,实验于2016年5—8月在中国农业科学院茶叶研究所连栋玻璃温室内进行。
实验共设8个处理,各处理具体溶液如下:处理Ⅰ(对照),ddH2O;处理Ⅱ,10 μmol·L-1EGCG;处理Ⅲ,100 μmol·L-1EGCG;处理Ⅳ,1 000 μmol·L-1EGCG;处理Ⅴ,200 mmol·L-1NaCl;处理Ⅵ,10 μmol·L-1EGCG+200 mmol·L-1NaCl;处理Ⅶ,100 μmol·L-1EGCG+200 mmol·L-1NaCl;处理Ⅷ,1 000 μmol·L-1EGCG+200 mmol·L-1NaCl。
采用培养皿滤纸法进行种子萌发试验。选取健康饱满、形态一致的黄瓜种子,于55 ℃温水中浸泡20 min。将2层无菌滤纸置于直径9 cm的培养皿中,向培养皿中添加10 mL处理溶液,将种子均匀地摆放在滤纸上。每个处理100粒种子,3次重复。将培养皿置于恒温培养箱(25±1) ℃进行催芽,光强为100 μmol·m-2·s-1,相对湿度控制在75%~85%,光周期12 h/12 h(光/暗)。发芽期间每天对培养皿内的溶液进行更换,直至该试验结束。
1.2 测定项目与方法
1.2.1 种子萌发相关指标的测定
以胚根突破种皮作为种子萌发的指标,以后每天记录发芽数,以发芽数量不再改变作为发芽结束的标志。按照文献[10]中的公式计算种子的发芽率(GR)、发芽势(GE)、发芽指数(GI),种子发芽结束后5 d进行主根长及侧根数量的测量统计。
1.2.2 丙二醛含量和抗氧化酶活性测定
主根长及侧根数量的测量统计结束后,取根系鲜样进行MDA(丙二醛)含量及抗氧化酶活性的测定。
粗酶液的提取参考Wang等[11]的方法,并加以改进。取0.3 g黄瓜胚根样品,在冰浴中用研钵进行研磨,研磨过程中分3次加入3 mL 50 mmol·L-1磷酸缓冲液,含0.2 mmol·L-1EDTA和2%(m/V)PVP;12 000g低温离心20 min,该上清液即为酶液,用于各种抗氧化酶活性及MDA含量的测定。
MDA含量的测定采用硫代巴比妥酸法[12],叶片提取物加入10%三氯乙酸(TCA)和0.65%硫代巴比妥酸(TBA)在95 ℃加热25 min,测定D532和D600,两者差值用于计算MDA含量。
抗坏血酸过氧化物酶(APX)活性的测定采用Nakano等[13]的方法,并有所改进。取100 mL酶液,加入1 700 mL 25 mmol·L-1PBS(pH 7.0,含0.1 mmol·L-1EDTA)、100 mL 5 mmol·L-1AsA 和100 mL 20 mmol·L-1H2O2,振荡混匀,用紫外分光光度仪立即测定D290的动力学变化,测定时长为 40 s。
过氧化氢酶(CAT)活力测定参照Patra等[14]的方法,并有所改进。取100 mL 酶液,加入1 700 mL 25 mmol·L-1PBS(pH 7.0,含0.1 mmol·L-1EDTA)和200 mL 100 mmol·L-1H2O2,振荡混匀,在25 ℃下反应,用紫外分光光度仪立即测定D470的动力学变化,测定时长为40 s。
超氧化物歧化酶(SOD)活力测定采用Steward等[15]的方法,并有所改进。取50 mL酶液,加入3 mL NBT 反应液(含50 mmol·L-1PBS,pH 7.8,0.1 mmol·L-1EDTA,13 mmol·L-1甲硫氨酸,63 μmol·L-1NBT,1.3 μmol·L-1核黄素)。在25 ℃、光强100 mmol·m-2·s-1下照光,直至颜色发生变化,然后将反应液置于黑暗环境中终止反应,测定D560的吸光值。
愈创木酚过氧化物酶(G-POD)活力测定参照Cakmak等[16]的方法,并有所改进。取100 mL酶液,加入1 700 mL 25 mmol·L-1PBS(pH 7.0,含0.1 mmol·L-1EDTA)、100 mL 1%愈创木酚和100 mL 20 mmol·L-1H2O2,振荡混匀,用紫外分光光度仪立即测定D470的动力学变化,测定时长为40 s。
可溶性蛋白含量测定根据Bradford[17]使用牛血清蛋白作为标准,采用考马斯亮蓝G250法进行测定。
1.3 数据统计与分析
试验数据采用Excel及stst方差分析软件进行统计分析,采用OriginPro 8作图,以P<0.05表示差异显著。
2 结果与分析
2.1 不同浓度EGCG对NaCl胁迫下黄瓜种子萌发的影响
由图1可以看出,在非盐胁迫条件下,10、100、1 000 μmol·L-1EGCG对黄瓜种子的发芽率没有显著影响,但对黄瓜种子发芽势具有显著促进作用,分别提高了2.5百分点、10.0百分点与5.0百分点;10、100 μmol·L-1EGCG处理后,黄瓜种子发芽指数分别提高了1.2、1.8,但是1 000 μmol·L-1EGCG处理显著降低了种子的发芽指数。200 mmol·L-1NaCl溶液处理黄瓜种子后,与对照相比,其发芽率、发芽势及发芽指数显著下降了5百分点、70百分点和9.2。添加不同浓度EGCG后发现,10、100及1 000 μmol·L-1EGCG处理的种子发芽率、发芽势、发芽指数显著高于对照,发芽率分别提高了2.5百分点、3.0百分点、3.0百分点,发芽势分别提高了10.0百分点、22.5百分点、12.5百分点,发芽指数分别提高了2.0、2.7、1.8,其中,100 μmol·L-1EGCG对NaCl胁迫条件下黄瓜种子的发芽率、发芽势及发芽指数的提高效果最佳。综合以上结果说明,100 μmol·L-1EGCG能够有效缓解盐胁迫对种子萌发产生的抑制作用。
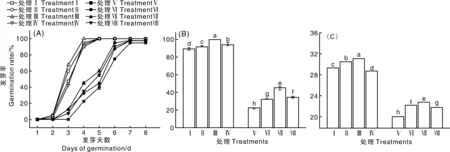
没有相同小写字母表示不同浓度处理下差异显著(P<0.05)。下同。Different lowercase letters mean significant differences at 0.05 level. The same as below.图1 不同浓度EGCG对NaCl胁迫下黄瓜种子萌发的影响Fig.1 Effects of different concentrations of EGCG on seed germination of cucumber under NaCl stress
2.2 不同浓度EGCG对NaCl胁迫下黄瓜种子主根长、侧根数量的影响
由图2可以看出,在正常条件下,10 μmol·L-1EGCG能够显著促进黄瓜主根的伸长及侧根数量的发生。但是200 mmol·L-1NaCl能够显著抑制黄瓜种子根系发育,其主根伸长及侧根均仅为非盐胁迫条件下的2/3左右。在盐胁迫条件下的黄瓜种子经不同浓度EGCG处理之后,其主根长与未经EGCG处理相比均有不同程度的增长,分别增长了6.4%、15.3%和12.1%;但是,通过对侧根数量的分析发现,仅100 μmol·L-1EGCG处理能提高侧根数量。综合以上结果表明,100 μmol·L-1EGCG能够有效缓解NaCl胁迫对种子胚根生长的抑制作用。
2.3 不同浓度EGCG对NaCl胁迫下黄瓜胚根中MDA含量的影响
由图3可以看出,与处理Ⅰ(对照)相比,200 mmol·L-1NaCl胁迫条件下黄瓜胚根中MDA含量均显著上升,说明盐胁迫使黄瓜种子胚根发生严重的膜质过氧化,从而抑制了种子萌发。但是与未经EGCG处理的黄瓜种子相比,经10、100及1 000 μmol·L-1EGCG处理的黄瓜种子胚根中MDA含量均有所下降,分别仅为原来的85.3%、68.5% 和80.2%,可以看出100 μmol·L-1EGCG处理胚根中MDA含量最少。因此,我们可以得出结论,100 μmol·L-1EGCG处理能有效缓解盐胁迫下黄瓜胚根的膜脂过氧化现象,从而缓解盐胁迫对黄瓜种子萌发产生的抑制作用。
2.4 不同浓度EGCG对NaCl胁迫下黄瓜胚根抗氧化酶活性的影响
2.4.1 对APX活性的影响
在非盐胁迫条件下,10与1 000 μmol·L-1EGCG 处理后黄瓜种子胚根中的APX活性与处理Ⅰ(对照)相比无明显差异,而100 μmol·L-1EGCG 处理后黄瓜胚根中的APX活性比处理Ⅰ(对照)明显降低。在200 mmol·L-1NaCl胁迫条件下,不同浓度 EGCG 处理的APX活性均比非盐胁迫条件下的显著增强。与未经EGCG处理的相比,不同浓度 EGCG 处理后黄瓜胚根APX活性均不同程度地增强,其中以100和1 000 μmol·L-1EGCG处理的增强效果最为明显,分别升高了27.5% 和38.3%(图4-A)。
2.4.2 对CAT活性的影响
图4-B所示,在非盐胁迫条件下,10和1 000 μmol·L-1EGCG 处理后黄瓜种子胚根中的CAT活性与处理Ⅰ(对照)相比无明显差异,而100 μmol·L-1EGCG 处理后根系中APX活性则明显降低。在200 mmol·L-1NaCl胁迫条件下,不同浓度EGCG处理后CAT活性均比非盐胁迫条件下的显著增强。与未经EGCG处理的相比,不同浓度EGCG处理后胚根CAT活性均不同程度地增强,其中以10、100 μmol·L-1EGCG处理后增强效果最为明显,分别升高了21.5%和16.0%。
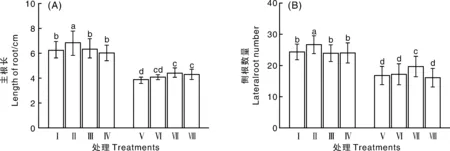
图2 不同浓度EGCG对NaCl胁迫下黄瓜种子主根长、侧根数量的影响Fig.2 Effects of different concentration of EGCG on radicle length and root branch number of cucumber seeds under NaCl stress
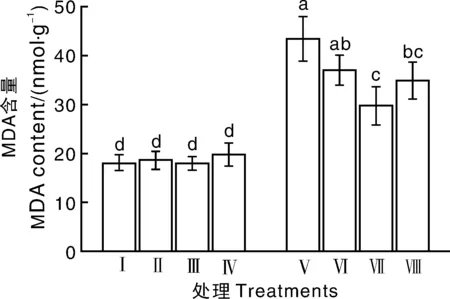
图3 不同浓度EGCG对NaCl胁迫下黄瓜胚根MDA含量的影响Fig.3 Effect of different concentrations of EGCG on MDA content in cucumber radicle under NaCl stress
2.4.3 对SOD活性的影响
图4-C结果表明,在非盐胁迫条件下,不同浓度EGCG处理后黄瓜种子胚根中的SOD活性与处理Ⅰ(对照)相比均不同程度地增强,以100、1 000 μmol·L-1EGCG处理后增强效果最明显。在200 mmol·L-1NaCl胁迫条件下,不同浓度EGCG处理后SOD活性与非盐胁迫条件下的相比均表现出不同程度的增强。与未经EGCG处理的相比,不同浓度EGCG处理后黄瓜根系中SOD活性均不同程度地增强,其中100 μmol·L-1EGCG处理后胚根SOD活性增强效果最明显,提高了36.3%。
2.4.4 对POD活性的影响
图4-D结果显示,在非盐胁迫条件下,不同浓度EGCG处理的黄瓜种子胚根中的POD活性与处理Ⅰ(对照)相比均不同程度地增强,以100和1 000 μmol·L-1EGCG处理后的增强最明显。200 mmol·L-1NaCl胁迫条件下,不同浓度EGCG处理后的POD活性与非盐胁迫条件下无显著差异。与未经EGCG处理的相比,不同浓度EGCG处理后的POD活性均不同程度地增强,其中100 μmol·L-1EGCG处理的胚根POD活性增强最明显,升高了25.1%。
3 讨论
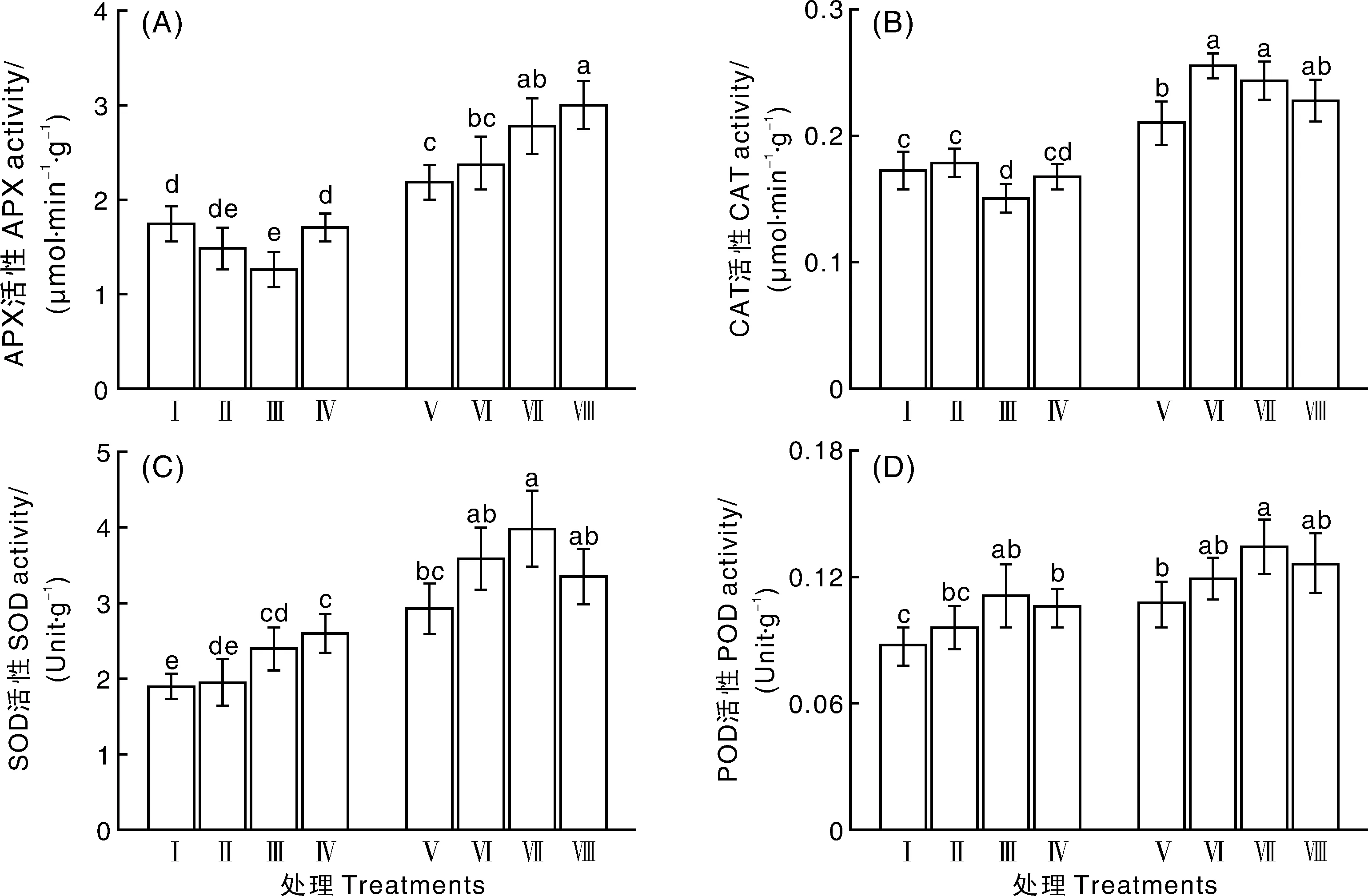
图4 不同浓度EGCG对NaCl胁迫下黄瓜种子胚根抗氧化酶活性的影响Fig.4 Effect of different concentrations of EGCG on the activities of antioxidant enzymes in cucumber radicle under NaCl stress
种子萌发是一个复杂的生理过程,同时也是植物发育的重要阶段。黄瓜耐盐碱能力较差,一般喜欢中性偏酸的土壤,以pH 6.0~6.8最好。侯梁宇等[18]研究表明,不同浓度的NaCl胁迫对黄瓜种子的萌发具有不同的效果。在本研究中,我们首先进行预试验筛选出合适的NaCl浓度为200 mmol·L-1,用于后续试验。
大量研究表明,某些化感物质能够刺激种子萌发或者抑制种子萌发。Kanmaz等[19]研究表明,在亚麻籽萌发后和萌发期间黄酮类化合物含量都增加,并且随萌发率的增加而增加。侯建霞[20]对苦荞麦萌发过程中活性成分进行测定后发现,荞麦黄酮的含量随着种子萌发过程的推进而不断增加。郭亚姣等[21]通过研究黄顶菊叶片中的黄酮类化合物对白菜种子萌发的影响发现,随着黄酮类化合物浓度的不断增加,白菜种子的发芽率、发芽指数和活力指数均呈逐渐下降趋势。以上研究均表明,黄酮类化合物对种子萌发能产生一定的影响。
前人研究认为,NaCl可能通过影响水势、改变代谢过程、破坏细胞膜、降低细胞的扩增和分裂等途径影响种子萌发[22]。另外,NaCl处理能够引起细胞的氧化应激现象,这种现象也与种子的萌发有密切的联系[23]。本实验结果表明,200 mmol·L-1NaCl胁迫下黄瓜种子的发芽率显著降低。在200 mmol·L-1NaCl胁迫条件下的黄瓜种子再经不同浓度的EGCG处理之后,其萌发受到了不同程度的促进,说明不同浓度的EGCG均能提高种子的耐盐能力。其中以100 mmol·L-1EGCG处理促进作用最明显,表现为萌发速度更快、发芽率更高、萌发更整齐。同时,在盐胁迫条件下,经不同浓度EGCG处理的黄瓜种子主根长及侧根数目均有不同程度的增长,以100 μmol·L-1EGCG的促进效果最为显著。有研究猜测,儿茶素调控拟南芥的生长发育可能是通过改变植株的根冠形态、叶片的气孔交换、IAA含量和分布来实现的[24]。然而,关于儿茶素能够促进植株根系生长的机理尚不明确,这种促进作用可能涉及分生组织细胞的化学反应,比如由扩张蛋白、纤维素内切酶或者木葡聚糖内切酶的反应以及由ROS诱导的非酶促过程[9]。
MDA含量表征着细胞膜系统结构和功能的受害程度[25],一定程度上反映细胞膜脂过氧化程度。植物体在遭遇胁迫时,活性氧积累能够启动膜脂的过氧化作用,引起膜脂过氧化产物MDA的增加[26]。在盐胁迫条件下,与未经EGCG处理相比,不同浓度EGCG处理后根系中MDA含量均表现出不同程度的下降(图3),其中,以100 μmol·L-1EGCG处理的MDA含量最低,说明100 μmol·L-1EGCG处理后黄瓜根系膜系统受损程度最低。
逆境胁迫往往会导致植物细胞内活性氧的动态平衡破坏,而超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)、过氧化物酶(POD)等能够有效清除植物细胞内的自由基,是反映植物抗逆性的重要生理指标[27-28]。大量研究表明,在植株遭受环境胁迫时,外源黄酮类物质能够缓解植株的受损伤程度,从而维持植株生命活动的正常运行[29-30]。在盐胁迫条件下,与未经EGCG处理相比,不同浓度EGCG处理后APX、CAT、SOD、POD活性均表现出不同程度的增强(图4),说明EGCG能提高NaCl胁迫下种子的抗氧化能力。其中APX活性呈逐渐上升趋势,CAT、SOD、POD活性呈先上升后下降的趋势。但是各种酶活性的变化趋势具有一定差异,可能与植物种类、胁迫时间及胁迫程度以及外源物质作用时间长短不同有关[31]。
综上所述,在200 mmol·L-1NaCl胁迫下,外源添加不同浓度EGCG能够促进黄瓜种子的萌发,其中100 μmol·L-1EGCG对NaCl胁迫的缓解作用最明显,这可能是由于该浓度下EGCG处理能够提高NaCl胁迫下黄瓜体内的抗氧化酶活性,从而促进植株对活性氧的清除,以此来维持细胞膜结构和功能的稳定性,从而保护植株不受伤害,这也与Yiu等[32]在番茄涝害上的研究是一致的。因此,可以将合适浓度的EGCG用于种子萌发,以缓解环境胁迫对种子萌发造成的抑制。但是EGCG的作用效果可能会由于种子品种、EGCG处理的浓度的不同和时间长短而出现差异[24,33]。因此关于EGCG对胁迫条件下种子萌发的影响还需做进一步的研究。

