ZPR1基因rs603446位点多态性与河南汉族人群血脂异常遗传易感性的关系
张洪磊,李玉倩,张 霞,刘晓田,屠润琪,刘瑞华,杨凯丽,毛振兴,张功员,王重建
1)郑州大学公共卫生学院流行病学教研室 郑州 450001 2)郑州大学药学院临床药理学系 郑州 450001
随着经济水平的提高以及生活方式的改变(如高脂饮食及较低的体力活动),心血管疾病已成为全球范围内死亡率上升的主要原因之一。有研究[1]显示,心血管疾病死亡的比例占全死因死亡的21.3%。近期的流行病学资料[2]显示,中国人群中有31.5%的人患有高胆固醇血症,22.3%的人高密度脂蛋白胆固醇(HDL-C)降低。血脂异常既是独立的慢性病,也是肥胖、糖尿病、高血压及心血管疾病的一个重要的危险因素[3-6]。大量研究[7-8]表明,血脂异常是一种多因素导致的代谢异常性疾病,涉及遗传及环境因素共同作用的结果。锌脂蛋白(ZPR1, Gene ID:8882; OMIM: 603901; 长度: 10.33 kb)位于11号染色体,也称ZNF259,是维持细胞增殖以及信号传导的基本调节蛋白[9]。目前,越来越多的研究[10-11]证实ZPR1在脂质代谢过程中发挥重要作用。国外已有关于ZPR1基因多态性和血脂异常易感性关系的研究[12-13],但在河南汉族人群尚未见有关研究。本研究选取河南汉族人群为研究对象,分析ZPR1基因rs603446多态性位点与血脂异常的易感性,并进一步分析位点多态性和环境因素的交互作用与血脂异常的关联。
1 对象与方法
1.1研究对象从河南农村队列研究的基线调查人群中,抽取916例血脂异常患者(血脂异常组),其中男性276人。采用11匹配的方法,根据年龄、性别进行匹配,要求对照组的年龄在±2岁范围内与病例组进行匹配,最终,在病例的源人群选出916例血脂正常者作为对照组。血脂异常的诊断标准采用2016年修订的《中国成人血脂异常防治指南》[14],具有以下3种情况之一时被诊断为血脂异常:①总胆固醇(TC)≥6.22 mmol/L 。②HDL-C<1.04 mmol/L。③甘油三酯(TG)≥2.26 mmol/L 。所有入选对象对本研究知情并同意,均签署知情同意书。
1.2调查方法与内容采用面对面的方式进行现场调查,调查内容主要包含以下几点。①问卷调查:人口统计学特征(姓名、性别、年龄、种族及教育水平等),行为危险因素(吸烟、饮酒等),个人疾病史家族史,膳食情况等。②体格检查:身高,体重,腰围,血压等。③生化指标:研究对象空腹8 h以后,抽取静脉血10 mL用于DNA的提取和相关指标检测。检测指标包括空腹血糖(GLU)、TC、低密度脂蛋白胆固醇(LDL-C)、HDL-C、TG。
1.3DNA提取采用北京百泰克生物技术有限公司提供的全血基因组DNA提取试剂盒提取样本中DNA,采用琼脂糖凝胶电泳对所提取DNA的纯度进行鉴定,核酸测定仪测量其纯度和浓度。
1.4基因分型采用2×48位SNPscanTM高通量SNP分型技术(上海天昊生物技术有限公司)进行基因分型。反应体系:将100~200 ng DNA样本转移至10 μL含有1 ×DNA 裂解缓冲液中,98 ℃ 5 min变性裂解,然后与10 μL含有2 μL 10×连接酶缓冲液、1 μL混合探针、0.5 μL连接酶、以及7.5 μL Mili-Q水的连接预混合液混合均匀。采用ABI热循环仪进行连接反应,其连接产物均采用2×48位荧光PCR反应扩增。PCR反应体系为20 μL(包括1×PCR预混液,1 μL连接产物和1 μL PCR引物)。采用毛细管电泳法在ABI3730XL测序仪上进行PCR产物分离和检测。采用盲法进行基因分型,并对整个过程进行严格的质量控制。
1.5统计学处理采用SAS 9.1进行分析。应用配对t检验和χ2检验比较两组人群基本特征,采用条件logistic回归分析计算未调整OR、调整后的OR及95%可信区间(95%CI);Hardy-Weinberg平衡的分析采用Haploview 4.2,基因与环境因素的交互作用采用多因子降维法分析(MDR);检验水准α=0.05。
2 结果
2.1基本特征血脂异常组和对照组的基本特征见表1。由表1可知,血脂异常组的体重指数(BMI)、TC、TG、GLU均高于对照组,而HDL-C低于对照组。
2.2ZPR1基因rs603446位点与血脂异常易感性的关系共检测到ZPR1基因rs603446位点CC、CT、和TT 3种基因型。对照组基因型的分布频率符合Hardy-Weinberg平衡(χ2=0.001,P=0.969)。血脂异常组和对照组3种基因型的分布频率见表2,且差异有统计学意义(χ2=6.158,P=0.046)。对照组T等位基因的频率为25.55%,高于病例组的22.05%,差异有统计学意义(χ2=6.164,P=0.013)。条件logistic回归分析得出,rs603446位点T等位基因可对血脂异常的发生起保护作用。进一步调整协变量后,rs603446位点多态性仍与血脂异常具有关联性。

表1 血脂异常组和对照组人群的基本特征
2.3ZPR1基因rs603446位点基因型与环境间的交互作用结果表明,rs603446位点基因型、吸烟和体力活动所组成的模型为最佳模型,其交叉验证一致性和检验正确率均为最高,且差异具有统计学意义(P<0.001)。进一步采用logistic回归分析环境因素与rs603446位点基因型的联合交互作用,结果显示,体力活动为中、重度且携带CT/TT基因型者,血脂异常的发生率为轻度体力活动且基因型为CC的0.497倍。rs603446位点与体力活动之间的交互作用为相乘模型(OR=0.873,95%CI=0.819~0.930)。相加交互作用分析得出rs603446位点基因型与吸烟存在相加交互作用,其交互作用指数为0.516(0.370~0.663)。见表3和表4。
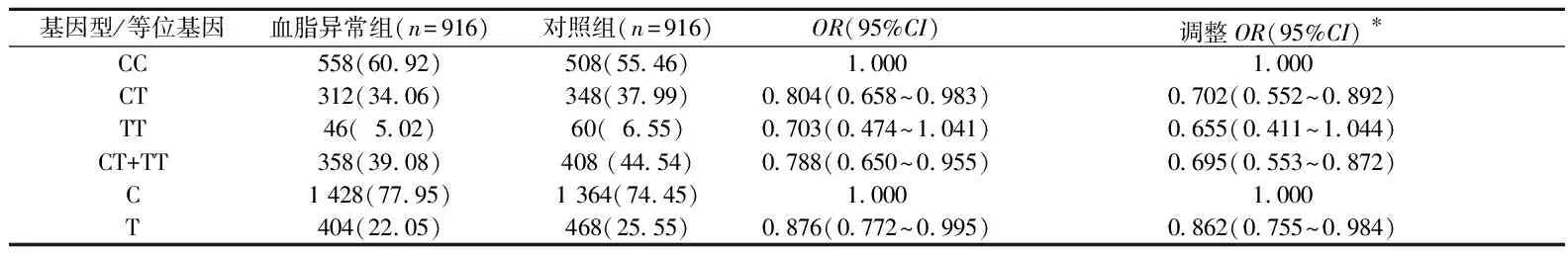
表2 血脂异常组和对照组ZPR1基因rs603446位点不同基因型的分布频率比较 例(%)
*:调整的协变量包括吸烟、饮酒、蔬菜水果摄入、高脂饮食、体力活动、BMI

表3 rs603446位点多态性与吸烟、体力活动的联合作用和相乘交互作用
*:调整的协变量包括饮酒、蔬菜水果摄入、高脂饮食、BMI
3 讨论
ZPR1位于11号染色体的APOA4-APOA5-ZNF259-BUD13基因簇上,研究[15]证实,在这个区域的基因变异与血脂的变化有密切关系。ZPR1的启动子区域被过氧化物酶体增殖物活化受体γ(PPARγ)1和2,以及肝细胞核因子4α包绕,其中PPARγ在肥胖和胰岛素抵抗中发挥重要作用,而肝细胞核因子4α可激活与血糖,脂肪酸,胆固醇代谢有关的基因[16]。
血脂异常是一种复杂的代谢性疾病,其发病与环境、饮食行为特征以及遗传易感性等多方面因素有关。近期的全基因组关联研究确定出一系列与血脂异常有关的基因,其中就包括ZPR1[10]。本研究结果显示,血脂异常组和对照组人群中ZPR1基因rs603446位点3种基因型(CC、CT和TT)的分布差异有统计学意义;调整了吸烟、饮酒、蔬菜水果摄入、高脂饮食、体力活动、BMI后,rs603446位点与血脂异常仍存在关联,基因型 CT以及含有T等位基因的基因型(CT+TT)与发生血脂异常的危险度降低有关。该研究与Aung等[10]对仫佬族人群的研究结果一致。同时,一项来自伊朗的研究[12]表明,ZPR1基因多态性与血清中TG和LDL-C的水平相关。此外,与血脂异常有关的各个因素之间可能存在交互作用。吸烟作为一种致癌物与多种疾病的发生有着密切的关系。一项来自韩国的研究[17]表明,吸烟可增加血脂异常的患病风险,并且这种现象在女性中更为突出。本研究发现吸烟与rs603446位点存在负相加的交互作用,但其内在的机制有待进一步的研究。本次研究还发现体力活动与rs603446位点基因型之间存在相乘模型的交互作用。

表4 rs603446位点与吸烟和体力活动之间的相加交互模型

