侧脑室注射EGb 761对MCAO大鼠神经细胞凋亡的影响※
孙灵芝 孟苗苗 刘 芹 曹晓岚
(1 山东中医药大学附属医院脑病科,山东 济南 250011;2 山东中医药大学中医学院,山东 济南 250014;3 山东中医药大学第一临床医学院,山东 济南 250014)
目前,缺血性脑卒中具有较高的发病率和致残率,却缺乏有效的治疗措施。溶栓治疗是循证医学证实有效的疗法,因时间窗的限制而难以使大部分患者获益。
近年来,人们认识到缺血-再灌注损伤是缺血性脑卒中的重要损伤机制,而细胞凋亡又是缺血-再灌注损伤的重要发病环节。脑梗死时,梗死中心区域的神经元因严重缺血而导致早期坏死,而周围半暗带的神经元则发生迟发性凋亡。c-fos基因属于即早基因家族,能在受到外界刺激后10~30 min内,转录形成mRNA。脑内正常水平的c-fos基因表达有一定保护作用,过度表达的Fos蛋白则会转入细胞核内与c-jun基因的表达产物Jun蛋白结合生成异源二聚体,作用于转录环节,可引起细胞凋亡[1-2]。
我们采用侧脑室注射技术,观察EGb 761对大脑中动脉缺血-再灌注大鼠皮层区梗死灶周围凋亡细胞、fos、c-jun基因表达,探讨其作用机制,及侧脑室注射技术的可行性。
1 材料与方法
1.1 动物 清洁级健康雌性SD大鼠,体质量(250±20)g。购自上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2007-0005,SPF级环境适应性饲养7 d。
1.2 药品和试剂 EGB 761(7320400,German Weimar Dr.Shu Pei pharmaceutical factory, Inc);10%水合氯醛,鲁药准字再H01080291,产品批号:20110601;0.9%氯化钠注射液,250 mL,山东金洋药业有限公司,国药准字H37021678,产品批号12.95412;兔抗c-fos、c-jun抗体(北京中杉生物有限公司);DAB显色液(京博奥森生物工程有限公司);TUNEL试剂盒 (Roche,Germany),Mouse polyclonal to Brdu (Santa Cruz biotechnology, Inc),工作浓度:1∶100;Mouse polyclonal to NCAM (Merck Millipore),工作浓度:1∶100;Goat anti Mouse IgG-FITC (Santa Cruz biotechnology,inc),工作浓度为1∶100。正常羊血清封闭液 (福州迈新生物技术开发有限公司)。柠檬酸抗原修复液 (PH6.0)(福州迈新生物技术有限公司)。PBS柠檬酸缓冲液(PH7.4) (福州迈新生物技术有限公司)。防脱片剂:0.1%多聚赖氨酸 (北京中杉金桥生物技术有限公司)。光学显微镜(德国leicaDM4000B);leica Qwin V3图像分析软件(德国)。
1.3 分组、模型制备及神经功能评分 将大鼠随机分为注模型组、治疗组及假手术组,每组10只。5只用于TUNEL检测,5只用于C-FOS、C-JUN检测。用插线法制备大脑中动脉阻断的缺血再灌注模型[3]。大鼠10%水合醛麻醉后,沿颈正中切开,仔细分离右侧颈内外动脉 (ICA,ECA),将ECA结扎并剪断,拉直与ICA成一直线,将一根长4.0 cm,直径0.26 cm的圆头硅化尼龙线由ECA插入ICA1.85~2.00 cm,进颅至大脑中动脉起始处,而假手术组仅插入9 mm。缺血2 h后小心抽出尼龙线,结扎ECA开口处,缝合切口后放回笼中。再灌注2 h后处死动物。选取评分为1~2分的大鼠为模型鼠,进行后续的检测。待大鼠术毕清醒后,参照Zea Longa分制法[4]进行神经功能缺损评分:0分:无神经功能缺损症状;1分:提尾倒挂时左前肢紧贴胸壁不能伸展;2分:行走时向左侧转圈;3分:行走或站立时向左侧倾倒;4分:意识障碍,不能行走。选取1~3分者进行后面的连续检测。
1.4 给药方法 脑缺血后即时给予侧脑室注射EGb 761或等量生理盐水。用10%的水合氯醛 (0.3 mL/100 g)腹腔麻醉大鼠,将大鼠俯卧位固定于脑立体定位仪上,矢状突切开头皮至颅骨,参照Paxinos-Watson图谱,以前囟为基点,后移3.5 mm,右移3.5 mm钻开颅骨,以颅骨表面为准垂直进针3.8 mm,用微量注射器将0.525 mg/kg EGb 761(0.1 mL/h)注入侧脑室,注射结束后留针10 min,再撤出微量注射器,骨蜡封闭小孔,常规局部消毒、缝合切口,麻醉管理,待苏醒[5]。
1.5 取材及组织切片样本制备 腹腔注射10%水合氯醛(0.06 mL/kg)麻醉大鼠,暴露心脏,穿刺左心室,插管入升主动脉,剪开右心耳,以250 mL生理盐水快速灌注至肝脏变白,以含4%多聚甲醛的PBS(0.1 mol/L,pH7.4)灌注固定,0.5 h后取出全脑,置入4%多聚甲醛0.1 mol/L的PBS(pH7.4,4℃) 后固定;8 h后放置于含20%蔗糖的磷酸缓冲液中,待脑组织下沉,进行冰冻切片;根据大鼠脑组织立体定位解剖图谱,将脑组织切成厚30 μm的切片,用于c-fos、c-jun、TUNEL。
1.6 细胞凋亡检测 采用原位末端标记法 (TUNEL)检测细胞凋亡,操作方法严格按照试剂盒说明书进行,细胞核染色呈紫褐色者视为TUNEL染色阳性神经元。选取脑额顶部皮层部位,200倍光镜下计数5个视野阳性细胞数目,求其平均值。
c-fos、c-jun检测:将脑片置于37℃正常羊血清工作液封闭,中孵育1 h,滴加一抗4℃冰箱孵育过夜;转至室温平衡30 min,PBS冲洗3×10 min;滴加荧光二抗,37 ℃避光孵育60 min,PBS冲洗4×10 min;DAB显色,复染;梯度酒精脱水;二甲苯透明2次,中性树胶封片[6]。光镜下,阳性细胞细胞核染色体呈现棕黄色,多为圆形或者卵圆形。各组大鼠每张脑片随机选取5个视野,分别对c-fos、c-jun阳性细胞进行计数并利用leica Qwin V3图像分析软件分析其平均灰度。
1.7 统计学方法 用SPSS 22.0进行统计学处理,采用单因素方差分析,结果用(±s)表示。
2 结果
2.1 神经行为学观察 术后2 h左右大鼠清醒时进行评分,分值越高,动物行为障碍越严重。有以下症状:画圈运动,站立不稳,左侧倾倒,不能完全伸展左侧前爪,经统计分析,除假手术组外无明显缺血行为表现外,其余各组均表现为神经行为学异常。
2.2 对缺血-再灌注大鼠皮层区梗死灶周围TUNEL阳性细胞计数的影响 各组不同时间点均有TUNEL阳性表达细胞。凋亡细胞胞核呈紫褐色着色,胞核固缩,颗粒深染,呈椭圆形、圆形及不规则形。假手术组第7天,第14天均有少量阳性细胞。与假手术组相比,模型组第7天,14天大鼠区TUNEL阳性细胞数均明显增多 (P<0.05),第7天更为显著,提示MCAO可引起梗死灶周围神经细胞凋亡;在各时间点,与模型组比较,治疗组阳性细胞数明显减少,差异有统计学意义 (P<0.05),提示治疗组大鼠海马区神经元调亡减少 (图1)。第14天,模型组及治疗组凋亡细胞数均有下降。
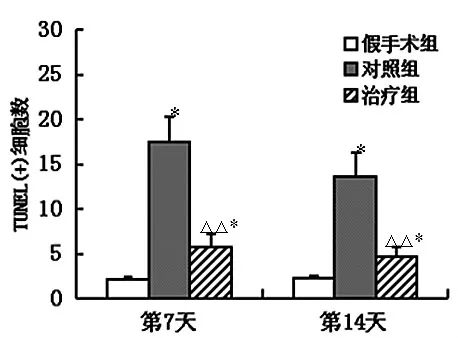
图1 缺血再灌注大鼠脑组织皮层梗死周边区TUNEL阳性细胞表达(×200)
假手术组、模型组和治疗组TUNEL阳性细胞:图1是对TUNEL阳性细胞的定量分析。模型组TUNEL阳性细胞较假手术组明显增多(P<0.01),治疗组TUNEL阳性细胞较模型对照组明显减少(P<0.05)。
2.3 对缺血-再灌注大鼠皮层区梗死灶周围c-fos和cjun阳性细胞数的影响 镜下c-fos、c-jun基因蛋白染色呈棕褐 (黄)色。假手术组仅见少量阳性细胞,模型组大鼠脑神经元、神经胶质内c-fos和c-jun阳性细胞数较假手术组明显增多(P<0.01),治疗组c-fos和 c-jun阳性细胞数较模型组显著减少(P<0.05),提示缺血-再灌注大鼠模型可显著提高c-fos和c-jun阳性细胞数,EGb 761对c-fos和c-jun阳性细胞数有抑制作用。
假手术组、模型组和治疗组c-fos、c-jun阳性神经细胞:图2A、2B是对c-fos、c-jun阳性细胞的定量分析。模型组c-fos、c-jun阳性神经细胞较假手术组明显增多(P<0.01),治疗组c-fos、c-jun阳性神经细胞较模型组明显减少 (P<0.05)。
3 讨论
脑缺血后即早基因的表达变化,与缺血后组织损伤、修复及神经网络的重建有关,其表达上调或下调可用于评价脑缺血的干预措施的有效性。Dragunow[7]研究发现,中度缺血缺氧可引起缺血侧神经元c-fos、cjun的快速诱导,且与迟发性选择性神经元死亡有关。蒋犁等[8]采用逆转录扩增、免疫组化和Tunel标记方法,在转录和翻译水平分析c-fos基因表达与脑海马迟发性神经细胞死亡的相关性。结果发现,缺氧缺血后脑海马c-fos mRNA即刻出现表达,至1 h左右达高峰,2 h后表达回落近基础水平;而对照组则无相应的表达曲线;c-fos蛋白表达较c-fos mRNA表达高峰时间迟约1 h,并持续于高水平。提示新生脑的神经元对损伤刺激不仅敏感,而且具有一定的耐受性。李一欣等[9]对新生大鼠脑缺血缺氧再灌注后不同时间段海马CA1、CA3区c-jun基因表达和凋亡细胞进行检测,发现缺血缺氧再灌注3、6、12、24、48、96 h后c-jun基因表达和凋亡细胞均高于对照组,6 h达高峰,7 d时与对照组无显著差异,提示c-Jun可能与轻度缺血缺氧再灌注后神经元的凋亡与修复有关。Yamaguchi[10]发现,脑缺血再灌注1~48 h内,大鼠脑内c-fos和c-jun的mRNA表达增高,而这种增高可被环孢菌素A明显抑制。董劲松等[11]发现,局灶性脑缺血可以引起c-fos在缺血侧脑区的广泛大量表达,而这种表达可被电针部分抑制,同时可见局灶性脑缺血动物模型的脑梗死灶体积减小;但脑内注射cfos反义寡核苷酸阻断c-fos表达,可导致脑梗死灶体积明显增大,提示脑内c-fos的过度表达是脑缺血损伤的机制之一,但其适度的表达,可能在脑缺血损伤中有一定的保护作用。
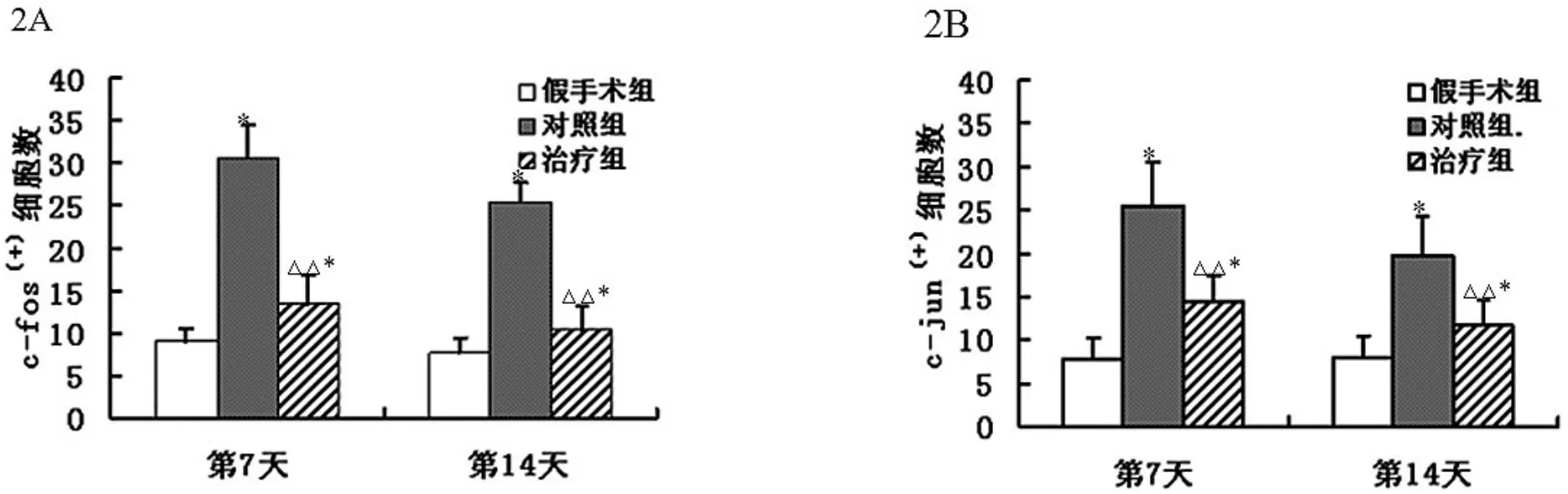
图2 c-fos、c-jun表达阳性神经元及神经胶质细胞(SP染色,×400)
脑缺血-再灌注损伤后,神经元和神经胶质细胞内均可见c-fos和c-jun表达,且其表达可受细胞内信号通路如神经生长因子 (nerve growth factor,NGF)、表皮生长因子 (epidermatic growth factor, EGF)、成纤维细胞生长因子 (fibroblast growth factor,FGF)和白细胞介素-6 (interleukin 6,IL-6)等诱导,参与神经突触可塑性的调节[12-15]。
EGb 761是银杏叶的提取物,含有多种相互作用的有效成分 (如黄酮糖苷、银杏苦内酯、白果内酯、先期花色素及少量酚酸),具有多价性的药理学作用。研究证实,EGb 761抗氧化、清除自由基,抗缺血引起的细胞凋亡等作用[16-19]。由于血脑屏障仅允许脂溶性小分子物质有效透过,限制了许多药物疗效的发挥,近几年作为一种系统性用药技术,侧脑室注射技术可提高治疗的靶向性,有效提高损伤局部血药浓度,被越来越多地应用于实验研究,并获得了良好的效果[20-22]。EGb 761具有水溶性和脂溶性双重特性,分子量较大,只能部分透过血脑屏障,因此,我们采用侧脑室注射技术以提高其缺血-再灌注损伤局部血药浓度,以提高其靶向性疗效。
本研究提示,大脑中动脉脑缺血-再灌注模型可引起皮层梗死灶周围神经细胞凋亡及c-fos、c-jun的过度表达;而侧脑室注射EGb-761可抑制细胞凋亡,下调cfos、c-jun的过度表达,上调海马区内源性神经干细胞的发生,这可能是其抗缺血-再灌注损伤的分子机制之一,为侧脑室注射EGb 761用于脑缺血-再灌注损伤的治疗提供了理论依据。

