99mTc-HYNIC-TOC SPECT/CT显像中胰头高摄取的判读:生理性摄取或胰腺神经内分泌瘤?
徐俊彦,李 毅,许晓平,李 蓓,章英剑
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海200032;
2.复旦大学生物医学影像研究中心,上海200032;
3.上海分子影像探针工程技术研究中心,上海200032
神经内分泌瘤(neuroendocrine tumor,NET)起源于神经内分泌细胞,具有多变的恶性潜能及异质性的特征,常给临床治疗带来挑战。NET作为罕见肿瘤,仅占所有恶性肿瘤的0.5%[1],但近几十年来发病率逐年上升。大部分NET起源于胃、小肠及胰腺,其中胰腺NET(pancreatic NET,pNET)最多见[2],占胃肠胰神经内分泌肿瘤的49.8%。约70%的pNET肿瘤细胞表面高表达生长抑素受体(somatostatin receptor,SSTR)[3],尤其是SSTR2。这一分子生物学特征使NET病灶容易被SSTR显像探测到。99mTc-HYNIC-TOC是生长抑素类似物,能与SSTR2特异性结合,在NET诊断、分期及随访中的价值已受到肯定,诊断pNET的准确率高达90%[4-6]。
在长期临床实践中,胰腺尤其是胰头部位经常出现高摄取,但临床随访未出现相关症状,传统影像学检查也未发现异常占位。近年来,越来越多的文献关注胰头部位的生理性摄取,包括111In-奥曲肽、99mTc-HYNICTOC SPECT/CT显像及68Ga-生长抑素类似物(somatostation analog,SSA)PET/CT显像均有类似报道[7-10]。胰头局部的生理性摄取会导致SSTR显像的假阳性结果,因此本研究分析胰头生理性摄取的不同表现,以提高99mTc-HYNICTOC SPECT/CT诊断pNET的准确率。
1 资料和方法
1.1 临床资料
回顾性分析2016年10月—2017年12月因疑似pNET或转移性NET寻找原发部位或其他部位NET临床分期或随访而在复旦大学附属肿瘤医院行99mTc-HYNIC-TOC SPECT/CT检查的125例患者。其中男性60例,女性65例;年龄20~81岁,平均(52.70±12.13)岁。入选病例中,包括疑似pNET 37例,转移性NET寻找原发灶20例,NET临床分期或随访68例。所有阳性病灶经手术或穿刺病理学或6个月以上的B超、CT或MRI等临床随访证实,病理学诊断明确者20例,临床随访者105例。
1.2 检查方法
99mTc-HYNIC-TOC由复旦大学附属肿瘤医院核医学科根据参考文献[11]自行制备,现已开发为试剂盒,标记物放射化学纯度经纸层析法和放射薄层层析法检测大于95%。显像仪器采用带CT的双探头SPECT(Discovery NM/CT 670,美国GE公司),配备低能高分辨平行孔准直器。静脉注射370~555 MBq(10~15 mCi)99mTc-HYNIC-TOC2 h后,先采集全身平面显像,后行躯干部SPECT/CT断层显像,经迭代重建后,用专用软件eNTEGRA(GE Medical Systems)处理及阅片。
1.3 图像分析
所有图像由2名有经验的核医学科医师盲法读片,通过视觉分析确定胰头部位是否存在放射性摄取增高及位置分布,若增高则对局部、胰腺体部正常组织、肝门区邻近正常肝组织(避开脉管区域)和胰头同层面竖脊肌软组织勾画感兴趣区(region of interest,ROI)并获得相应的平均放射性计数值,然后计算病灶/胰腺本底比(L/P)、病灶/肝脏本底比(L/H)及病灶/肌肉本底比(L/M)。除胰头病灶完整勾画外,其余ROI只取直径1 cm大小,勾画中需注意避开功能/解剖上表现出的邻近病灶。
1.4 统计学处理
数据经SPSS 16.0统计软件进行分析,根据最终随访结果,采用非参数检验方法区分pNET与胰头生理性摄取的L/P、L/H及L/M差异是否有统计学意义,P<0.05为差异有统计学意义。对差异有统计学意义者行受试者工作特征(receiver operating characteristic,ROC)曲线分析,获取各靶/本底比的最佳阈值。
2 结 果
根据视觉判断,42例(33.6%)患者存在胰头区域的放射性摄取增高。其中22例6个月以上影像学随访未见局部有异常占位,考虑为生理性摄取(图1),放射性高摄取灶位于钩突及胰头其余部位者各占50%。另有20例病理证实为pNET(图2),根据世界卫生组织(World Health Organization,WHO)2010标准[12],G1为8例,G2为9例,G3为3例;50%的患者同时伴有肝转移;放射性高摄取灶仅4例位于钩突,16例在胰头其余部位。生理性摄取病例中,男性13例,年龄明显较无生理性摄取者年轻[(48.0±12.9)岁 vs (53.3±12.1)岁,P=0.047]。
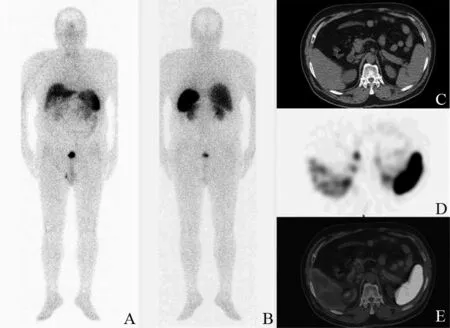
图1 生理性摄取图像患者,男性,54岁,胃NET术后随访。99mTc-HYNIC-TOC平扫显像(A前位,B后位),全身未见明显放射性摄取异常增高灶;CT平扫(C)胰头钩突未见明显软组织肿块影;SPECT显像及SPECT/CT融合图像(D、E)则见胰头钩突局灶性放射性摄取增高,L/P=7.5,L/H=1.3,L/M=12.0
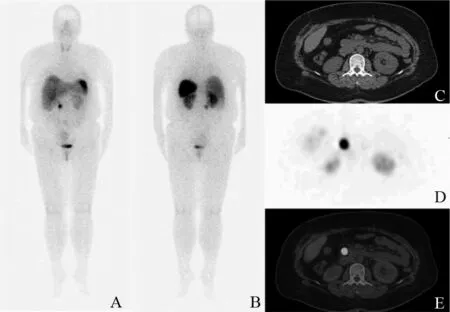
图2 pNET图像患者,女性,48岁,因肝脏肿瘤行特殊肝段切除,病理示NET,G2。99mTc-HYNIC-TOC平扫显像(A前位,B后位)示右中腹部局灶性放射性摄取增高;CT平扫(C)胰头钩突占位不明显;SPECT显像及SPECT/CT融合图像(D、E)见胰头钩突局灶性放射性异常浓聚,L/P=14.1,L/H=5.7,L/M=43.3
以胰头高摄取灶与不同区域本底的比值进行半定量分析发现,L/H和L/M在生理性摄取灶与pNET之间差异均有统计学意义(P=0.001和0.013,表1)。对L/H和L/M行ROC曲线分析显示,两者曲线下面积(are aunder curve,AUC)分别为0.789和0.725。当L/H的阈值为1.4时,灵敏度和特异度分别为70%和77%;当L/M的阈值为12.46时,灵敏度和特异度分别为65%和86%。在不同分级的pNET患者中,L/P、L/H和L/M差异均无统计学意义(P=0.456、0.131和0.293)。
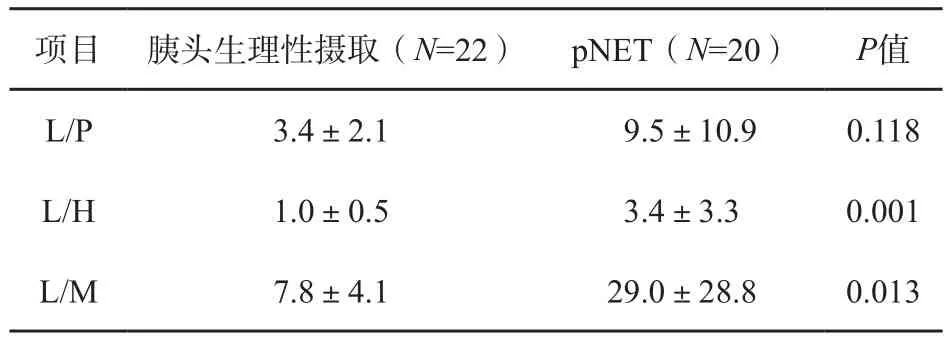
表1 胰头高摄取灶的半定量分析
3 讨 论
目前,68Ga SSA已获美国食品药品管理局(Food and Drug Administration,FDA)批准用于神经内分泌肿瘤的显像。然而应用至今,有不少报道显示68Ga-SSA在胰头钩突部位存在增高的摄取[8,13-15]。该部位的生理性摄取并不罕见,大部分报道其发生率在30%左右,甚至有一项研究显示70%的患者具有胰头钩突部位的生理性摄取[13]。早先的单光子SSTR显像中也有同样发现,其中111In-DTPA-奥曲肽显像中胰头生理性摄取的报道较多[7,9,16]。如果对胰头的生理性摄取认识不足,无疑会在SSTR显像的图像分析中将其误判为阳性。本研究发现,99mTc-HYNIC-TOC SPECT/CT显示的胰头生理性摄取发生率为17.6%,虽然低于68Ga-SSA PET/CT,但与另一项报道[17]相似(19.4%),但其总病例数仅为41例,因此本组的发生率较为真实。
对68Ga-SSA PET/CT显像的胰头/钩突部位生理性摄取进行研究发现,生理性摄取最大标准摄取值(maximum standardized uptake value,SUVmax)为5.8~10.59[18-19],与pNET的摄取差异无统计学意义,因此误判概率较高。本研究采用99mTc-HYNIC-TOC SPECT/CT显像,利用靶/本比进行半定量研究,虽然检查速度慢于PET/CT,射线衰减多于68Ga,其中的L/P在生理性摄取灶与pNET之间的差异也无统计学意义,但L/H和L/M差异均有统计学意义,且L/H在ROC曲线分析中AUC更高(0.789),诊断效率在3个指标中最高。因此,在胰头高摄取灶的判读中,将高摄取灶与正常肝脏作对比的价值最大,准确率最高。当L/H的阈值为1.4时,灵敏度、特异度和准确率分别为70%、77%和79%。近期一项111In-DTPA-奥曲肽在胰头/钩突部位生理性摄取的研究[9]中,同样应用了胰头/钩突部位高摄取灶与正常肝脏对比的方法。但他们采用视觉分析,将胰头/钩突的摄取用4分法来分级,0分为没有摄取,1分为摄取程度低于肝脏生理性摄取,2分为摄取程度等同于肝脏生理性摄取,3分为摄取程度高于肝脏生理性摄取。该研究结果显示,大部分胰头/钩突生理性摄取为1分(15%)和2分(10%),与本研究结果类似。然而,通过4分法判断主观性较强,本研究采用的L/H可操作性强,更加客观,对99mTc-HYNIC-TOC SPECT/CT分析胰头高摄取性质有重要的应用价值。
本研究还观察到胰头生理性摄取好发于青年男性,可能与胰头的生理特征有关。在1例胃泌素瘤SSTR显像的病例报道[16]中,同样观察到胰头区域的局灶性放射性摄取增高 ,手术病理证实是胰腺多肽(pancreatic polytide,PP)细胞增生引起的。Wang等[20]发现相比于胰腺其他部位,PP细胞更多富集于胰头尤其是钩突区域;而且PP细胞表面表达SSTR1~4,从而导致SSTR显像中胰头/钩突的生理性摄取。年长者可能发生PP细胞退化,导致胰头生理性摄取的发生率低于年轻人。
在99mTc-HYNIC-TOC SPECT/CT显像中,胰头/钩突的生理性摄取并不罕见,尤其多见于青壮年男性,需要注意鉴别诊断。L/H可作为鉴别胰头生理性摄取与胰腺NET的参考指标。

