重金属铅对绢毛委陵菜光合特性及荧光参数的影响
, , , , , , , ,
(东北林业大学园林学院,黑龙江 哈尔滨150040)
我国约有五分之一的耕地受到重金属的污染,重金属污染具有多元性、隐蔽性、一定程度上的长距离传输性和污染后果严重性等特点,其中铅污染的范围最广[1-2]。铅是一种有毒性的银白色金属,对植物危害严重,已成为国内外研究的热点[3]。近年来,已有大量关于重金属铅污染对植物毒害的报道[4-5]。植物受到铅毒害后,种子萌发、胚芽发育以及植株的生长进程都会受到影响,严重时能引起植物矮化,叶片失绿,影响植物对矿质元素的吸收并改变膜结构和渗透平衡,同时对叶绿体有一定的损伤,进而影响到植物的光合作用[6]。但铅又是植物生长的非必需元素,所以土壤中铅的含量超过植物的耐受范围后会对植物产生一系列毒害作用[7]。因此这种重金属成为目前研究的重点[8]。
土壤的重金属污染使园林地被植物的生长受到了极大威胁,进而加速了耐重金属污染园林植物的筛选。在北方地区,应用在城市园林绿化中的地被植物的种类并不多,能适应北方干旱、寒冷的种类更加有限。绢毛委陵菜(PotentillasericeaL.)是良好的地被植物,适宜生存的生态环境十分广泛[9],花色艳丽,栽培管理简单,具有较高的园林利用价值[10]和特别的观赏效果,且在环境保护、水土保持等方面有着明显的优势。目前关于委陵菜的引种驯化、干旱胁迫等方面有报道,但重金属胁迫下光合特性及荧光参数的变化未见报道。本试验以绢毛委陵菜为材料,研究绢毛委陵菜光合特性及荧光参数对Pb2+胁迫的响应机制,为选择耐金属污染植株提供理论依据,对修复土壤重金属污染,充分挖掘超富集植物具有一定的理论及实践指导意义。
1 材料与方法
1.1 试验材料
绢毛委陵菜为黑龙江省森林植物园提供的野生栽培种。
1.2 试验设计
在东北林业大学苗圃基地进行盆栽试验(花盆直径120 mm×高110 mm),每盆装土0.25 kg(干质量)。将生长一致、发育正常的多年生绢毛委陵菜幼苗定植到花盆中,每盆5株。待生长恢复后进行Pb2+胁迫处理,Pb以Pb(NO3)2的形式加入。处理期间,采用称重法进行水分的控制,使水分处于60%~80%之间,保证植株正常生长。
重金属Pb2+胁迫试验设置0 mg·kg-1、300 mg·kg-1、600 mg·kg-1、1 000 mg·kg-1、1 500 mg·kg-1和2 000 mg·kg-1(以含Pb2+量计,每组5盆,重复3次)6个浓度梯度。分别以CK、Pb 300、Pb 600、Pb 1 000、Pb 1 500、Pb 2 000表示,采用根外浇灌的方法,将Pb(NO3)2以水溶液的形式分5次加入到盆土中,避免重金属的流失。每10 d后测定各生理指标。共计50 d。
1.3 试验方法
1.3.1光合作用相关生理因子的测定 采用美国Li-Cor公司生产的LI-6400便携式光合测定仪测定光合数据,测量均在上午9:00-11:00,天气晴朗无风条件下进行。测定时选取生长良好、大小相近的叶片,以专用内置红蓝光源控制叶室,光强设置为1 200 μmol·m-2s-1,CO2浓度设定为400 μmol·mol-1(使用CO2钢瓶)。温度控制在28°C[11],设定系统内气流速度为500 μmol·s-1,对照组和处理组分别选取3片叶子测定,并做好标记,每片叶子每次测量重复记录3组数据,然后计算其平均值。测定指标包括叶片净光合速率(Pn,μmol CO2·m-2·s-1)、蒸腾速率(Tr,mmol H2O·m-2·s-1)、气孔导度(Gs,mol H2O·m-2·s-1)、胞间CO2浓度(Ci,μmol CO2·mol-1)。
1.3.2光合荧光参数的测定 在植株生长到最后阶段时,采用美国LI-Cor公司生产的LI-6400便携式光合测定仪,使用荧光叶室,测定绢毛委陵菜的荧光参数。测量条件与测量光合的条件一致。参照Ralph[12]的方法,将叶片暗适应30 min,测定初始荧光(Fo)、最大荧光(Fm)。从每个培养盆中选取长势基本一致的绢毛委陵菜的叶片的相同部位做好标记并进行测量,获得3个以上的平行数据。根据以上数据计算:可变荧光Fv(Fv=Fm-Fo)、PSII最大光化学效率(Fv/Fm)、PSII潜在活性(Fv/Fo)。
1.4 数据分析
计算和绘图采用Excel 2003软件进行,方差分析采用SPSS 17.0统计软件进行,多重比较分析和显著性分析使用Duncan法。
2 结果与分析
2.1 重金属铅胁迫对绢毛委陵菜光合特性的影响
2.1.1铅胁迫对净光合速率(Pn)的影响 植物的净光合速率积累的有机物,是植物进行生长发育的重要物质基础,试验结果表明,Pn会随着胁迫时间的延长和浓度的升高呈明显下降趋势。如图1,在10 d时,Pb 300与Pb 600有较小幅度的上升,分别上升0.34%,1.07%,Pb 300与Pb 600较对照组差异性不显著,Pb2000与其它各组差异性显著(P<0.05),Pb 2 000较对照组下降了24.37%;20 d,30 d时的变化幅度与第10 d基本相同,Pb 300与对照组差异性不显著,20 d时,Pb 2 000较对照组差异性显著(P<0.05),比对照组下降了31.69%,30 d时,Pb 2 000较对照组下降了50.04%。在重金属铅胁迫50 d时,随着浓度的增加,Pn的下降趋势和下降幅度加快。处理组Pb 300与对照组相比下降了24.37%,但可以正常生长。剩余的处理组与对照组相比均差异性显著(P<0.05)。各处理组分别比对照组下降了37.52%,69.41%,75.96%,79.35%。
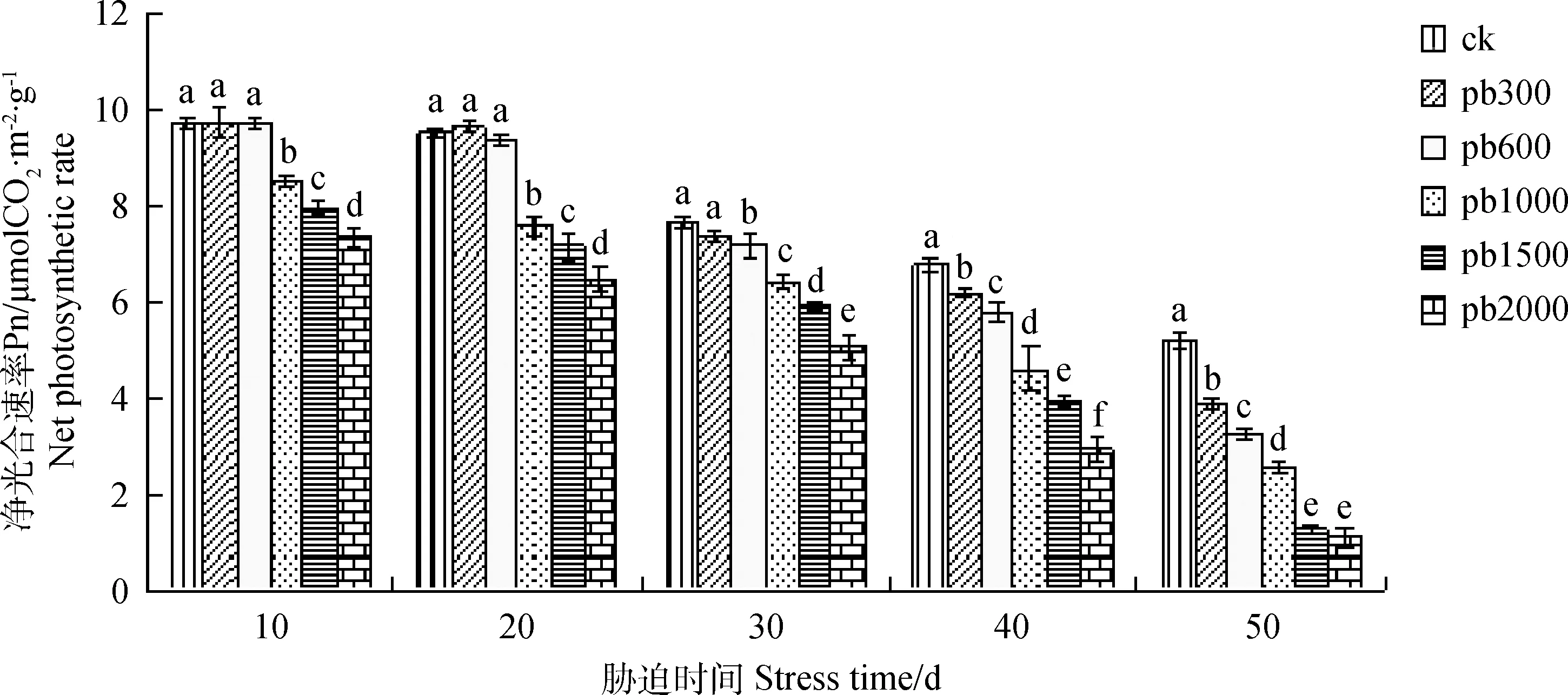
图1 铅胁迫对叶片净光合速率的影响Fig.1 Effect of heavy metal lead stress on net photosynthetic rate of leaves注:不同小写字母表示同一时间不同处理浓度间显著差异(P<0.05),下同Note: Different lowercase letters indicate significant difference among different pb concentrations at the same time at the 0.05 level; The same as below
2.1.2铅胁迫对气孔导度(Gs)的影响 气孔导度指的是气孔的张开程度,叶片气孔是控制二氧化碳由大气进入叶肉组织以及水分从叶片内部扩散到周围空气中的阀口,其参与植物的多种生理过程。由图2可知,绢毛委陵菜受到重金属铅的胁迫后,气孔导度出现下降趋势,且浓度越大下降趋势越明显。在第10 d时,Pb 300较对照组略微上升,其余处理组随浓度的升高气孔导度逐渐下降。20 d时,Pb 300,Pb 600与对照组差异性不明显,其余各组与对照组相比显著下降。自30 d开始,各处理组之间差异性显著,呈下降趋势。在50 d时,植株的气孔导度达到最低,各处理组分别比对照组下降了21.81%,62.31%,66.31%,67.19%,74.74%。

图2 铅胁迫对叶片气孔导度的影响Fig.2 Effect of heavy metal lead stress on stomata conductance of leaves
2.1.3铅胁迫对蒸腾速率(Tr)的影响 蒸腾作用承担了植物吸收水分和转运水分的主要工作,能够保持细胞组织形态完好,且能将光合作用和氧化代谢中产生的多余热能散到植株体外。如图3可知,蒸腾速率的变化趋势与净光合速率和叶片气孔导度的变化趋势相似。随着铅胁迫浓度的加大蒸腾速率逐渐下降,各处理组与对照组相比均差异性显著,处理50 d时的各个浓度梯度分别比对照组降低了43.01%,53.51%,54.54%,57.61%,68.28%;处理组Pb 300,Pb 600,Pb 1 000,Pb 1 500差异性显著。
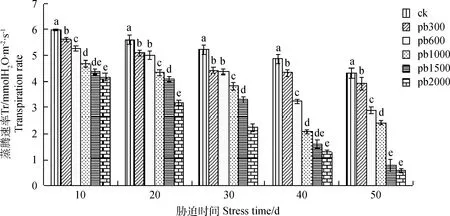
图3 铅胁迫对叶片蒸腾速率的影响Fig.3 Effect of heavy metal lead stress on transpiration rate of leaves
2.1.4铅胁迫对胞间CO2浓度(Ci)的影响 如图4可知,胞间CO2浓度与胁迫浓度呈正相关。10 d,20 d,各处理组与对照组相比上升趋势大致相同,30 d,40 d,50 d上升幅度较大。10 d,20 d时,Pb 300与对照组差异性不显著,其他各处理组与对照组均差异性显著(P<0.05)。在30 d时,Ci急剧上升,各处理组间差异性显著,分别比对照上升了8.17%,35.28%,46.01%,54.33%,75.22%。此时,Pb2000的生长较其它组生长缓慢。40 d,50 d时,各处理组Ci一直在上升,但是上升的幅度基本保持一致。50 d各处理组分别比对照组增加了13.58%,24.59%,31.37%,43.98%,73.51%,此时处理浓度Pb 1 000,Pb 1 500,Pb 2 000的植株地上部分已干枯接近死亡。
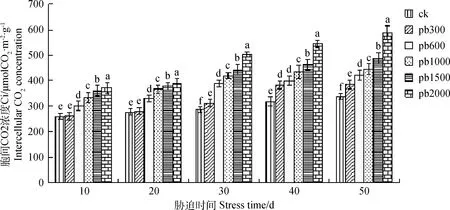
图4 铅胁迫对叶片胞间CO2浓度的影响Fig.4 Effect of heavy metal lead stress on intercellular CO2 concentration of leaves
2.2 重金属铅对绢毛委陵菜叶绿素荧光参数的影响
植物在正常情况下,PSII最大光化学效率(Fv/Fm)的数值稳定,一般在0.75~0.85之间,这一数值与物种无关,只有在植物受到外界不良环境胁迫时,Fv/Fm的数值会显著下降[13]。Fv/Fm的值反映了PSII反应中心均处于开放状态时的量子产量,即PSII的潜在最大量子产量[14]。如图5,在重金属胁迫到第50 d时,处理组Pb300与对照组PSII最大光化学效率相比,差异性显著,其他4个处理组与对照组相比均差异性显著(P<0.05),分别比对照组下降了13.75%,21.12%,29.53%,38.63%。说明此时浓度较大的处理组可能导致了PSII反应中心失活,而对绢毛委陵菜的生长产生了阻碍。
Fv/Fo反映了PSII的潜在活性,是Fv/Fm的另一种表达方式,同样表明光化学反应状况,不同的是Fv/Fo对胁迫的响应更为敏感,变化幅度也更大。如图6,铅胁迫下PSII潜在活性随着浓度的增大逐渐出现下降的趋势,且所有处理组与对照组相比均差异性显著(P<0.05),表明重金属Pb2+胁迫对绢毛委陵菜产生了显著影响。
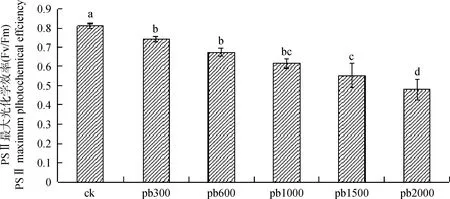
图5 铅胁迫对PSII最大光化学效率(Fv/Fm)的影响Fig.5 Effect of lead stress on maximal photochemical efficiency of PSII (Fv/Fm)

图6 铅胁迫对PSII潜在活性(Fv/Fo)的影响Fig.6 Effect of lead stress on Potential activity of PSII (Fv/Fo)
3 讨论与结论
重金属胁迫对地被植物等所造成的破坏作用主要是与受胁迫的时间长短以及处理组重金属浓度的大小有着一定的联系[15]。大量研究表明,重金属对植物光合作用的影响是通过干扰呼吸和光合过程中的电子传递、生物酶活性和破坏叶绿体的完整性来实现,这种抑制作用具有时间和浓度效应。植物的净光合速率一般随重金属浓度的升高呈先上升后下降[16]或一直呈下降的趋势[17]。在本试验中,随着胁迫时间和胁迫浓度的增加,绢毛委陵菜的净光合速率显著下降,与牟兰[18],杨文权[19],Krupa Z[20]的研究结果一致。刘洋等[21]的研究中表明红椿(Toonaciliate)幼苗叶片的蒸腾速率随浓度的增加逐渐下降,李文娆等[22]也发现随着水分胁迫时间的延长,紫花苜蓿的蒸腾速率也显著下降。这与本试验研究结果一致。气孔因素和非气孔因素都会影响光合速率[23]。Farquhar等[24]认为,检查气孔因素限制是否为光合速率的原因,要同时看气孔导度的大小和胞间CO2浓度的变化。当光合速率下降时,如果两者同时下降,说明光合速率的降低主要是由于气孔因素限制所致;如果气孔导度下降而胞间CO2浓度升高,则表明此时光合速率下降的主要原因是非气孔因素限制所致。本试验中,Pn、Gs下降,Ci升高说明影响绢毛委陵菜光合速率的原因是非气孔因素限制。
光合作用是植物体中重要的代谢过程,而叶片叶绿素荧光与光合作用密切相关,因此将叶绿素荧光参数作为光合反应中灵敏的指标[25]。而Fv/Fm和Fv/Fo值用于度量植物叶片PSII原初光能转化效率和PSII潜在活性,是表明光化学反应状况的2个重要参数[26]。叶绿素荧光参数的变化能够反映外界的环境胁迫对植物光合作用各过程产生的影响[27]。在本试验中,随着Pb2+处理浓度的增大,叶片最大光化学效率(Fv/Fm)明显下降,且在Pb 1 000,Pb 1 500、Pb 2 000处理时下降幅度较大,各处理组均与对照差异显著。不同浓度的Pb2+胁迫处理对绢毛委陵菜的Fv/Fm影响不同,原因可能是低浓度处理激发了植物体内铅的解毒机制,将Pb2+胁迫对PSII的抑制作用降到最低。试验结果表明,绢毛委陵菜的光化学效率随着Pb2+胁迫浓度增大,逐渐减小,表明铅胁迫引起PSII反应中心的开放程度和捕获激发能的效率下降。在Fv/Fm代表光反应中心的原初光能转换效率,反映植物体内进行光合作用的潜在的最大光合能力[28]。本试验中随着胁迫浓度的增大Fv/Fm逐渐减小,与韩张雄[29]、万雪琴[30]、刘晓静[31]等的研究结果保持一致。
在重金属铅胁迫下,随着胁迫时间的延长,各处理组光合参数与对照是存在显著差异的。
绢毛委陵菜的Pn、Gs和Tr变化趋势随着胁迫时间和胁迫浓度的增加逐渐降低,Ci变化趋势逐渐升高。此时非气孔因素限制是影响绢毛委陵菜光合速率下降的主要原因。荧光参数Fv/Fm和Fv/Fo显著下降,表明植物的光合系统受到破坏,光合物质合成减少,植物的生长受到抑制。绢毛委陵菜在一定的胁迫浓度范围内(Pb 300,Pb 600)可以存活,可以考虑将绢毛委陵菜作为重金属铅轻微污染地区的修复植物。

