灭菌处理对不同含水量玉米青贮影响的研究
, , *, , , ,
(1. 山西农业大学动物科技学院, 山西 太谷 030801; 2. 中国农业大学动物科学院, 北京 100193; 3. 山西农业科学院高寒区作物研究所, 山西 大同 037008)
玉米青贮具有产量高、消化率高、能量高以及易调制和适口性好等优势,在牛、羊等反刍动物粗饲料供应中占有举足轻重的地位。适宜的水分含量是青贮饲料保存的重要条件之一,青贮原料含水量要求在65%~70%范围内[1]。青贮饲料发酵中适宜的水分含量能影响细菌总数和发酵速率[2]。原料中的含水量是保证青贮过程中乳酸菌新陈代谢的条件之一,过高或过低的水分含量都会影响饲料发酵过程和青贮饲料的品质。如果水分含量过高, 青贮发酵过程中养分损失多,梭菌繁殖会造成饲料腐败难以得到控制,影响青贮品质[3]。含水量过低,原料装填时难以压紧,原料间会残留大量的空气,青贮料汁液浓度越大,导致渗透压较强,抑制了青贮饲料的发酵,酵母和霉菌易于生长,易引起“二次发酵”的现象[4]。本研究将玉米(ZeamaysL.)原料晾干后,施以灭菌处理,再设置不同的含水量,评估灭菌处理对不同含水量青贮玉米的影响,一方面探讨原料水分对青贮玉米发酵的影响,同时旨在为将来评定青贮添加剂的直接效应提供科学依据。
青贮灭菌处理,青贮过程中,优质青贮随发酵时间的延长,微生物数量呈先增后减的趋势,初期养分充足且有一定的含氧量,无论是真菌还是细菌均快速增殖,后期随着可利用营养物减少,氧气的消耗和一些产酸菌的产物导致PH降低,能存活的微生物也随之减少。在青贮前对原料进行灭菌处理,可排除微生物对于研究水分时的影响。灭菌处理也可减少青贮本身营养物质的损失,提高利用率和经济效益。本文研究了对原料灭菌条件下青贮的发酵情况,并与通常的青贮发酵模式比较优劣。
1 材料和方法
1.1 试验材料
原料为全株青贮玉米,品种为晋单42号,取自山西省晋中市太谷县昌晟农牧专业合作社(37°25′ N,112°23′ E,海拔799 m),将蜡熟期全株玉米收割后(无泥土)取回,进行机器切割,切碎长度1~2 cm,在室内阴干,通风且避免阳光照射,含水量间隔3 h测一次,在阴干15 h时水分含量为77%,48 h含水量55%,64 h含水量为40%,86 h含水量为25%。取目的含水量原料混合均匀,每罐装入140 g样品,压实,瓶口覆膜密封。青贮容器选用容积为500 ml的玻璃罐(直径8.5 cm,高10 cm,壁厚0.2 cm)。灭菌处理组将装满原料的青贮罐用高压灭菌锅在121℃条件下灭菌30 min,冷却后备用。将制作好的青贮罐,置于17~37℃的室内贮藏(避免阳光直射)。青贮前全株玉米营养成分见表1,包括干物质(dry matter,DM)、粗蛋白(crude protein,CP)、粗脂肪(ehanol extract,EE)、中性洗涤纤维(neutral detergent fiber,NDF)、酸性洗涤纤维(acid detergent fiber,ADF)、可溶性碳水化合物(water soluble carbohydrate,WSC)、粗灰分(Ash)与淀粉(Starch)。

表1 青贮前全株玉米营养成分Table 1 The nutrition components in whole-plant corn before ensiling
1.2 试验设计
试验包括灭菌和水分处理2个因素,灭菌设灭菌与不灭菌2个处理,水分梯度分别为25%,40%,55%和70%的含水量,共形成8个处理,每个处理重复3次,试验设计见表2。

表2 试验设计Table 2 The experimental design
注:NM组为不灭菌处理,1~4水分含量从低到高分别为25%,40%,55%,70%,SM组为灭菌处理,1~4水分含量从低到高分别为25%,40%,55%,70%
Note: The NM group was not sterilized. The moisture content from 1~4 was from low to high, 25%, 40%, 55%, and 70%, respectively. The SM group was sterilized, and the 1~4 water content was from low to high, respectively 25 %, 40%, 55%, 70%
1.3 取样分析
每次取样时,开罐后首先除去上层1 cm厚的青贮料,充分混匀,测定青贮的pH、有机酸和氨态氮(NH3-N)。同时测定DM、EE、Ash、CP、NDF、ADF、WSC、Starch,乳酸菌、酵母菌和霉菌,有氧稳定性,水活度。精密酸度计(PHS-2C)测定pH[5],高效液相色谱法测定有机酸[6],苯酚-次氯酸钠比色法测定NH3-N[7]。烘干法测定DM[8]。索氏抽提法测定EE[9]。凯氏定氮法测定CP[10]。按照Association of official Analytical Chemists (AOAC) 2002的方法测定Ash[11]。范氏(Van Soest)洗涤纤维滤袋法测定NDF和ADF[12]。蒽酮-硫酸法测定WSC[13]。Herrera-Saldana等方法测定Starch[14],用水分活度仪(HD-4)测定水活度(Aw)。
取鲜样10 g,装入盛有0.85%灭菌生理盐水225 ml的三角瓶内,置于摇床上震荡30 min, 稀释100倍后取100 μl于MRS培养基上,涂布均匀,在30℃下培养48 h[15]。霉菌和酵母菌用孟加拉红培养基,30℃条件下培养48 h对活菌进行有效计数[16]。
对有氧稳定性进行评定,在发酵42 d后打开全部青贮罐取样,每个处理取50 g,充分混匀,松散放入500 ml玻璃罐。每个罐口覆盖两层粗棉布,以避免污染和防止样品水分散失,样本保存在室温下(19~25℃)。测量温度时,数字温度计探头放在青贮饲料的中间。有氧稳定性测量当青贮饲料温度超过环境温度2℃时说明青贮开始腐败变质,记录时间[17]。
1.4 数据分析
测定数据用 Excel 2007 及SPSS 17.0 软件进行方差分析,数据用(均值±标准差)表示。
2 结果与分析
2.1 灭菌处理对不同含水量玉米青贮营养成分的影响
由表3可知,不同水分含量对营养成分也表现出一定的影响,高水分灭菌组干物质保存率达到99.40%,而不灭菌组的干物质的保存率为97.67%,不灭菌组的可溶性碳水化合物为4.15%,而灭菌组可溶性碳水化合物高达18.10%。 试验结果表明,青贮前后各处理之间,营养成分除干物质含量有差异之外,CP,EE,Ash,NDF,ADF,Starch 含量差异不显著。WSC 含量相对于青贮前,不灭菌组含量损失较大,而其它组变化不大。
2.2 灭菌对不同含水量玉米青贮发酵有机酸的影响
由表4可知,通过对各处理组青贮饲料的检测,从全株玉米青贮过程中的 pH 变化看 ,不灭菌组的pH相比灭菌组较低,高水分含量玉米青贮比低水分组玉米青贮pH 低,乳酸(lactic acid,LA)含量高水分组低于低水分组,灭菌组在高温灭菌条件下没有乳酸产生。高水分处理组的乙酸(acetic acid,AA)含量和丙酸(propionic acid,PA)含量都始终低于低水分组。灭菌组因处于高温灭菌条件,乙酸和丙酸均未检测到。此外,在本试验中,未检测到有丁酸的存在,表明青贮饲料保存比较成功。不同含水量处理间玉米青贮料的氨态氮(ammonia nitrogen,AN)含量有所不同,高水分组的氨态氮含量最高。
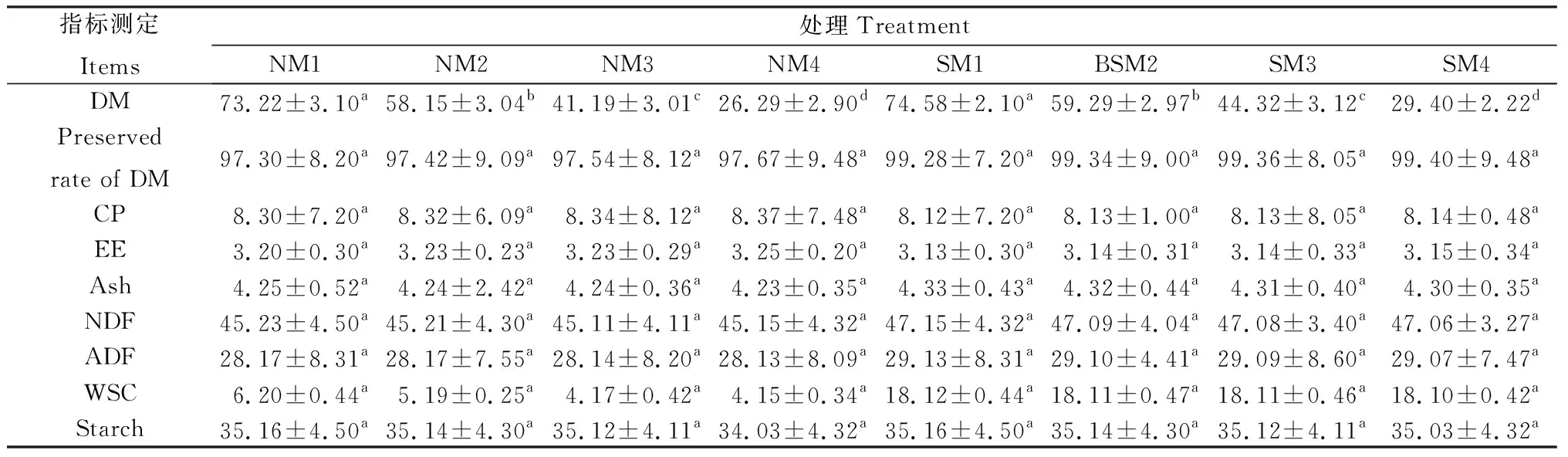
表3 玉米青贮饲料的营养成分Table 3 Nutritional Components of Corn Silage
注:表中数值为平均值±标准差,同列不同小写字母表示不同处理间的差异达到显著水平(P<0.05),下同
Note: Different small letter in the same column means significantly differences among different treatment at the 0.05 level, the same as below

表4 玉米青贮发酵品质pH和有机酸Table 4 The pH and organic acids content of Corn silage
注: -表示没有检测到含量
Note: - indicates that no content was detected
2.3 灭菌对不同含水量玉米青贮饲料微生物的影响
青贮玉米饲料中微生物数量分析见表5所示。在高温灭菌条件下,无乳酸菌和霉菌产生。不灭菌条件下NM3和NM4乳酸菌含量无差异,NM1组含量低于NM2组(图1A),不灭菌处理下4个梯度的含水量酵母菌含量基本无差异,开始增长缓慢,后趋于稳定(图1B),霉菌含量在0~3天时迅速增长,之后减少,不同含水量青贮霉菌含量NM1>NM2>NM3>NM4(图1C)。高含水量组NM4乳酸菌含量为3.45,0~3 d急速增长,第7 d时达到高峰6.99,之后趋于稳定,酵母菌和霉菌0~3 d时也在增长,但增长曲线幅度没有乳酸菌急剧,酵母菌在第7 d时与乳酸菌含量接近,之后缓慢下降;而霉菌的含量显著低于乳酸菌和酵母菌,在第7 d达到峰值5.13,之后迅速下降,霉菌在青贮完成时仅以极少量的状态存在(图1D)。
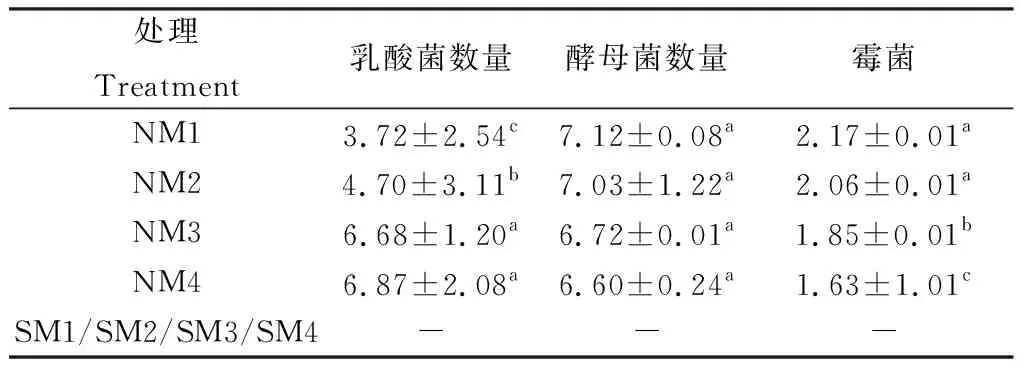
表5 玉米青贮饲料中的微生物Table 5 Microorganisms in Corn Silage/log cfu·g-1 FM
注: log cfu·g-1FM为每g青贮中菌落的对数值,下同
Note: Log cfu·g-1FM is the logarithm of colonies per g of silage, the same as below
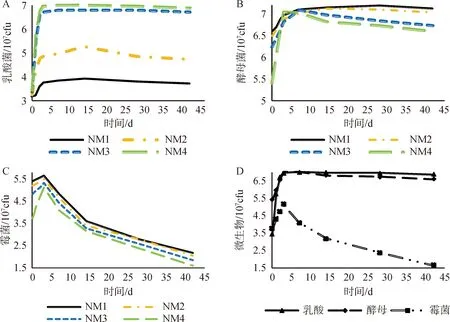
图1 不灭菌处理不同含水量乳酸菌(A)、酵母菌(B)和霉菌(C)的动态变化Fig.1 Non-sterile treatment of different moisture Dynamic changes of lactic acid bacteria (A), yeast (B) and mold (C)
2.4 灭菌对不同含水量玉米青贮饲料水活度的影响
从表6可以看出,青贮玉米发酵中,高水分玉米Aw略高于低水分玉米,灭菌组与不灭菌组差异不显著。
2.5 灭菌对不同含水量玉米青贮有氧稳定性的影响
2.5.1玉米青贮有氧暴露温度变化 在发酵42 d后打开青贮罐取样分析,结果如图2所示,灭菌组青贮温度达到高于环境温度2℃的时间明显高于不灭菌组,不灭菌组分别40 h,50 h,50 h,60 h后高出外界环境温度2℃,而灭菌组分别在70 h,80 h,80 h,90 h后出现不稳定状态。

表6 青贮玉米饲料的水活度Table 6 The water activity of corn silage
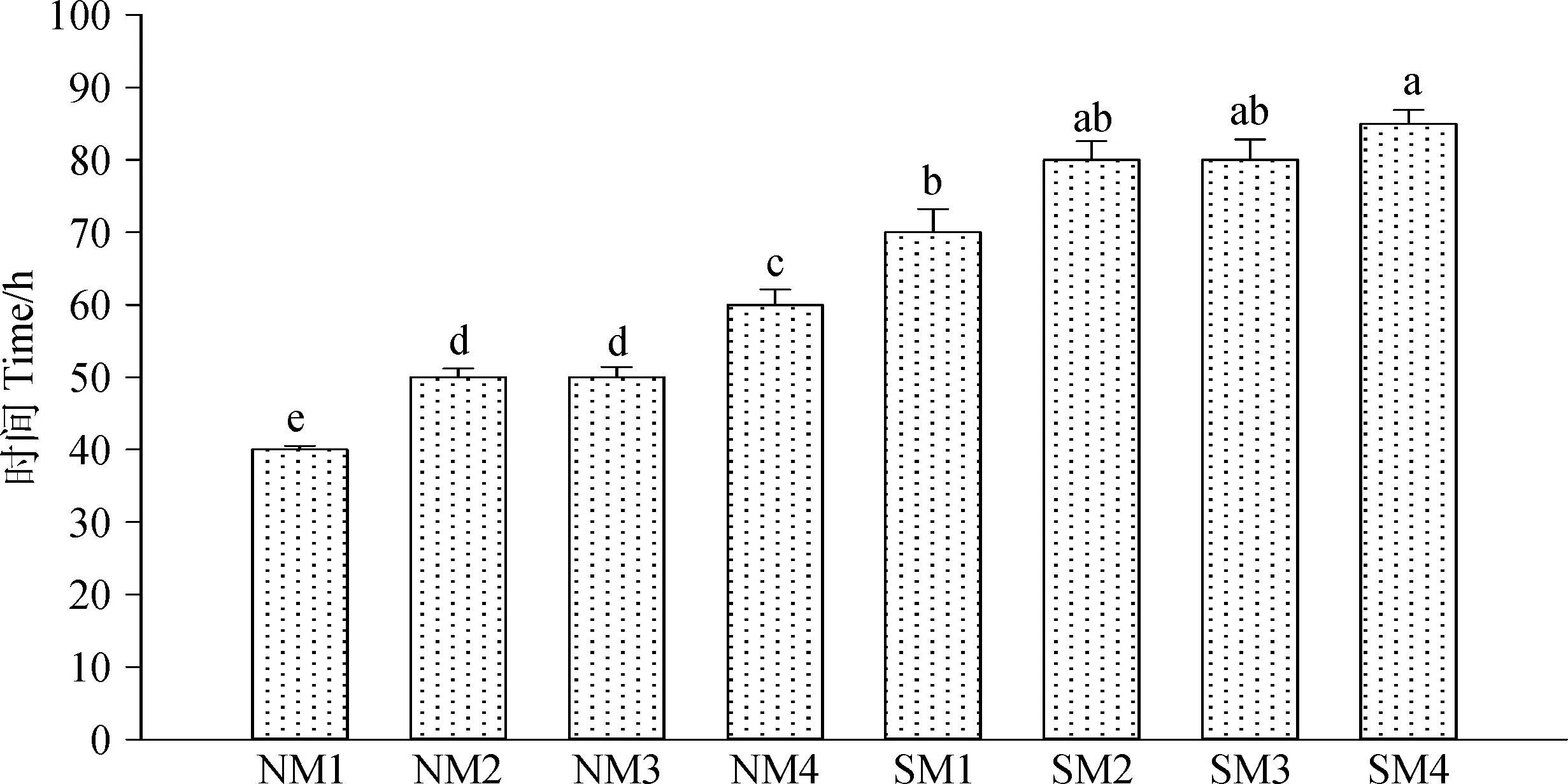
图2 青贮饲料暴露于空气下的有氧稳定性Fig.2 Aerobic stability of silage exposed to air
2.5.2玉米青贮有氧暴露后营养成分变化 从表7可以看出Ash和Starch比有氧暴露前有所增加,其他指标略有下降。WSC损失较大,不灭菌NM4组为4.05%,是青贮前的3.4倍。

表7 不同含水量的青贮玉米营养成分(%DM)的影响Table 7 The influence of different water content of corn silage nutrition ingredient
2.5.3不同含水量在有氧暴露情况下对pH、有机酸的影响 青贮玉米在整个有氧暴露过程中,暴露后pH升高,高水分组pH明显低于低水分组,而灭菌组pH变化不大。乳酸含量整体呈下降,而乙酸和丙酸随着暴露在空气中高于暴露前,灭菌组暴露后没有检测到乳酸、乙酸、丙酸和氨态氮含量(见表8)。

表8 玉米青贮有氧暴露pH和有机酸的变化情况Table 8 The pH and organic acids dynamic in aerobic expose changes of the corn silage
2.5.4玉米青贮有氧暴露后微生物变化 从表9可知,青贮玉米在空气中有氧暴露,灭菌70%含水量组乳酸菌数量相比暴露前(6.87 log cfu·g-1FM)下降显著,酵母菌数量增长缓慢。与暴露前相比,霉菌数增多,出现有霉变,霉味。灭菌处理组乳酸菌含量为0,酵母菌和霉菌数量大幅增加,酵母数量SM4组比NM4组增长约1.2倍,霉菌数量SM4组达到7.37 log cfu·g-1FM,SM4组比NM4组增涨1.7倍。

表9 玉米青贮有氧暴露微生物数量变化Table 9 Microbial quantity changes of the corn silage aerobic expose/log cfu·g-1 FM
3 讨论
3.1 不同含水量对玉米青贮发酵品质的影响
不同的水分含量对营养成分也表现出一定的影响,适中的水分处理营养成分略高于低含水量和高含水量。试验结果表明,青贮前后,各处理组营养成分中除DM含量有差异外,CP,EE,NDF,ADF与Ash含量的平均值均表现出差异不显著,而WSC含量相对于青贮前,不灭菌组含量损失较大,这与金加明和范华[18]的报道一致。在试验中WSC作为发酵底物适当增长被认为是至关重要的[19],WSC含量低,发酵不充分,pH不能迅速下降,发酵品质从而降低。适当降低青贮原料的含水量可使WSC等养分浓缩,有利于乳酸菌发酵,提高青贮品质[20]。而且水分含量为70%WSC含量适当,有利于乳酸菌发酵[21]。灭菌组的WSC含量高达18% DM,可能的原因是灭菌处理杀死了绝大多数的微生物,原本微生物消耗的那部分营养物质以碳水化合物的形式保留,而没有转化为相关的有益产物,类似于乳酸和蛋白酶等。这种情况存在隐患,即当有害微生物(如:霉菌和酵母菌)的入侵或者青贮开罐有氧暴露后有害菌感染的发生,因没有与其竞争性的菌产生抑制作用,从而对青贮的营养品质造成极大的损失。NH3-N含量是评价青贮品质好坏的重要依据,NH3-N含量越高说明营养物质分解越多,青贮料的品质和营养价值就越低。NH3-N/%TN更能反应出饲料中蛋白质的降解情况,可以较好的表达青贮品质的好坏,NH3-N/%TN变化幅度越小,青贮饲料的有氧稳定性越好,反之越差。高水分组青贮和低水分组青贮NH3-N/%TN值均低于5%,但70%含水量的青贮比25%含水量的青贮NH3-N/%TN变化幅度小。本试验NDF和ADF含量对比原料有下降的趋势,这与席兴军[22]在玉米秸中添加乳酸菌结果相一致。
3.2 不同含水量及灭菌处理对玉米青贮微生物的影响
本试验分析了不同含水量梯度下微生物的种类和数量差异。在青贮饲料发酵过程中,因青贮含水量不同,发酵期间青贮饲料中存在的微生物也有差别,但主要存在的有益微生物是乳酸菌,属兼性厌氧型微生物,在无氧条件下也生长良好,其主要特征是以糖为发酵底物产生乳酸,乳酸菌的发酵产物乳酸是导致青贮饲料酸度升高的主要原因之一,且能对不耐酸的有害厌氧微生物产生抑制作用。故青贮饲料的优劣与否取决于乳酸菌的作用,因此,反映青贮质量的重要指标即乳酸的生成量,也是影响pH最主要的因素之一。
在青贮发酵初期,玉米附着的好氧细菌、酵母及霉菌等利用体系残留的氧气消耗原料中营养物质进行繁殖[23]。随着在密闭环境中时间延长,各微生物的发酵活动致使氧气快速消耗,营养物质逐渐减少。乳酸菌发酵产生乳酸使pH下降。氧气的减少和pH的降低改变了霉菌的生长环境,霉菌数量显著减少,整体呈现先缓慢上升后迅速下降的趋势,在青贮完成时仅以极少量的状态存在。而低pH和无氧的环境有利于乳酸菌的生长繁殖,乳酸含量增多,酸性环境增强,使乳酸菌含量整体呈现先显著升高,达到最大值后稍微下降最后趋于稳定的生长状态。其次,微生物的生长需要一定的水分维持,本研究中高水分条件下青贮玉米的微生物含量与低水分条件下青贮玉米微生物含量相比也存在差异。在发酵42 d时,含水量为25%条件下青贮玉米乳酸菌的含量为3.72 log cfu·g-1FM,含水量为70%条件下青贮玉米乳酸菌含量为6.87 log cfu·g-1FM,差异显著。最后,在有氧暴露过程中,随氧气的大面积接触,一些好氧腐败菌开始滋生。酵母菌和霉菌数量均有升高,出现霉变。
不同的微生物之间,最适、最高和最低的水分活度也不同。酵母菌的最低Aw值范围在0.94~0.88,霉菌的最低Aw值范围在0.94~0.73。低水分条件下,渗透压高,细胞原生质浓缩发生质壁分离,故降低水活度不利于微生物生长。减少水分中的溶解氧,可抑制好氧微生物生长。本试验青贮玉米发酵中,高水分玉米青贮水活度值高于低水分玉米青贮,灭菌组与不灭菌组差异不显著。在微生物的生长中,水活度、温度和pH之间存在一定的协同作用[24]。青贮饲料中乳酸菌发酵产物可降低pH,酸度增加,好氧微生物的耐渗透力显著下降,抑制霉菌和酵母菌的生长,从而有利于青贮的健康发酵。
在高温灭菌条件下,高水分组和低水分组均没有产生有益菌和腐败菌,表明灭菌处理可以抑制所有微生物的繁殖。
3.3 不同含水量及灭菌处理对玉米青贮有氧稳定性的影响
在有氧暴露条件下,无论是灭菌组还是不灭菌组,含水量为70%条件下的青贮玉米DM,CP,EE较含水量为25%条件下的青贮玉米高,但差异不显著。有氧暴露后,Ash和Starch比有氧暴露前有所增加,WSC损失较大,高水分组损失率小于低水分组的青贮玉米,但差异不显著。灭菌组分别在70 h,80 h,80 h,90 h后青贮温度比周围环境温度高2℃,说明灭菌处理可以有效延长有氧稳定的时间。
当青贮玉米在空气中有氧暴露,不灭菌组与暴露前相比,无论是高水分还是低水分,乳酸菌的数量均有下降趋势,但NM4组较NM1组乳酸菌含量高,有研究表明,添加乳酸菌可以保持青贮的有氧稳定[25],灭菌组乳酸菌含量均未检测到。不灭菌组酵母菌和霉菌含量低,灭菌组酵母菌和霉菌含量显著增加,酵母数量SM4组是NM4组的1.2倍,霉菌数量SM4组是NM4组的1.7倍。原因有可能是,受外界酵母菌和霉菌感染,而青贮本身经灭菌后微生物含量极少,更加缺乏可抑制有害菌的微生物,再加之可利用的营养物质丰富,故繁殖速度增快,加速青贮腐败,导致青贮品质大大降低。这一假设与有氧暴露后青贮的WSC显著减少相符合,但进一步的数据论证灭菌处理导致青贮WSC含量虚高还有待后续试验。
4 结论
不同含水量的青贮玉米发酵品质差异较大,高水分青贮玉米发酵品质较低水分青贮玉米优良。灭菌处理可以抑制所有微生物的繁殖。不灭菌组含水量在70%条件下,玉米青贮的发酵品质最佳。

