吗啡对非小细胞肺癌A549细胞增殖、侵袭、迁移及上皮间质转化的影响
文怀昌,汪懿,金孝岠,杨柳,袁益民
(皖南医学院第一附属医院,安徽芜湖241000)
肺癌是最常见的恶性肿瘤之一,其发病率和致死率均位居恶性肿瘤首位。大部分肺癌患者确诊时已处于中晚期,错过了最佳的手术时机。肺癌晚期患者多数会伴有不同程度的癌性疼痛,口服阿片类镇痛药是缓解疼痛的最基本方法。吗啡作为阿片类镇痛药的代表性药物,广泛用于癌性疼痛的治疗[1]。研究发现,吗啡除强大的镇痛作用外,还可调节多种肿瘤细胞的增殖、凋亡、侵袭及转移,进而影响肿瘤患者的预后[2]。Niu等[3]研究发现,吗啡具有促进乳腺癌细胞上皮间质转化(EMT)的作用。但吗啡对非小细胞肺癌(NSCLC)细胞增殖、迁移、侵袭及EMT的影响少见报道。2016年8月~2017年12月,我们采用吗啡处理NSCLC细胞,观察吗啡对细胞增殖、迁移、侵袭及EMT相关分子标志物上皮细胞标志物E型钙黏蛋白(E-cadherin)、间充质细胞标志物N型钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)表达的影响,并探讨其可能的作用机制,旨在为吗啡的临床应用提供理论依据。
1 材料与方法
1.1 材料 NSCLC细胞株A549由皖南医学院中心实验室提供。胎牛血清购自美国Gibco公司,RPMI1640培养基购自美国Hyclone公司,盐酸吗啡注射液购自东北制药集团沈阳第一制药有限公司。
1.2 细胞培养方法与分组 向A549细胞中加入含10%胎牛血清的RPMI1640培养基,置于37 ℃、5% CO2培养箱中培养24 h。将细胞随机分为对照组、1 μg/mL吗啡组、10 μg/mL吗啡组、100 μg/mL吗啡组。
1.3 细胞增殖率检测 采用CCK-8法。取对数生长期细胞,加入胰酶消化,制成单细胞悬液,调整细胞密度为2×104/mL,按2×103/孔接种于96孔板中。将96孔板放入37 ℃、5% CO2的恒温培养箱中孵育过夜。吸弃旧培养基,1、10、100 μg/mL吗啡组分别加入吗啡浓度为1、10、100 μg/mL的完全培养基,对照组不加药,每组设5个复孔,继续培养24 h。加入10 μL的CCK-8溶液培养1 h,在酶标仪下读取490 nm处的吸光值。细胞增殖率=给药组吸光值/对照组吸光值×100%。
1.3 细胞迁移能力观察 采用划痕实验。取对数生长期细胞,胰酶消化后制备单细胞悬液,按1×105/孔接种于6孔板,培养过夜。吸弃旧培养液,用10 μL枪头垂直于6孔板背后划痕,PBS冲洗。1、10、100 μg/mL吗啡组分别加入吗啡浓度为1、10、100 μg/mL的完全培养基,对照组不加药。即刻在显微镜下拍照,记录为0 h,继续培养24 h后取出拍照,观察划痕愈合情况,以SPSS19.0软件计算划痕面积。划痕愈合率=(0 h时划痕面积-24 h划痕面积))/0 h时划痕面积×100%。
1.4 细胞侵袭能力观察 采用Transwell小室实验。将Matrigel基质胶与无血清培养基按1∶8稀释,取50 μL包被小室底部膜的上室面,37 ℃孵育过夜。加入无血清培养基,放入温箱中水化30 min。1、10、100 μg/mL吗啡组分别加入吗啡浓度为1、10、100 μg/mL的完全培养基,对照组不加药。培养24 h后,胰酶消化细胞,用无血清培养基重悬,调整细胞密度至2.5×105/mL。每孔上室加入200 μL单细胞悬液,下室加入600 μL含10% FBS培养基,将小室放入恒温培养箱培养24 h。拭去Transwell膜上室内的细胞,甲醛固定15 min,结晶紫染色10 min。用流动的水冲洗去多余的结晶紫,晾干后,倒置显微镜下拍照。每个小室随机选取5个视野,拍照并计数细胞数量。
1.5 细胞中E-cadherin、N-cadherin、Vimentin蛋白表达检测 采用Western blotting法。取对数生长期细胞,按1×105/孔接种于6孔板。待细胞贴壁后,1、10、100 μg/mL吗啡组分别更换吗啡浓度为1、10、100 μg/mL的完全培养基,对照组更换正常培养基,继续培养24 h。取各组细胞,加入细胞裂解液提取细胞总蛋白。采用BCA法测定蛋白浓度。蛋白上样于制好的SDS-PAGE上,电泳后转移至PVDF膜。5%脱脂奶粉封闭l h,加入稀释的一抗(E-cadherin抗体1∶1 000,Vimentin抗体1∶1 000,GAPDH抗体1∶1 000),4 ℃摇床过夜。次日加入含有2%脱脂奶粉-TBST稀释的二抗(1∶5 000),室温摇床孵育1 h。TBST洗涤后,加入显影剂,凝胶成像系统中观察、拍照。以GAPDH蛋白表达作为内参,采用Image J软件分析目的条带的灰度值。
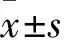
2 结果
2.1 各组细胞增殖率比较 对照组和1、10、100 μg/mL吗啡组的细胞增殖率分别为100%、87.90%±3.23%、78.36%±3.56%、41.97%±1.71%,吗啡组细胞增殖率均低于对照组,100 μg/mL吗啡组低于1、10 μg/mL吗啡组(P均<0.05)。
2.2 各组划痕愈合率比较 对照组和1、10、100 μg/mL吗啡组的划痕愈合率分别为82.27%±4.56%、66.71%±3.57%、48.10%±2.81%、30.42%±7.13%。吗啡组划痕愈合率低于对照组,100 μg/mL吗啡组低于1、10 μg/mL吗啡组(P均<0.05)。
2.3 各组穿膜细胞数比较 对照组和1、10、100 μg/mL吗啡组的穿膜细胞数分别为(83.6±3.0)、(68.4±5.6)、(43.2±5.8)、(29.0±6.7)个。吗啡组穿膜细胞数较对照组减少,100 μg/mL吗啡组少于1、10 μg/mL吗啡组(P均<0.05)。
2.4 各组细胞E-cadherin、N-cadherin、Vimentin蛋白表达比较 见表1。与对照组相比,吗啡组E-cadherin蛋白表达升高,N-cadherin、Vimentin蛋白表达降低(P均<0.05)。

表1 各组细胞E-cadherin、N-cadherin、Vimentin蛋白表达比较
注:与对照组比较,*P<0.05。
3 讨论
NSCLC患者的5年生存率仅10%~15%,肿瘤复发及转移是导致治疗失败和患者死亡的最主要原因。肿瘤细胞的迁移、侵袭能力越强,其形成转移瘤的能力就越强,所以针对肿瘤细胞的增殖、迁移、侵袭能力的研究成为目前研究的热点。关于阿片类镇痛药对肿瘤增殖、迁移和侵袭能力的影响目前尚无一致的结论。多项体外细胞实验和动物实验研究认为,吗啡可通过多种机制促进或抑制肿瘤增殖、迁移。Bimonte等[4]研究发现,单次或者低剂量应用阿片类镇痛药可促进肿瘤增殖、迁移,而长期大剂量应用阿片类镇痛药可抑制肿瘤的进展。Tegeder等[5]研究显示,当吗啡剂量大于10 μmol/L时可抑制肿瘤细胞的增殖。我们推测,导致研究结果差异性的原因可能与研究方法、给药方式、阿片类镇痛药种类、剂量以及血药浓度不同有关。本研究结果显示,1、10、100 μg/mL吗啡组细胞增殖率均低于对照组,100 μg/mL吗啡组低于1、10 μg/mL吗啡组,表明1、10、100 μg/mL吗啡均能够抑制A549细胞增殖,100 μg/mL吗啡的抑制作用最强。
侵袭和转移能力是恶性肿瘤的重要生物学特性,大多数NSCLC患者都是由于晚期肿瘤在体内进行了扩散转移而最终导致死亡,也是其放化疗效果不佳的原因之一[6]。而肿瘤的转移能力表现在其迁移力和侵袭力。本研究结果显示,吗啡组划痕愈合率和穿膜细胞数均低于对照组,100 μg/mL吗啡组低于1、10 μg/mL吗啡组,表明1、10、100 μg/mL吗啡均可抑制A549细胞的体外迁移和侵袭能力,100 μg/mL吗啡的抑制作用最强。
EMT是指上皮细胞在某些生理或病理情况下,上皮细胞极性丢失,逐渐转化为间充质细胞的生物学过程。EMT参与人体的多种生理和病理过程,如胚胎发育和器官形成、组织修复与器官纤维化、肿瘤的侵袭和转移等。EMT是肿瘤侵袭、转移过程及肿瘤产生耐药性的关键步骤,肿瘤的恶性程度直接由肿瘤细胞EMT的程度所决定[7,8]。E-cadherin是一种细胞膜黏附蛋白,对上皮细胞极性及上皮完整性的维持起关键作用[9]。生理条件下,E-cadherin蛋白可调节细胞与基质之间、细胞与细胞之间的黏附,维持细胞结构的稳定性和完整性[10]。当Ecadherin蛋白表达下调发生在恶性肿瘤细胞中时,细胞极性会完全消失,从而使肿瘤细胞获得侵袭转移的能力[11]。研究发现,NSCLC的TNM分期、恶性程度、转移性及患者预后与E-cadherin蛋白的低表达具有明显的相关性[12]。作为细胞骨架蛋白之一,Vimentin是一种特异性的表达于间质细胞的中间微丝蛋白,在上皮细胞通常不表达[13]。当肿瘤细胞中出现Vimentin蛋白的表达上调时,则提示其由上皮细胞表型转变为间质细胞表型[14]。有研究发现,Vimentin在NSCLC中的表达与肿瘤细胞的分化程度、侵袭和转移明显相关,可作为评估NSCLC患者预后的一个重要指标[15,16]。Koodie等[17]报道,吗啡可通过上调E-cadherin蛋白、下调Vimentin蛋白的表达阻止肺癌细胞EMT的发生,从而抑制肿瘤的增殖、侵袭转移。而Lennon等[2]报道,采用1、10、100 nmol/L吗啡处理非小细胞肺癌A549细胞后,吗啡通过作用于μ型阿片受体上调Vimentin蛋白的表达,促进了肿瘤的增殖、侵袭转移。本研究结果显示,1、10、100 μg/mL吗啡处理A549细胞后,能使上皮细胞标志物E-cadherin蛋白表达上调,并下调间充质细胞标志物Vimentin蛋白、N-cadherin表达水平,说明吗啡能有效抑制NSCLC的EMT相关蛋白表达。
综上所述,吗啡能够抑制A549细胞增殖、侵袭与转移,从而抑制恶性肿瘤的发生进展,其机制可能与抑制EMT有关。目前关于吗啡对肿瘤细胞生物学行为影响的研究结果仍不一致,需要更系统、科学的体外细胞实验、动物及临床研究等进一步阐明。

