白屈菜红碱对肝纤维化小鼠TGF-β/Smads信号通路的影响*
李晓明, 欧阳婷庭, 董妙先, 崔 涛, 郭丽娜, 董 巍, 王晓丽
(齐齐哈尔医学院, 黑龙江 齐齐哈尔 161006)
肝纤维化是由于肝脏对不同病因所致的慢性损害产生的创伤愈合反应,是各种慢性肝脏疾病的共同病理学基础,也是肝硬化-肝癌的必经阶段[1]。研究表明,肝纤维化以细胞外基质(extracellular matrix,ECM)过度或异常沉积及降解不足为主要特征[2]。目前经研究证实,肝纤维化经过积极治疗后是可逆的,因此,如何治疗逆转肝纤维化进而防治肝硬化-肝癌成为医药工作者的首要任务。 转化生长因子β(transforming growth factor-β,TGF-β)是目前致纤维化最强的因子之一,是促进细胞外基质过度沉积的关键因子,而Smads家族蛋白是TGF-β信号传递的关键性蛋白,且不同的Smad介导不同的TGF-β家族成员的信号转导[3-4]。白屈菜为罂粟科白屈菜属多年生草本植物白屈菜(ChelidoniummajusL.)全草,其化学成分主要有白屈菜碱(chelidonine)、白屈菜红碱(chelerythrine)和原阿片碱(protopine)等,具有抗菌、镇痛和兴奋平滑肌的作用,目前临床上主要用于治疗胃痛、肠炎、慢性支气管炎、百日咳、黄疸和疥癣疮肿等。我们前期研究表明,白屈菜对小鼠肝纤维化具有一定的逆转作用[5-6]。为进一步研究其作用及其机制,本文以四氯化碳(carbon tetrachloride,CCl4)诱导小鼠肝纤维化模型,探讨白屈菜红碱抗肝纤维化的作用及其对TGF-β/Smads信号通路的调控作用。
材 料 和 方 法
1 药物、试剂和仪器
白屈菜红碱(中国食品药品检定研究院);天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒(批号20171216)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)检测试剂盒(批号20171220)和肝组织羟脯氨酸(hydroxyproline,Hyp)检测试剂盒(批号20171229)均购自南京建成生物工程研究所;透明质酸(hyaluronic acid,HA)检测试剂盒(批号201709,武汉默沙克生物科技有限公司);Van Gieson(VG)染色试剂(批号20161121,北京索莱宝科技有限公司);细胞核蛋白与细胞浆蛋白抽提试剂盒(批号P0028,碧云天生物技术公司);PrimeScriptTMRT reagent Kit(批号BK4001)和SYBR Premix Ex TaqTMKit(批号AK2603)购自宝生物工程大连有限公司;TRIzol Reagent(批号47323,Am-bion);TGF-β1、Smad3、Smad4和Smad7引物由上海生工生物工程有限公司合成;抗GAPDH抗体(批号106M4851V)、抗Smad4抗体(批号A114739)和抗Smad7抗体(批号061M4888)购自Sigma;II 抗(批号00051405,康为世纪公司);ECL超敏发光检测试剂盒(批号PH202434,Thermo Fisher Scientific)。
CKX41型倒置显微镜(Olympus);Stratagene Mx3005P Real-time PCR仪(Agilent);S1000TMThermal Cycler(Bio-Rad);ELx800全自动酶标仪(BioTek);JY-ZY2型转移电泳槽和JY-CZ1型单垂直电泳槽(北京君意东方);HL-2000分子杂交箱(UVP);SmartChemi II一体式化学发光图像分析系统(北京赛智);5417R型离心机(Eppendorf);XPE504分析大平(Mettler Toledo)。
2 方法
2.1动物、分组及造模 SPF级C57BL/6N小鼠50只(7~8周龄),体重(35.0±2.0)g,雄性,购自南京大学-南京生物医药研究院,动物许可证号为SCXK(苏)2015-0001。实验前适应性饲养1周,造模前禁食12 h,常规饮水,室温20~25 ℃,12 h昼夜交替。小鼠随机分成5组:正常对照组、模型组和白屈菜红碱高、中、低(40 mg·kg-1·d-1、 20 mg·kg-1·d-1和 10 mg·kg-1·d-1)3个剂量组,每组各10只。除正常对照组外,其余各组均被制成四氯化碳橄榄油溶液诱导的肝纤维化-肝癌模型,造模方法按参考文献[7]方法并加以改进,首次以四氯化碳3 mL/kg腹腔注射,以后以 50%四氯化碳-橄榄油 3 mL/kg 体重腹腔注射,1周2次,共8周。白屈菜红碱3个剂量组于造模后第5周开始分别每天灌胃给药,直至第14周,其余组给予溶媒灌胃。
2.2样品的采集与处理 第14周实验结束,小鼠禁食不禁水1 d,称量体重后麻醉取血,收集血清,备用;摘取并称量肝脏,于冰上取右肝叶一小块肝组织,用4%甲醛溶液固定24 h,用于病理学检查;肝右叶其余部分,留存备用;将肝左叶液氮速冻后,-80 ℃冰箱冻存,待提取组织进行RT-qPCR和Western blot 检测。计算肝脏指数,肝脏指数(%)=肝脏重量/小鼠体重×100%。
2.3血清中AST、ALT和HA含量检测 取备用血清,按试剂盒要求,检测血清中AST、ALT和HA含量。
2.4肝组织羟脯氨酸含量的测定 取留存的部分肝叶,参照文献处理方法[8],按试剂盒要求,检测肝组织中Hyp含量。
2.5肝组织HE和VG染色观察 取经甲醛溶液固定的小鼠肝组织,石蜡包埋,切片,二甲苯、多级乙醇脱蜡至水,分别用苏木精-伊红染色(hematoxylin-eosin,HE)法和苦味酸-酸性品红(VG)法对肝组织切片进行染色,并于显微镜下观察小鼠肝组织的病理改变及肝纤维化的程度。
2.6RT-qPCR实验检测肝组织TGF-β1、Smad3、Smad4和Smad7的mRNA表达 取冻存肝组织,至室温,用TRIzol试剂提取总RNA,按ExscriptTMRT reagent Kit说明书操作,逆转录合成cDNA。按照PCR Amplification Kit说明书进行PCR反应。TGF-β1的上游引物序列为5’-GTGTGGAGCAACATGTGGAACTCTA-3’, 下游引物序列为5’-TTGGTTCAGCCACTGCCGTA-3’;Smad3的上游引物序列为5’-GTCAACAAGTGGTGGCGTGTG-3’,下游引物序列为5’-GCAGCAAAAGGCTTCTGGGATAA-3’;Smad4的上游引物序列为5’-TTGCTTGGGTCAACTCTCCA-3’,下游引物序列为5’-TCACCTTCACCTTTACATTTCCAAC-3’;Smad7的上游引物序列为5’-GTCCAGATGCTGTACCTTCCTC-3’,下游引物序列为5’-GCGAGTCTTCTCCTCCCAGTAT-3’;β-actin的上游引物序列为5’-GGCCAACCGTGAAAAGATGA-3’,下游引物序列为5’-CAGCCTGGATGGCTACGTACA-3’。数据分析用2-ΔΔCt法。
2.7Western blot 检测肝组织中TGF-β1、Smad4和Smad7的蛋白表达 取冻存肝组织,至室温,用组织蛋白裂解液提取组织总蛋白,加入上样缓冲液,SDS-PAGE法进行蛋白分离,电转移至硝酸纤维素膜上,用含5%脱脂奶粉的TBST溶液4 ℃封闭过夜。与抗TGF-β1、Smad4、Smad7和GAPGH多克隆抗体于25 ℃孵育4 h,生物素标记的Ⅱ抗孵育2 h。最后加入Western blot荧光检测试剂激发荧光,于一体式化学发光图像分析系统扫描、分析各蛋白质条带的积分光密度。结果表示为与对照组的相对吸光度。
3 统计学处理
采用SPSS 13.0软件进行统计分析。实验数据以均数±标准差(mean±SD)表示,多组间差异的显著性分析采用单因素方差分析,各组均数间的两两比较用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 小鼠肝脏指数及血清AST、ALT和HA含量检测结果
如表1所示,与正常对照组比较,模型组的肝脏指数、AST、ALT和HA含量明显增加;与模型组比较,白屈菜红碱组的肝脏指数、AST、ALT和HA含量明显降低(P<0.05)。
2 肝组织羟脯氨酸含量检测结果
与正常对照组比较,模型组Hyp含量明显增加;与模型组比较,白屈菜红碱组的Hyp含量明显降低(P<0.05),见表1。
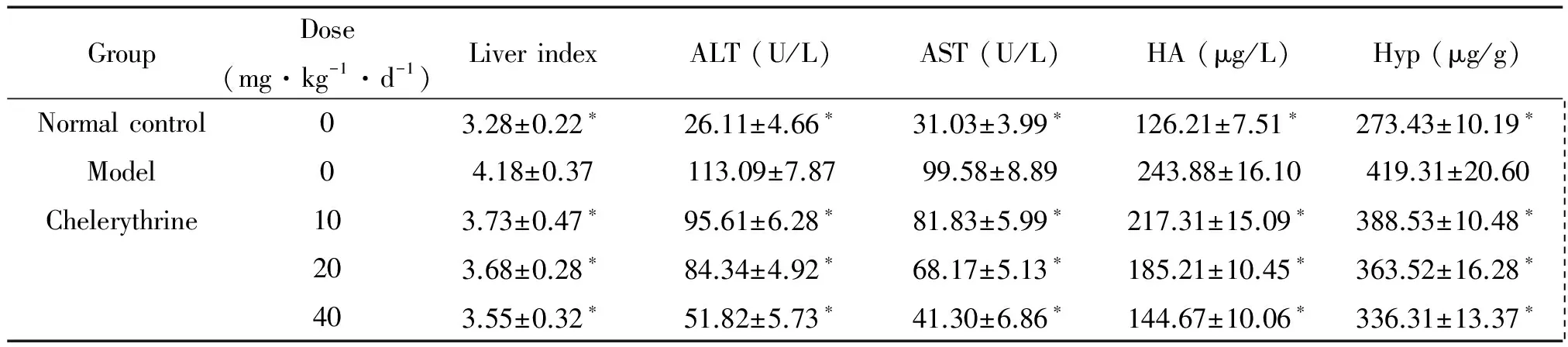
表1 各组小鼠肝脏指数,血清AST、ALT和HA及肝组织Hyp含量的测定
*P<0.05vsmodel group.
3 肝组织HE和VG染色
HE染色结果显示,正常组小鼠肝细胞结构正常;模型组小鼠肝细胞不同程度的水肿、脂肪样病变及炎症细胞浸润,并可见明显的纤维隔形成;白屈菜红碱各剂量组,随白屈菜红碱给药剂量增加,小鼠肝脏组织结构损伤随之改善,肝细胞的水肿程度、脂肪样病变及炎症细胞浸润程度明显减少,白屈菜红碱高剂量组未见纤维隔形成,见图1。
小鼠肝组织中纤维蛋白经VG染色显示为红色。正常组小鼠肝脏肝小叶结构正常,汇管区及中央静脉周围几乎无纤维增生;模型组小鼠肝小叶结构破坏,肝索排列紊乱,肝脏汇管区及周围纤维结缔组织增生明显;白屈菜红碱各剂量组小鼠肝脏组织结构损伤改善明显,纤维沉积、汇管区或中央静脉间纤维间隔较模型组小鼠明显变薄,结缔组织增生明显减少,见图1。

Figure 1. Liver tissues with hematoxylin-eosin (HE) staining and Van Gieson staining (×200).
图1各组小鼠肝组织HE和VG染色
4 肝组织中TGF-β1、Smad3、Smad4和Smad7的mRNA表达
如表2所示,与正常对照组比较,模型组中TGF-β1、Smad3和Smad4的mRNA 表达明显上调,Smad7的mRNA表达均明显下调;与模型组比较,白屈菜红碱组TGF-β1、Smad3和Smad4的mRNA 表达明显下调,Smad7的mRNA 表达明显上调(P<0.05)。
5 肝组织中TGF-β1、Smad4 和Smad7蛋白表达
与正常对照组比较,模型组小鼠肝组织中TGF-β1和Smad4的蛋白表达显著增加,Smad7的蛋白表达显著下调(P<0.05);与模型组相比,白屈菜红碱组小鼠肝组织中TGF-β1和Smad4的蛋白表达显著降低,Smad7的蛋白表达显著上调(P<0.05),见图2。

Figure 2. The effect of chelerythrine on the protein expression of TGF-β1, Smad4 and Smad7 in the liver tissues. Mean±SD.n=3.*P<0.05vsmodel group.
图2白屈菜红碱对TGF-β1、Smad4和Smad7蛋白表达的影响

表2 各组小鼠肝脏TGF-β1、Smad3、Smad4和Smad7的mRNA表达
*P<0.05vsmodel group.
讨 论
肝纤维化是机体对慢性肝损伤炎症刺激的一种修复反应。腹腔注射CCl4混合溶液诱导的肝纤维化损伤模型是最常用的肝纤维化模型[9]。CCl4在内质网中逐渐代谢生成活泼的三氯甲基自由基和氯自由基,使肝细胞变性坏死,肝内脂质细胞膜发生溶解,细胞内大量肝内酶(AST和ALT等)渗出进入血液,其渗出含量在一定程度上反映肝脏受损程度,而长期的CCl4刺激可诱发纤维化损伤。
AST和ALT是肝细胞浆内比较多的活性酶,是评价肝功能的主要指标[10],肝细胞膜轻度损伤就可使血液中的AST和ALT含量显著升高。HA是细胞外基质中糖胺聚糖的主要成分,可维持内环境的稳定及肝细胞的结构和功能,在肝纤维化发生时血中HA含量即显著升高。检测血清HA,可反映肝纤维化的程度。肝脏纤维化时可见大量的胶原蛋白生成和沉积,Hyp是胶原蛋白特有的氨基酸,其含量变化可反映出细胞合成和分泌胶原蛋白的功能,客观地反映肝纤维化程度[11]。因此本研究选择以检测AST、ALT、HA和Hyp含量观察CCl4溶液对小鼠肝纤维化损伤程度。
本研究发现模型组小鼠肝脏指数,血清中AST、ALT和HA水平及肝组织Hyp含量较正常对照组均显著增加,病理学检测镜下观察到肝内纤维组织增生明显,说明模型组小鼠肝损伤严重,本研究利用CCl4混合溶液诱导的肝纤维化损伤模型复制成功。而灌胃不同剂量的白屈菜红碱后,小鼠肝脏指数,血清中AST、ALT和HA水平及肝组织Hyp含量较模型组均显著降低,病理学检测可观察到肝内增生的纤维组织改善明显,说明白屈菜红碱对利用CCl4诱导的小鼠肝纤维化损伤具有保护作用。
肝纤维化是一个复杂的过程,TGF-β/Smads信号通路是肝纤维化主要的信息转导途径,在其发生发展中起着重要的作用[12]。TGF-β是目前被认为最强的致纤维化的因子之一,它可以影响ECM的生成,促进胶原蛋白合成,通过抑制基质降解酶的活性而抑制ECM正常的降解,导致ECM过度沉积[13]。Smads蛋白是目前所知的唯一TGF-β受体的胞内激酶底物,是TGF-β跨细胞膜传入细胞核的关键蛋白[14-15]。
肝纤维化发生时,TGF-β作为配体与受体形成的复合物磷酸化,激活Smad2和Smad3,再与胞浆内的Smad4形成复合物由胞浆传导至胞核内,从而与特定DNA序列结合,调控特异性靶基因特别是ECM等目的基因的转录并高表达,形成HF[16-18]。Smad7是TGF-β/Smads信号转导通路的负调节因子,它可以抑制Smad2/3介导的基因表达,与Smad4竞争性地结合磷酸化的受体,形成无活性的复合物,阻碍TGF-β信号向下游传导,从而抑制ECM的沉积[19-20]。因此,Smads家族蛋白是TGF-β信号传递的关键性蛋白,是TGF-β介导的转录反应的重要节点,Smad3、Smad4和Smad7为其关键信号分子,通过调控Smad 3、Smad4和Smad7蛋白可以阻断TGF-β信号的继续传导。
本研究发现,不同剂量白屈菜红碱可显著影响TGF-β1、Smad3和Smad4的mRNA以及负调节因子Smad7的mRNA的表达,提示白屈菜红碱对TGF-β受体复合物由胞浆传导至胞核的信号传导有阻断作用。Western blot实验结果显示,白屈菜红碱对TGF-β1、Smad4以及Smad7蛋白表达的干预作用,进一步验证白屈菜红碱对小鼠肝纤维化有一定的抑制作用,且与TGF-β/Smads信号通路有关。

