干燥综合征腺体外损害的治疗进展
李奔,薛鸾
原发性干燥综合征(primary Sjogren’s syndrome,pSS)是一种主要累及外分泌腺体的慢性系统性自身免疫病。除累及涎腺和泪腺导致口干眼干外,还可累及腺体外其他器官而出现多系统损害。迄今为止,国内外对pSS尚无肯定有效的全身治疗药物,对于仅有干燥症状的患者,主要是采取改善环境湿度、人工泪液等局部替代治疗以及毛果芸香碱、西维美林等促分泌治疗;对于有腺体外损害的患者,目前常用药物仍是糖皮质激素和免疫抑制剂,严重者可选择静脉注射丙种球蛋白、生物制剂、血浆置换等,治疗药物的选择主要根据疾病的累及部位、活动度和严重程度而定。本文重点归纳了干燥综合征(SS)腺体外损害的治疗进展,希望可以对干燥综合征的临床治疗有所帮助。
1 糖皮质激素和免疫抑制剂的应用
1.1 皮肤病变 环形红斑可影响约10%的pSS患者,糖皮质激素可作为局部治疗的主要药物[1],随着病情的加重出现广泛难治的病变时,可全身用药。一项58例的随机对照试验(RCT)支持羟氯喹作为首选药物[2]。一项非随机、无对照临床研究认为甲氨蝶呤可作为治疗环形红斑的二线药物[3]。此外根据病情可选择糖皮质激素、硫唑嘌呤、霉酚酸酯等[1]。当pSS患者皮肤出现紫癜、溃疡、荨麻疹、甲周梗塞、微梗死等血管炎表现,特别是伴有内脏血管炎时,提示预后不良,此时应全身使用糖皮质激素,必要时可进行冲击治疗,或联合其他免疫抑制药物[1]。
1.2 肌肉骨骼 肌肉骨骼症状主要包括非侵蚀性关节炎/关节痛和肌痛/肌炎。在早期的回顾性和开放性研究中,羟氯喹被证实对pSS的关节痛有效[4],但这一点在近期一个以干燥症状缓解为主要终点的RCT研究中却未被证实[5]。基于类风湿关节炎和系统性红斑狼疮的治疗经验,甲氨喋呤和来氟米特以及低剂量糖皮质激素也可用于治疗pSS的关节症状。当pSS伴有肌炎时,尽管目前没有相关的RCT研究支持,糖皮质激素仍应作为主要的一线治疗药物,并根据肌炎的严重程度选择口服或是静脉冲击治疗,其中高疾病活动者应同时给予免疫抑制剂以增强疗效、帮助撤减糖皮质激素[1]。在免疫抑制剂的使用方面,可首先考虑甲氨蝶呤[6],当甲氨蝶呤治疗失败时,可选择硫唑嘌呤、霉酚酸酯、他克莫司以及环孢素等。针对炎性肌肉骨骼痛的治疗,2016年干燥综合征基金会临床实践指南委员会给出了推荐(图1)[7]。
1.3 呼吸系统 间质性肺病(ILD)是pSS患者呼吸系统最常见的受累表现,该类患者若肺组织受累面积<10%、一氧化碳弥散量>65%、无呼吸道症状,并不需要立即治疗,患者可每半年随访1次胸部CT评估病情。对于症状更严重的患者,可口服或静脉注射中等剂量糖皮质激素联合免疫抑制剂治疗。免疫抑制剂主要选用环磷酰胺,此外,基于临床经验也可选用霉酚酸酯、硫唑嘌呤和环孢素等。
pSS并发肺动脉高压(PAH)虽然不如ILD常见,但易导致心功能下降,严重者预后差。针对pSS原发病的治疗可能对改善和稳定pSS相关PAH病情有帮助[8],但证据尚不充足。临床上免疫抑制的治疗方案多借鉴系统性红斑狼疮相关PAH的经验来选择糖皮质激素及环磷酰胺、霉酚酸酯、硫唑嘌呤、甲氨喋呤等药物[9]。

Fig.1 Recommendations for the treatment of inflammatory musculoskeletal pain in Sjogren’s syndrome图1 干燥综合征炎性肌肉骨骼痛的治疗推荐
1.4 泌尿系统 间质性肾炎是pSS患者肾活检中最常见的病理表现,其中远端肾小管较近端肾小管更易累及,约占所有pSS间质性肾炎的92%[10]。而肾小球肾炎相对少见。到目前为止,pSS肾受累的治疗既不规范,也没有指南及RCT研究证据支持。然而鉴于自身免疫反应在发病机制中的作用,糖皮质激素和免疫抑制剂可作为治疗选择。一项小型研究显示霉酚酸酯对pSS患者血清肌酐及肾小球滤过率有显著改善作用[11]。环磷酰胺也在一些小的病例报告中被证实有效[12],但因间质性肾炎随病程进展,肾功能损害并不明显,且考虑环磷酰胺的不良反应,故已不被建议用于间质性肾炎[1,9]。而无论是环磷酰胺、硫唑嘌呤或霉酚酸酯均可用于膜增生性肾小球肾炎的维持治疗[13]。环孢素、他克莫司等被证实对pSS间质性膀胱炎有较好疗效[14-15]。
1.5 神经系统 对于pSS相关神经系统疾病,目前没有RCT研究对其治疗方法的有效性进行评估。根据临床经验,无论是周围神经系统病变还是中枢神经系统病变,在病情活动和进展时,都应给予糖皮质激素治疗,必要时联合免疫抑制剂。免疫抑制剂中环磷酰胺最常用[16],霉酚酸酯、硫唑嘌呤、甲氨喋呤等可用于维持治疗[17]。对于急性发作、病情凶险的中枢神经系统病变患者,可予糖皮质激素和免疫抑制剂冲击治疗。
1.6 消化系统 pSS肝脏受累在临床中非常普遍,常合并原发性胆汁性肝硬化(PBC)等自身免疫性肝病。多数pSS自身免疫损害导致的肝损伤患者早期对激素及免疫抑制剂敏感。PBC首选的治疗药物是熊去氧胆酸[18],当遇到难治性PBC时,可联合使用甲氨喋呤[19]等其他药物,但目前尚缺乏pSS合并PBC使用熊去氧胆酸的临床研究[9]。pSS合并自身免疫性肝炎时应予激素联合硫唑嘌呤治疗。
1.7 血液系统 pSS可引起自身免疫性血细胞减少,如程度较重可予中、高剂量糖皮质激素联合免疫抑制剂和/或达那唑治疗,严重的活动性患者应给予糖皮质激素冲击治疗。
2 生物制剂的应用
虽然生物制剂在类风湿关节炎、脊柱关节炎等风湿病治疗中的疗效已得到证实,但其在pSS中的作用仍不明了。一项10 414例患者的大规模调查研究发现,在pSS患者中,生物制剂的使用多是针对其并发的其他自身免疫性疾病,而针对性治疗pSS时,生物制剂仍然使用较少[20]。总结近年的研究,对pSS腺体外系统累及的生物制剂的使用多集中在rituximab,其他部分生物制剂如epratuzumab、belimumab等的使用正在研究中。
2.1 Rituximab 临床一系列小样本、开放性、回顾性研究和病例报告表明,rituximab可以在部分严重的pSS患者中使用,对腺体外表现,如肾脏受累、血液系统受累、血管炎等有一定的改善作用,特别是在常规治疗无效时建议使用[21-23]。如当患者合并严重肌炎,建议rituximab单独或联合糖皮质激素及免疫抑制剂使用[24]。一项200例患者的随机双盲对照研究证实了rituximab可改善难治性肌炎患者的肌力及肌酸激酶水平[25]。pSS相关性肾炎病情进展迅速时,亦可考虑使用rituximab,特别是基于狼疮肾炎的疗效和经验证据,rituximab可用于增生性病变患者[26]。感觉神经节神经元或感觉性共济失调神经病变等严重的神经系统受累往往也难以治疗,rituximab在多项研究中被证明应用前景广阔[27-29],甚至可以作为视神经脊髓炎的一线治疗药物[30]。此外,对于pSS并发难治性血小板减少、血栓性血小板减少性紫癜、pSS相关冷球蛋白血症出现全身症状者也可考虑选择rituximab[31]。法国一项注册研究分析显示,69%的pSS患者使用rituximab后系统症状可得到改善,同时有利于激素的撤减[32]。但在一项120例患者的多中心、随机、双盲、安慰剂对照研究中却未发现rituximab在治疗pSS中的优势超过其他免疫抑制剂,且结果显示其疗效有限[30]。同时,rituximab因不能改变pSS患者唾液腺中免疫球蛋白产生细胞的克隆性扩增,故停止治疗后病情易复发,降低了其临床使用价值。
尽管rituximab所致的严重损害罕见,但对于使用rituximab的pSS患者,仍应密切观察有无以下情况:输液反应;进行性多灶性白质脑病;乙型肝炎再激活乃至可能的爆发性肝炎;严重的黏膜皮肤反应;感染;肠梗阻和穿孔;心律失常、心绞痛;血细胞减少;严重的细菌、病毒或真菌感染;在怀孕及哺乳期间,必须仔细衡量风险及益处;医生应该避免对使用rituximab的患者使用活疫苗[29]。
2.2 其他生物制剂 除rituximab,其他类型生物制剂也被用于pSS腺体外系统受累患者的治疗,部分生物制剂被证实对受累系统或疾病活动度等存在影响,也有部分生物制剂已被证实不适合用于pSS腺体外损害,还有一些潜在的生物制剂对pSS的作用有待发掘(表1)。
3 其他治疗
3.1 静脉注射丙种球蛋白 pSS合并肌炎、慢性炎性脱髓鞘多神经病[47]以及自身免疫性血细胞减少等病情较重时,可考虑静脉注射丙种球蛋白,通常为0.4 g/(kg·d),连用3~5 d,必要时可重复使用。
3.2 血浆置换 pSS患者病情危重、难治,并存在大量自身抗体时,可考虑联合使用血浆置换。如膜增生性肾小球肾炎、重症混合型冷球蛋白血症相关性血管炎、感觉神经节神经元或感觉性共济失调神经病变、中枢神经系统病变以及血栓性血小板减少性紫癜等。
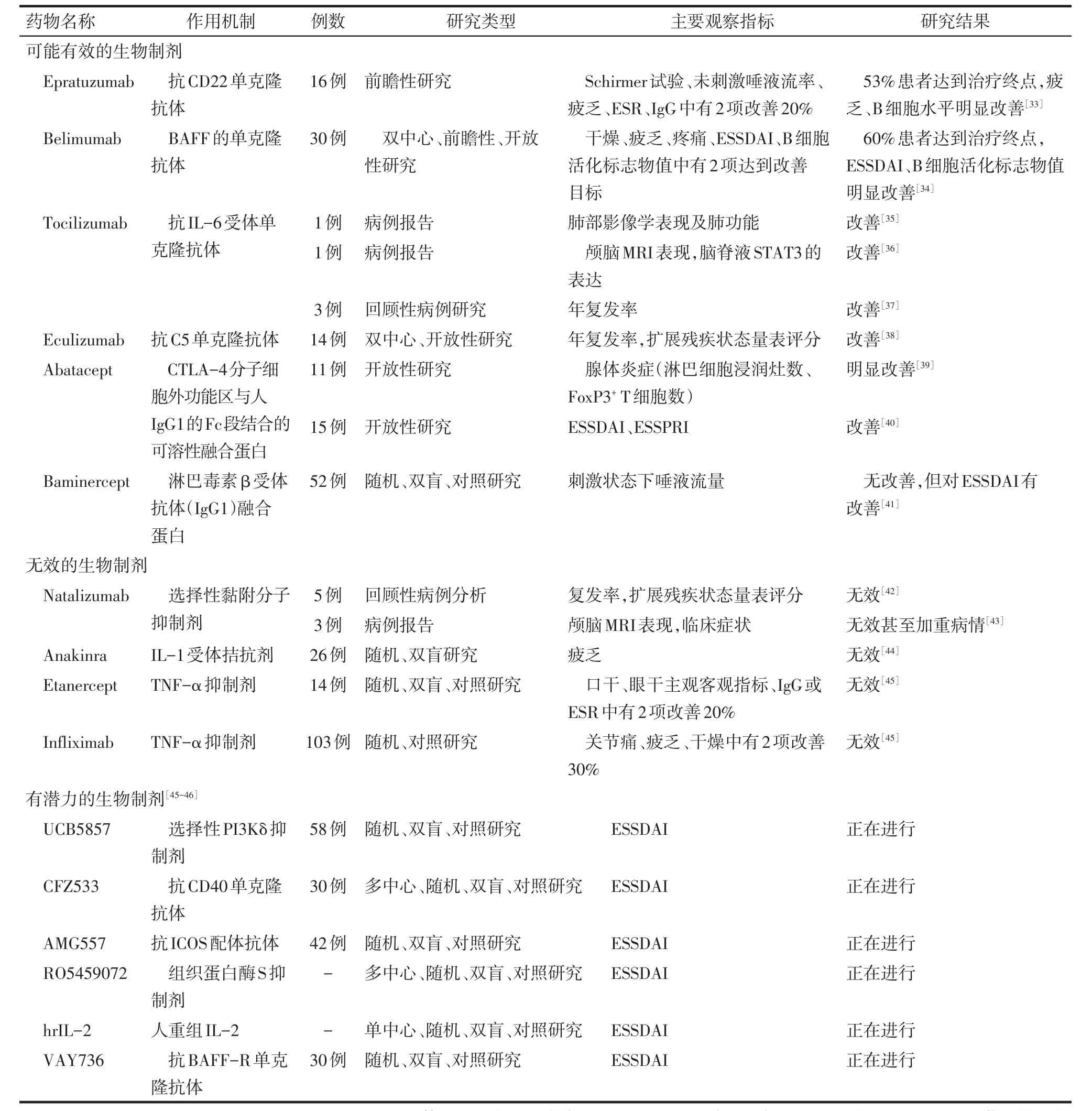
Tab.1 The application of biological medications in extraglandular damage of Sjogren syndrome表1 其他生物制剂在干燥综合征腺体外损害中的应用
4 小结与展望
pSS腺体外系统受累患者大多经治疗后可缓解,预后较好。少数威胁生命的病变主要是治疗效果欠佳的血管炎或冷球蛋白血症、进展性肺纤维化、中枢神经系统受累以及神经节神经疾病等。目前对这些危重患者的治疗方案选择主要根据开放标签的临床研究、病例报告,类似疾病(血管炎和系统性红斑狼疮等)和专家意见提供的数据。治疗主要包括免疫抑制剂、高剂量糖皮质激素,在更加严重的情况下还应使用激素、环磷酰胺冲击治疗,必要时联合使用静注人免疫球蛋白或血浆置换、生物制剂等。
分析pSS全身治疗缺乏疗效的原因时发现,除了药物本身可能疗效欠佳的因素外,研究所采用的分类标准、应答及达标标准不一致以及入选标准合适度欠佳等均应考虑在内。针对这些问题,如果日后临床研究在考虑将分类标准和患者选择标准更加一致化的基础上,根据不同的治疗目的采用不同的观察终点,如针对腺体症状的治疗终点选择腺体大小、质地和组织病理学改变为目标,针对腺体外表现采用EULAR干燥综合征疾病活动度指数(ESSDAI)进行评估等,则会使研究药物的有效性和安全性结果更加具有说服力。随着pSS免疫病理机制的不断明了,治疗新靶点会不断呈现,这使得将来可以针对患者疾病所涉及的具体机制选择个体化靶向治疗,从而实现真正的精准医疗。

