三例典型无功能胰腺神经内分泌瘤诊疗分析
牛连杰 ,张雅敏
胰腺神经内分泌肿瘤(pancreatic neuroendo⁃crine tumors,PNETs)是一种较少见的肿瘤,常见于中老年人,发病率为1/10万,约占原发性胰腺肿瘤的3%,且易发生早期远处转移[1]。无功能胰腺神经内分泌瘤(NF-PNETs)可发生在任何年龄段,30~60岁是其发病年龄高峰。发病部位多位于胰头部(约50%),也可见于胰体、胰尾部。世界卫生组织(WHO)2010年分级系统根据核分裂象和细胞增殖指数Ki-67将PNETs分为G1、G2、G3级。本文3例均经病理及免疫组化确诊且分别为G1、G2、G3级,报告如下。
1 病例报告
例1 男,75岁。主因右上腹间断疼痛1个月余,于2012年7月10日入住天津市第一中心医院肝胆外科。患者于1个月前无明显诱因出现右上腹疼痛,与体位无关,无腹胀、腹泻,无恶心、呕吐,无便血、黑便,近1年体质量减轻7 kg。患者既往体健。查体:巩膜黄染,右上腹可触及韧性包块,不可移动,腹部微膨隆,左肋下可触及肝缘,质硬。实验室检查:糖蛋白抗原199(CA199)272.3 kU/L,甲胎蛋白(AFP)719 kU/L,碱性磷酸酶(ALP)898.2 U/L。CT提示胰头区胆总管下端探及低回声团,大小约11.2 cm×10.3 cm×9.0 cm,边界模糊,形态不规则,肝上见多发低回声团,边界规则,最大为5.0 cm×4.2 cm×3.8 cm,初步诊断:胰腺恶性肿瘤,胰腺恶性肿瘤肝转移?患者于2012年7月19日行剖腹探查术,开腹发现肿瘤已无法全部切除,遂行减瘤手术。患者送检物切面呈实性,灰白色,质韧。免疫组化:Ki-67阳性细胞增殖指数约为47%(图1A1)、突触素(Syn)、嗜铬颗粒蛋白A(CgA)、CD56、CK、神经元特异化烯醇化酶(NSE)阳性、细胞角蛋白7(CK7)大灶性阳性。病理诊断(图2A1):(胰腺)神经内分泌瘤(NET G3),核分裂象密集处约35个/10 HPF(每10个高倍镜视野内35个),侵犯神经,间质脉管内可见瘤栓。术后患者一般情况较差,予营养支持等对症治疗。患者自入院起84 d后在院内死于肝肾功能衰竭。
例2 女,55岁。主因上腹疼痛伴消瘦半年,于2011年7月6日收入天津市第一中心医院肝胆外科。患者于半年前无明显诱因出现上腹部疼痛,与体位无关,伴纳差,无腹胀、腹泻,无恶心、呕吐,无反酸、烧心,无便血、黑便,近半年体质量减轻10 kg。患者既往高血压病史3年,最高达170/95 mmHg(1 mmHg=0.133 kPa),目前口服氨氯地平降压,血压控制可。查体:上腹部压痛。实验室检查:CA199 28.59 kU/L、ALP 598.5 U/L。CT:胰头区胆总管下端探及低回声团,大小约为4.1 cm×4.1 cm×3.6 cm,边界清,形态不规则,彩色多普勒超声(CDFI):内探及星点血流信号。初步诊断:胰头恶性肿物;高血压。患者于2011年7月26日行胰十二指肠切除术,术中完整切除胆总管、胃的3/5、胰头(居肿瘤边缘2 cm)及屈氏韧带下端约10 cm小肠,加淋巴结清扫。送检组织1个,胰头部见一肿物,大小约4 cm×3.5 cm×3.3 cm,切面灰白色,实性,质中。免疫组化:Ki-67阳性细胞增殖指数约为18%(图1A2)、Syn、CgA、NSE阳性、CK7小灶性阳性。病理诊断(图2A2):(胰腺)壶腹周围神经内分泌瘤(NET G2),核分裂象密集处约6个/10 HPF,侵犯神经,间质脉管内可见瘤栓;胃断端、小肠断端、胆总管断端及胰腺断端均阴性。患者自手术后10 d出院,随访至今已80个月,复查未见复发。
例3 女,61岁。主因发现胰尾部占位性病变1周,于2017年1月21日入院。患者于1周前体检时发现胰尾部占位性病变,无腹痛、腹胀、腹泻,无恶心、呕吐,无反酸、烧心,无便血、黑便,体质量无明显减轻。为明确占位性质就诊。患者既往高血压5年,最高达180/95 mmHg,平素口服硝苯地平缓释片控制血压,血压控制可。查体:腹部平坦,无压痛及反跳痛。实验室检查:CA199 18.59 kU/L、ALP 82.4 U/L。CT:胰尾囊性结节,考虑良性囊腺瘤?周围淋巴结未见异常。初步诊断:胰腺囊腺瘤;高血压。患者于2017年1月29日行腹腔镜下胰尾部切除术,切除范围距肿物边缘2 cm。送检组织1个,胰尾部见一肿物,大小2.8 cm×2.0 cm×2.0 cm,灰粉囊肿,内外壁光滑,厚0.2~0.6 cm。免疫组化:Ki-67阳性细胞增殖指数小于2%(图1A3),Syn、CgA、CK19、NSE阳性。病理诊断(图2A3):(胰腺囊肿)胰腺神经内分泌瘤(NET G1);未见明显坏死及核分裂象。例3手术后6 d出院,随访至今复查未见复发。
2 讨论
NF-PNETs早期缺乏典型的临床表现,上腹部隐痛多见,也可为钝痛或胀痛,疼痛可向腰背部放射,其他比较常见的症状有纳差、消瘦、黄疸等。50%~75%的NF-PNETs会发生转移而出现转移灶的症状,患者的生存质量与是否发生转移及转移的程度密切相关,常见转移部位依次为胰腺周围淋巴结、肝脏,脾脏、骨骼、肺脏、乳腺[2]。因临床表现不具有特异性,NF-PNETs易被误诊为胰腺炎、早期胰腺癌、胰腺良性肿瘤等疾病,而晚期患者往往伴有腹痛、腹泻和晚期远处转移,易确诊,但患者预后不良[3]。我院收治的3例患者术前影像和相关实验室检查均未给出PNETs的明确诊断。
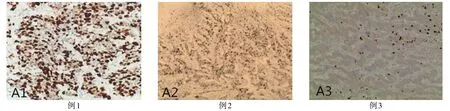
Fig.1 Non-functional pancreatic neuroendocrine tumors under microscope(IHC,×100)图1 无功能性胰腺神经内分泌瘤免疫组化镜下表现(IHC,×100)

Fig.2 Non-functional pancreatic neuroendocrine tumors under microscope(HE,×100)图2 无功能性胰腺神经内分泌瘤病理镜下表现(HE,×100)
目前常规的影像学检查的敏感度,特异度及检出率与以前相比有明显提高。超声引导下细针穿刺(EUS-FNA)可为术前提供病理诊断,近年来已经成为诊断PNETs的重要方法[4]。考虑到胰腺癌种植转移,目前该检查尚未在我院做临床推广,故文中3例患者均未做该检查。除此之外还可以进行的检查:经皮经肝穿刺脾静脉分段取血、动脉造影[5]。但所有的影像学检查方法只能帮助肿瘤定位,无法提供肿瘤预后信息。文中3例患者的影像学检查均未给出明确疾病诊断。目前临床上,病理及免疫组化检查是诊断神经内分泌肿瘤的金标准。现在应用最广泛也最特异的免疫组化神经内分泌标志物有Syn、CgA。Syn敏感性高,CgA特异性强,两者搭配,可准确诊断几乎所有的PNETs[6]。WHO 2010年分级系统中,PNETs根据病理核分裂象和细胞增殖指数Ki-67可分为G1、G2、G3级,且分级越高,恶性度越高,预后越差[7]。无功能神经内分泌瘤早期患者(G1、G2期)较晚期患者(G3期)有较高的生存率和生活质量[8]。Strosberg等[9]报道的146例PNETs患者中生存时间超过103个月者占75%,国内要文青等[10]报道的PNETs患者5年无进展生存率为91.4%;发生转移的PNETs患者5年无进展生存率为60%。本文中例1分级为G3级,患者病情发现较晚且多发脏器转移,行减瘤手术后患者预后不佳,最终死于多脏器功能衰竭。例2分级为G2级,发现较早,手术治疗至今80个月患者健康状况良好,复查未见复发。例3因体检发现该病,肿瘤体积小、无侵润及转移,手术后预后良好,随访至今未复发。
手术是NF-PNETs的主要治疗手段,也是目前唯一可能治愈NF-PNETs的方法。小于2 cm的NFPNETs可考虑行肿瘤摘除术或局部切除术。大于2 cm或有恶性倾向的PNETs,无论是否有功能,均建议手术切除,必要时可切除相邻器官和清扫区域淋巴结[11]。偶然发现的≤2 cm的NF-PNETs,是否手术切除尚有争议,应根据肿瘤的位置、手术创伤的程度、患者年龄、身体状况和患者从手术中的获益,衡量利弊做出选择[5]。目前认为进展期或有远期转移的NF-PNETs的减瘤手术或姑息原发灶切除不能延长患者的生存时间,但对于仅存在不可切除的肝转移灶,原发灶切除可能有利于对肝转移灶的处理。综合以上研究,NF-PNETs患者符合手术指征的应积极手术治疗,对于肿瘤不能完全切除的患者,也应积极综合治疗。

