人源化动物模型在肿瘤免疫治疗药物临床前研究中的应用
宋 征,马 璟
(中国医药工业研究总院,国家上海新药安全评价研究中心,上海益诺思生物技术有限公司,上海 201203)
肿瘤免疫治疗是通过激活自体免疫系统实现抗肿瘤作用的一种治疗方式,其应用已有较长的历史,最早可追溯到19世纪末外科医生W illiam COLEY用活细菌治疗肿瘤患者,以延长其生存时间。近年来,药物研发人员及医药公司在肿瘤免疫治疗药物的研发上投注了巨大的精力和财力,大力推进了肿瘤免疫治疗的发展。美国FDA于2011年首次批准免疫检查点抑制剂抗人细胞毒T淋巴细胞相关抗原4(cytotoxic T-lym phocyte-associated antigen-4,CTLA-4)的抗体Yervoy上市,用于治疗黑素瘤;2014年又批准了2个治疗黑素瘤等实体瘤的程序性死亡受体1(programmed death-1,PD-1)nivolumab(商品名Opdivo)和pembrolizumab(商品名Keytruda)上市;在2017年批准了诺华及Kite公司2个嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy,CAR-T疗法)上市,揭开了肿瘤免疫治疗的新篇章。
在临床应用过程中发现,不同患者对于肿瘤免疫治疗的效果差异较大。越来越多的证据表明,由于肿瘤微环境的异质性造成了不同个体的抗肿瘤免疫应答反应不尽相同[1-2]。肿瘤的微环境是由肿瘤细胞及肿瘤周围的浸润免疫细胞、新生血管及内皮细胞、肿瘤相关成纤维细胞(cancer associated fibroblast,CAF)和细胞外基质等共同构成[3-4]。随着肿瘤细胞的增殖,肿瘤细胞、基质成分和免疫细胞在微环境中相互影响,肿瘤细胞利用机体免疫系统的负调控作用,在肿瘤微环境中建立全方位免疫抑制状态,对抗机体抗肿瘤免疫作用,为肿瘤细胞的生存和发展创造条件,并最终促进肿瘤免疫逃逸。
经典的免疫缺陷动物肿瘤模型(如免疫缺陷小鼠肿瘤移植模型和致癌物诱导的免疫小鼠肿瘤模型)在前期化学抗肿瘤药物研发中发挥了重要的作用,可用于体内药效学评价、组织分布研究以及动物对侯选化合物的整体耐受性评价。且适用于多个肿瘤细胞系,常应用于早期药物研发中的体内药效筛选。上述免疫缺陷动物肿瘤模型在肿瘤免疫治疗药物的研发过程中出现了一些限制及缺陷,如①以上模型往往使用体外连续传代培养的肿瘤细胞株进行移植,由于肿瘤细胞株在体外培养环境中缺乏肿瘤微环境,丢失了原代肿瘤的特性以及生长特性,因此不能客观地反映原代肿瘤的情况[5-8];②移植方法往往为局部皮下注射,局部注射大量的肿瘤细胞可能导致局部的炎症反应,也可能限制了肿瘤的微环境;③在局部死亡的肿瘤细胞产生了类似疫苗的作用,也可能影响肿瘤免疫药物药效的评价[9-10];④免疫缺陷小鼠肿瘤模型提供了大量关于肿瘤生物学的信息,但由于宿主动物为免疫缺陷动物,因此无法单独评价以免疫系统为靶点的肿瘤免疫药物。
由此可见,肿瘤微环境对于肿瘤免疫药物的评价非常重要。肿瘤微环境是一种非常复杂的、动态变化的环境,理想的动物模型应尽可能模拟人体内肿瘤微环境,合适的动物模型有助于免疫肿瘤药物在临床前阶段安全性、有效性的评价中获得更有价值的数据,具有更高的临床预测性。近年来,由于基因编辑技术及干细胞培养技术的不断进步,实验动物的人源化技术取得了巨大的进步[11-12]。人源化动物模型是指带有人类功能性基因、细胞或组织的动物模型[13]。人源化动物的构建主要通过2种方式:①基因人源化,即将人类的抗体、病原受体、药物代谢基因等敲入到大鼠或小鼠的基因组中,使动物可分泌人类抗体、感染人传染病病原、与人类有相似的药物代谢行为和毒理表型;②细胞人源化,即在免疫缺陷动物(如NSG小鼠)中注射一定数量的人类细胞或干细胞,从而获得人源化动物。本文总结了目前可用于肿瘤免疫治疗药物研究的人源化动物模型的特点,希望为研究者开展相关研究工作提供参考。
1 重建人免疫系统动物模型
免疫系统在机体消灭肿瘤细胞的过程中发挥着重要的作用。在肿瘤免疫药物研发的过程中,临床前阶段的实验结果往往不能很好地推测临床毒性及疗效,牵涉到的原因会有很多,但其中最重要的原因就是种属差异性,啮齿类动物模型不能很好地模拟人类的免疫系统,特别是T细胞信号通路、抗原递呈作用和免疫受体表达[14-15]。
目前,通过在高度免疫缺陷小鼠体内移植来源于人的骨髓、外周血或胚胎组织的造血干细胞,使小鼠体内表达人类的免疫系统,可获得重建人免疫系统(human immune system,HIS)小鼠模型。根据所使用小鼠的品系及所移植的人源细胞系的不同,每个模型均有各自的优缺点[16-23](表1)。重建HIS的小鼠模型有望成为克服种属差异的重要模型,并广泛应用于肿瘤免疫药物的临床前评价。
重建HIS的小鼠模型具有很多优点,但在使用过程中也有一些限制,包括:①移植物抗宿主反应(graft-versus-host disease,GVHD)。通过输入骨髓、外周血单个核细胞(peripheralblood mononuclear cell,PBMC)建立的人源化小鼠在建模后不同时间均会发生致命的GVHD,表现为皮肤炎症和消瘦。这是由于活化的人源性T细胞攻击宿主(小鼠)的组织,从而导致宿主血清中人类免疫球蛋白水平(IgG和IgM)升高而产生。②增殖效果不佳。小鼠内源性免疫系统会限制移植人源细胞的扩增,如NSG小鼠具有固有的免疫细胞(如巨噬细胞、树突状细胞和中性粒细胞),会阻碍人源细胞的增殖[24],使扩增缓慢。小鼠的蛋白虽不会与人类细胞交叉反应,但人源性的一些蛋白会与小鼠蛋白交叉反应,从而影响人源性细胞的增殖速度。③不完整的HIS。重建HIS小鼠模型无法反映HIS的所有特征,如在人源外周血淋巴细胞重症联合免疫缺陷(hu-PBL-SCID)和人源SCID再植细胞严重联合免疫缺陷(hu-SRC-SCID)小鼠模型中,人源T细胞受限于小鼠H-2d抗原而不能识别HLA限制的抗原,这种缺失使得在使用该类小鼠研究肿瘤的转移时,由于小鼠无法产生人源细胞毒T淋巴细胞反应,而对研究肿瘤转移过程有所影响。重建HIS小鼠模型对于外周淋巴结的特性反映较少,仅人源骨髓/肝细胞/胸腺重症联合免疫缺陷小鼠(hu-BLT-SCID)模型能部分反映外周淋巴结的功能,但仍无法反映淋巴结的生发中心,因此无法呈现Ig类别转换。
2 重建人免疫系统+人源肿瘤组织异种移植动物模型
约10年前,研究者发现,可直接将新鲜取得的人体肿瘤组织通过手术的方式移植到免疫缺陷小鼠体内,获得的模型称为人源肿瘤组织异种移植(patient-derived tumor xenograft,PDX)模型[25-28]。该模型保留了人源肿瘤的微环境和基本特性以及组织病理学特征,并一定程度上保留了遗传学异质性,弥补了肿瘤细胞系移植模型的一些缺陷[29-30]。该模型也可保留人源肿瘤的临床和组织病理学标志物、基因表达以及DNA拷贝数,这些指标均可用于临床上判断肿瘤转移的类型[31-32]。该模型的另一优势是具有良好的临床预测性,可应用于指导肿瘤患者的个性化临床用药。有文献报道,使用人源肿瘤组织移植模型预测药物临床疗效为阳性的准确率达90%(19/21例),预测为阴性的准确率达97%(57/59 例)[25,31-32]。
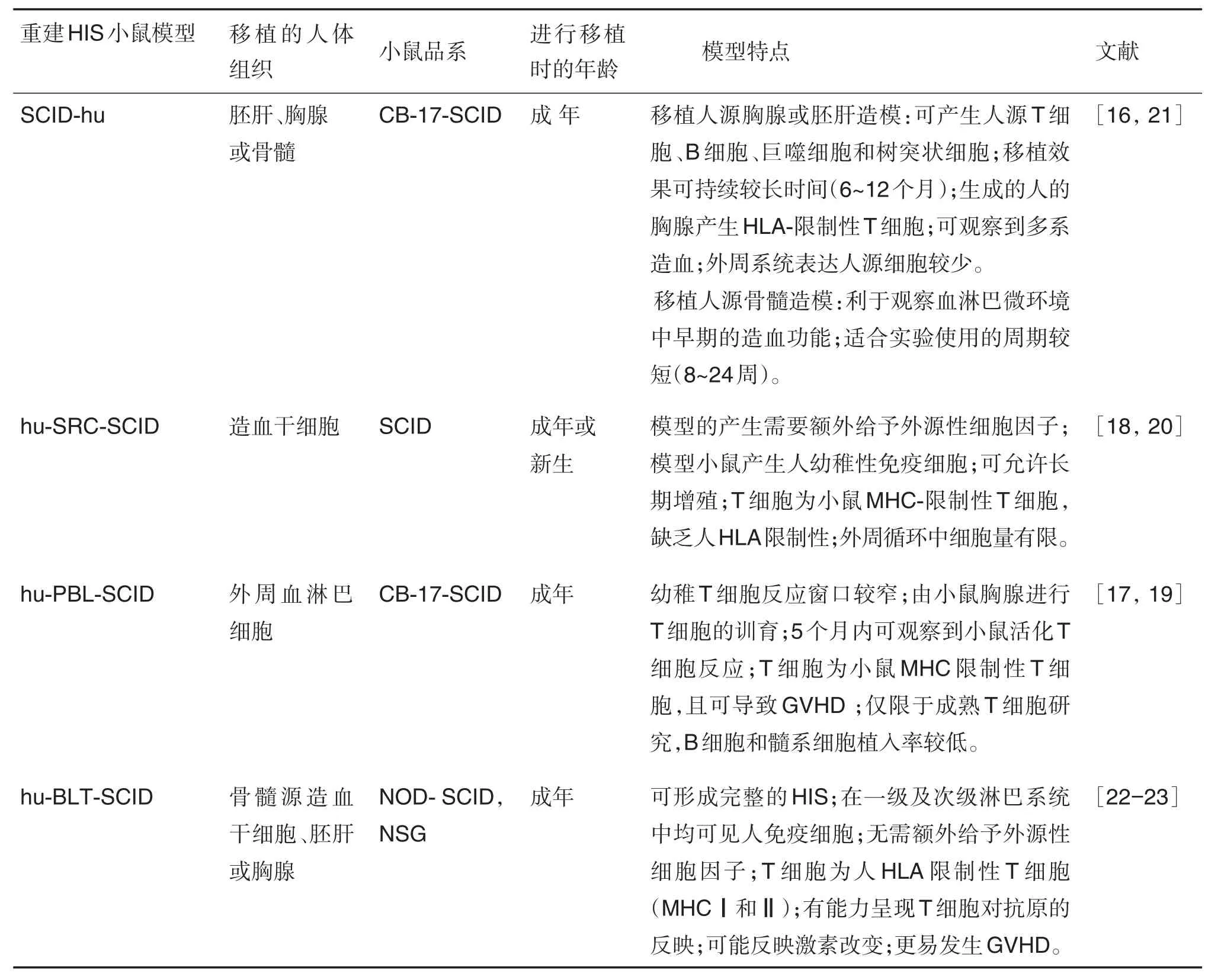
表1 常用重建人免疫系统(HIS)小鼠模型的特点
随着重建HIS动物模型的发展,有研究者在使用重建HIS动物进行PDX,构建了重建HIS+PDX动物模型。使用该模型可在重建的患者免疫系统环境下考察接种该患者肿瘤后,肿瘤与机体相互作用过程中各项生理指标的变化,以及肿瘤与免疫系统的相互作用和肿瘤的抵抗性,因此也是目前最接近临床肿瘤患者情况的模型,可用于个体化检测患者肿瘤对于不同抗肿瘤药物治疗效果的敏感度。此外,重建HIS+体外培养的人源肿瘤细胞移植动物模型还可用于药物临床前的药效和毒理实验,为免疫毒性的评价提供更多信息。
已有研究报道,将体外扩增的人造血干细胞或人干细胞祖细胞,经骨髓腔注射至经过辐照(如60Coγ射线)后的NSG小鼠体内,可建立重建HIS的小鼠模型,之后再将头部及颈部肿瘤患者的肿瘤组织经手术切除后,皮下移植至构建的重建HIS的小鼠侧面体表,以研究人干细胞祖细胞与移植的人源肿瘤之间的相互作用[33]。结果表明,在重建HIS后6个月,在小鼠的外周血中仍可检测到稳定表达的人源CD3/CD45+细胞;12个月后,在小鼠的骨髓及脾内可见人源T细胞及B细胞,证明人干细胞祖细胞在移植后仍在持续扩增,在骨髓细胞中人源化细胞的比例占2%~5%。移植的人源骨髓细胞可浸入皮下移植的人源肿瘤内产生α平滑肌肌动蛋白,散在分布于小鼠基质细胞内。此外,移植的人干细胞祖细胞可产生人源细胞因子,产生的人源细胞因子有助于移植的人源肿瘤维持肿瘤原本的特性避免遗传漂变。与其他模型相比,该模型建立的肿瘤微环境更加接近临床患者的情况,是研究肿瘤与免疫系统相互作用的有力工具,可用于探索病理情况下潜在的生物标志物或基因信号,还可用于推测临床联合用药的有效性,及对特殊肿瘤的临床用药进行指导。据文献报道,临床发现的某例乳腺癌雌激素受体阳性患者,由于出现雌激素受体变异导致针对该靶点的治疗无效,通过采用以上模型针对该患者进行其他治疗方案的评估,从而指导了该例患者的临床用药[34-37]。通过大量肿瘤模型的建立可用于临床前研究、辅助临床试验中生物标志物的发现和与临床患者做同步用药试验及相应的回顾性试验。
但PDX模型在应用过程中也有一些限制因素,如用于移植的人源肿瘤必须是通过手术方式新鲜取下,移植成功率较低(约70%)[31-32],且移植后的肿瘤成活需较长时间。因此,该模型的应用局限于药物研发的中后期,可与临床试验联合进行,以更好地协助指导临床用药,探索新的肿瘤治疗机制及发现新的标志物。
3 基因修饰的人源化动物模型
在过去几十年间,基因工程技术发展迅速,已可实现在小鼠基因组内进行有目的的基因修改,因此基因修饰的人源化动物模型也快速发展并被广泛应用。基因修饰后的人源化动物在部分或全部细胞内携带了人类DNA,人源的序列可调节基因表达及编码蛋白。目前利用转基因技术或基因敲除技术进行小鼠的基因修饰,在肿瘤免疫治疗中已得到广泛应用。如当肿瘤细胞与来自不同个体的造血细胞之间时,人类白细胞抗原(human leukocyte antigen,HLA)的不匹配会引起严重的GVHD或反应缺失。Shultz等[38]报道,通过转入HLA匹配的人类造血干细胞来构建HLAⅠ类(A2)转基因NSG小鼠。这些模型小鼠的发展为研究肿瘤的免疫治疗提供了良好的工具。
临床前实验阶段,常用的啮齿类动物为大鼠或小鼠,均具有健全的免疫系统。但在进行免疫治疗药物的临床前毒理学评价时,某些人源化的产品在啮齿类动物体内无效,因而很难采用啮齿类动物模型进行实验。目前已研发出转入有人类基因的基因修饰的人源化小鼠模型,可在小鼠体内表达人源蛋白。如PD-1主要表达于T细胞及初级B细胞表面,在免疫应答的负性调控方面发挥重要作用,抑制PD-1与其配体的结合,可使肿瘤细胞暴露于免疫系统的杀伤视野,进而达到杀伤肿瘤组织及治疗癌症的作用。通过将人PD-1基因转入C57H Black/6小鼠,可使小鼠表达人源化PD-1蛋白,以评价人源化PD-1抗体的药效。
4 人源化动物模型的选择及应用
目前免疫治疗药物的发展日新月异,对动物模型提出了较高的要求。对于一些机制不明的免疫治疗产品,不同的动物模型对于药物作用的响应会有非常大的差异,因此选择合适的动物模型进行实验非常重要。与非免疫治疗药物研究的模型选择不同,免疫治疗除了需要关注选择的肿瘤类型、药物作用机制外,还要关注肿瘤模型的宿主因素,如所动物种属对药物作用的特异性、是否会发生GVHD、免疫原性和是否有合格的动物供应商等等。即使考虑到以上因素,由于免疫治疗的个体差异性非常大,建议选择多个模型进行实验,以获得不同模型的数据。在临床前及临床阶段,还应考虑该模型是否具有可供监测的敏感的生物学标志物。
直接针对肿瘤细胞的免疫治疗药物,如直接调节肿瘤细胞生长的药物,可考虑使用重建HIS+PDX动物模型,以验证药物作用靶点、开展药效学和药动学实验、以及发现生物标志物等。目前在临床前的药物作用机制及药效学研究过程中,重建HIS动物+PDX模型是最接近肿瘤患者病理生理特征的动物模型,也是未来新的动物模型发展的重要方向。
对于免疫检查点抑制剂类药物,免疫缺陷动物往往不能体现其靶点相关的毒性,而使用动物源的替代产品一方面对药学部分提出很高的要求,另一方面也需有足够的实验结果证明动物源替代产品的结果对于临床毒性预测的意义。因此在目前阶段,采用转基因技术构建的人源化动物模型是一个相对比较理想的选择。如何保持动物模型本身免疫系统的完整性及减少动物个体差异性,是该模型下一步需要解决的问题。在选择动物供应商时,需要关注其模型动物的背景数据(如人源化基因表达的比例及其随时间变化的关系、动物生长曲线、存活期、不同周龄动物各项临床病理指标的背景数据),以选择个体差异较少的动物模型,从而获得差异较小、准确度较高的动物实验数据。
对于目前不断产生的新的细胞治疗产品,在选择动物模型时需要针对细胞治疗产品的作用机制及特点进行选择。对于特殊给药途径的细胞治疗产品需考虑动物和人的解剖学差异,以及药物到达作用部位的可行性。如在CAR-T治疗产品临床前安全性评价中,需要考察CAR-T增殖所带来的靶点相关毒性以及脱靶毒性,可通过不同模型的组合实验达到评价目的,即采用人源化小鼠荷瘤模型考察CAR-T治疗产品的靶点毒性,同时采用免疫缺陷动物考察脱靶毒性。在实验设计中可将药效、组织分布、毒理等多个评价目的整合在一个实验中,作为概念验证实验(proof of concept)对新的免疫治疗药物临床前安全性进行综合性评价。
人源化动物的构建技术还在不断发展中,各个实验室及动物供应商对于新模型的应用需特别注意背景数据的累积。如在应用人源化动物模型进行临床前毒理学评价时,需充分考虑到模型动物个体差异以及新模型动物的特点,在进行实验设计时,通过适当放大动物例数、设立不同的对照组等方法科学地评价肿瘤免疫治疗药物的安全性。
不同类型人源化小鼠模型有其不同的特点、应用阶段和范围。在临床前评价阶段,尚无一个动物模型是万能的,需根据药物的特点选择不同的动物模型,综合评价药物的安全性及有效性,科学地预测药物临床应用的安全性。
5 结语
新技术在动物模型构建中的应用为肿瘤免疫治疗研究带来巨大的发展。人源化动物模型在研究免疫治疗药物的作用机制、药效筛选和毒性评价等方面具有较明显的优势,如可表达人源化蛋白、人细胞因子、模拟HIS、体现HIS下移植的人源化肿瘤与免疫系统及药物之间的相互作用,甚至可应用于临床指导患者个体化用药的研究。但目前可用的人源化动物的类型还较为单一,HIS重建程度也有待完善。如何构建与HIS相似度更高的模型动物,同时提高人源化动物的质量和产量,完善模型动物背景数据库,并建立更健全的动物检验标准,都是需要不断努力解决的问题。希望在不远的将来有更好的动物模型产生,为新药研发及临床应用研究助力。

