2-吲哚啉酮衍生物对二氧化硅致小鼠肺纤维化的预防作用
刘 婷,赵 珂,高 瑞,李小东,詹轶群,高慧英,杨晓明2,,李长燕
(1.安徽医科大学研究生学院,安徽合肥 230032;2.军事科学院军事医学研究院辐射医学研究所,北京 100850;3.军事科学院军事医学研究院生命组学研究所,北京 102206)
矽肺病是长期吸入大量的游离结晶二氧化硅(silica,SiO2)所引起的以结节性纤维化为主的慢性职业性肺病[1]。大量吸入SiO2可产生严重的炎症反应,巨噬细胞大量聚集,释放大量细胞因子如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)、脂类介质、氧自由基和活性氧类(reactive oxygen species,ROS)等[2],导致肺部结构严重损伤,成纤维细胞过度增殖,胶原沉积,最终导致呼吸衰竭。越来越多的报道表明,氧化应激在矽肺病中发挥巨大作用[3-4]。矽肺病的治疗包括药物干预与非药物干预[5],但效果并不理想。目前国际批准用于治疗肺纤维化的药物也仅有2种:尼达尼布(nintedanib)和吡非尼酮(pirfenidone,PFD)。我国尚缺乏具有自主知识产权的肺纤维化治疗药物[6],所以研发新的肺纤维化治疗药物具有重要意义。
2-吲哚啉酮衍生物〔3-(3-pyridylmethylidene)-2-indolinone,PMID〕是本研究室应用蛋白质相互作用药物平台筛选出的具有抗氧化活性的小分子化合物[7],为无定型结晶黄色粉末,化学式为C14H10N2O,相对分子质量为222.24。PMID能够激活核因子E2相关因子2(NF-E2-related factor 2,Nrf2)/抗 氧 化 反 应 元 件(antioxidant response element,ARE)信号通路,上调血红素加氧酶和超氧化物歧化酶等蛋白的表达,对抗氧化应激对机体造成的损伤[8]。鉴于氧化应激损伤在肺纤维化发病过程中发挥重要作用,本研究观察PMID对SiO2所致肺纤维化的预防作用。
1 材料与方法
1.1 实验动物、药物、试剂和仪器
SPF级C57BL/6J小鼠,雄性,体质量18~22 g,周龄为6~8周,购于北京维通利华(北京)生物技术有限公司,实验动物合格证编号:SCXK(京)2016-0002。实验动物在军事医学研究院SPF级动物实验室内饲养,实验室饲养设施合格证号:SYXK-(军)-2007-004。每笼5只小鼠,自由进食和饮水,昼夜节律。动物实验室内温度保持在约25℃,相对湿度保持在40%~70%。
PMID,军事医学研究院辐射医学研究所合成,批号为20160901,纯度99.22%;PFD,大连美仑生物有限公司;SiO2,美国Sigma公司,纯度99%,粒子直径在0.5~10 μm,80%粒子直径在1~5μm,烘烤过夜(200℃,16h)去除内毒素;生理盐水注射液,石家庄四药有限公司;大鼠抗小鼠α平滑肌肌动蛋白(α-smoothmuscleactin,α-SMA)单抗、兔抗小鼠转化生长因子 β(transforminggrowthfactor-β,TGF-β)单抗、兔抗小鼠CD11b单抗和兔抗小鼠F4/80单抗均购于北京谷歌生物有限公司;PE-Cy7标记大鼠抗小鼠CD11b单抗、V450标记大鼠抗小鼠Ly6G单抗及APC标记大鼠抗小鼠CD3单抗,美国eBioscience公司;APC标记大鼠抗小鼠Ly6C单抗和PE-Cy7标记大鼠抗小鼠B220单抗,美国BioLegent公司;实时定量PCR引物由生工生物工程有限公司合成,GAPDH引物序列:F-AATGTGTCCGTCGTGGATCT,R-CATCGAAGGTGGAAGAGTGG;IL-6引物序列:F-CCAGAGATACAAAGAAATGATGG,R-ACTCCAGAAGACCAGAGGAAAT。实时定量PCR仪,日本TOYOBO公司;PCR仪,美国BIO-RAD公司;酶标仪,美国PerkinElmer公司;激光共聚焦显微镜,德国Zeiss公司;流式细胞仪,美国BD公司。
1.2 SiO2诱发小鼠肺纤维化模型的制备和分组给药
C57BL/6J小鼠提前禁食12h,称重,用1%戊巴比妥钠麻醉小鼠,将小鼠固定在固定器上,通过喉镜照射找到气管,将喷雾针插入气管后分别立即喷雾给予SiO220,30,40和50g·L-1,每只100uL。喷雾完成后轻轻旋转小鼠,使SiO2在小鼠体内分布均匀。正常对照组同种方式给予生理盐水喷雾。SiO2给药后分别在第7,14和28天每组处死5只小鼠,通过HE染色分析各组小鼠肺组织病理变化,确定小鼠的最佳造模剂量。
确立最佳喷雾剂量后,采用喷雾针无创喷雾方式制备小鼠肺纤维化模型。小鼠分为正常对照组、模型组、模型+PMID5,15和20mg·kg-1组及模型+PFD15mg·kg-1组,每组10只。喷雾完成后待小鼠活动正常,立即分别ig给予PMID5,15和20mg·kg-1或PFD15mg·kg-1,每天2次,每次间隔6~8h,连续28d。每组取3只进行肺泡灌洗,其余解剖取肺组织用于后续实验。
1.3 流式细胞术分析支气管肺泡灌洗液(bronchoalveolarlavagefluid,BALF)中免疫细胞种类
用剪刀在气管处剪一小口,用枪头进行气管插管,用PBS进行支气管-肺泡灌洗,收集BALF,反复抽吸3次。灌洗液体积为1mL,回收率达70%~80%为合格。BALF于800×g离心5min,收集上清分装冻于-80℃。细胞沉淀加入1mL红细胞裂解液裂解红细胞,裂解时间为5min,用PBS终止;800×g离心5min,用PBS1mL重悬细胞,将细胞过筛到1.5mL离心管中;800×g离心5min,用80 μL PBS重悬,将细胞平均分为2份,细胞数量为1×105,一份用于检测CD3-APC和B220-PE-Cy7细胞,另一份用于检测CD11b-PE-Cy7,Ly6G-V450和Ly6C-APC细胞。分别加入相应抗体0.5μL(抗体浓度0.2g·L-1),常温避光标记15min,用PBS 900 μL终止,800×g 离心5min;弃上清,用含1%多聚甲醛固定细胞,转移到流式管,于流式细胞仪进行检测。
1.4 HE染色观察肺组织病理变化
肺组织固定完成后,进行常规石蜡切片,HE染色,根据炎症细胞浸润、以及组织水肿、上皮细胞损伤、组织肺叶浸润、肺泡损伤程度等分析。每组取3张切片,每张切片随机选取5个视野,进行评分。评分标准见表1。

Tab.1Gradingstandardofpathologicalchangesin lungtissue(HEstaining)
1.5 Masson胶原染色观察肺组织胶原含量
将肺组织切片进行脱蜡处理,Masson染色,然后脱水封片,显微镜下观察有胶原物质积累的部位,Masson染色为蓝色。每组取3张切片,每张切片随机选取5个视野,进行评分。根据评分标准(表2)半定量分析肺纤维化程度。

Tab.2 Grading standard of lung fibrosis(Masson co llagen staining)
1.6 免疫组化法分析免疫细胞数量和纤维化相关因子表达
用多聚甲醛固定肺组织,进行石蜡包埋切片,将病理切片进行脱蜡处理,用柠檬酸盐缓冲液进行组织抗原修复(中火8m in煮沸,然后停火8m in,随后转低火7 m in),随后进行过氧化物酶阻断。室温避光孵育25 m in,BSA室温封闭30 m in,随后加入一抗〔α-SMA(1∶500),TGF-β(1∶500),CD11b(1∶1000)和F4/80(1∶1000)〕工作液,4℃孵育过夜;孵育二抗辅助工作液1 h,孵育相对应的山羊抗大鼠IgG单抗和山羊抗兔IgG单抗(二抗)1.5 h,孵育完成后进行DAB显色,随后进行苏木素染核,温水反蓝,脱水封片。显微镜下观察分析α-SMA,TGF-β,CD11b和F4/80抗原的表达。以胞浆或细胞核染成棕黄色为阳性表达,每组取3张切片,每张切片随机观察5个视野,Image pro p lus6.0软件进行半定量分析。
1.7 实时定量PCR分析肺组织lL-6m RNA水平
Trizol法提取肺组织总RNA,按照试剂盒说明书用Promega GoScriot TM Reverse Transcription System系统进行PCR扩增,逆转录为cDNA。随后进行RT-PCR,将模板、引物、水以及TOYOBO SYBR Master Mix按比例混合,使用 IQ5 Realtime PCR System仪器进行检测,实验条件为95℃,10m in;95℃,15 s ,60℃,1m in ,40个循环;95℃,1 m in;55℃,1 m in ;55℃,10 s,81个循环。用2-△△Ct表示IL-6mRNA水平。
1.8 统计学分析
计量资料实验结果数据以x±s表示,通过GraphPad Prism 5软件进行统计分析,组间差异采用单因素方差分析。P<0.05认为具有统计学意义。
2 结果
2.1 SiO2诱发小鼠肺纤维化模型的制备

Fig.1 Determ ination of silica(SiO2)dose for p reparation of pulmonary fibrosis m ouse m odel by HE staining.Mice were adm inistered with trachea spray of SiO2 20,30,40 and 50 g·L-1,and the volume was 100 μL.After 7,14 and 28 d,the lung tissues were stained with HE staining.The arrows show lung pathological changes including inflammatory infiltration and pulmonary parenchyma change.
实验实施期间,所有组别小鼠均无死亡。图1结果显示,在SiO2喷雾剂量为20和30 g·L-1时,肺组织并未出现明显的损伤。喷雾剂量为40 g·L-1时,肺组织可见支气管及血管周围大量淋巴细胞浸润,肺泡腔内见巨噬细胞,部分肺泡塌陷,肺泡间隔增宽,28 d时可见少量肺实质。喷雾剂量为50 g·L-1时,造模第7天,可见大范围炎症细胞浸润;造模第14天,多处小范围肺实变,肺泡间隔轻度增宽,肺泡腔内炎性物渗出,巨噬细胞聚集;造模第28天后,多处大范围肺实变,肺泡腔内炎性物渗出,巨噬细胞聚集,成纤维细胞大量聚集,形成肺纤维化。根据以上结果,本研究确定SiO2致肺纤维化的造模剂量为50 g·L-1,喷雾体积为100 μL。
2.2 PM lD有效减轻SiO2所致小鼠肺纤维化
2.2.1 PMlD显著减轻肺纤维化小鼠肺损伤
肺部大体观察可见,与正常对照组相比,模型组肺部肿大;模型+PMID和模型+PFD组肺部肿大明显缓解。HE染色结果显示(图2A),正常对照组肺组织结构正常,肺泡腔呈空泡状薄壁结构,支气管为纤毛柱状上皮结构,肺泡壁结构清晰。模型组整个肺组织发生实变,可见炎症细胞灶性浸润,肺泡腔内充满炎性渗出物,淋巴细胞和巨噬细胞浸润,出现明显的肺纤维化。模型+PMID 5和15 m g·kg-1组气管周围可见少量淋巴细胞浸润,肺泡壁结构正常;模型+PMID 20mg·kg-1组肺组织结构恢复正常;模型+PFD组仍有少量肺实质改变。对肺纤维化程度进行评分分析(图2B),发现PMID可显著减轻肺纤维化小鼠的肺损伤,与模型组相比,肺组织病理变化评分降低(P<0.05),且模型+PMID 20mg·kg-1组明显优于模型+PFD组(P<0.05)。
2.2.2 PMlD显著降低肺纤维化小鼠肺组织中胶原的含量
如图3所示,与正常对照组比较,模型组肺组织有大量的胶原物质积累(P<0.01);模型+PMID组和模型+PFD组有明显的缓解(P<0.01),其中模型+PMID 20 mg·kg-1组优于模型+PFD组(P<0.05),表明PMID可显著降低肺纤维化小鼠肺组织中的胶原含量。

Fig.2 Effect of 3-(3-pyridylm ethylidene)-2-indolinone(PM lD)on histopatho logical dam age in mice with pulmonary fibrosis induced by SiO2 by HE staining.Pulmonary fibrosismousemodelwas induced by spray of SiO2 50 g·L-1(100 μL).Mice were ig given PM ID or pirfenidone(PFD)tw ice daily for 28 d.B was the sem iquantitative resu lt of A.The arrows show lung patho logical changes including in flammatory in filtration and pulm onary parenchyma change.x±s,n=7.**P<0.01,com pared with norma l control group;#P<0.05,com pared withmodelgroup;△P<0.05,com pared withmodel+PFD group.
2.2.3 PMlD显著降低肺组织纤维化相关因子的表达
免疫组化实验结果表明(图4),与正常对照组相比,模型组肺实质损伤处被染成深棕色,表明肺纤维化相关分子α-SMA,TGF-β和ColⅠA2高表达(P<0.01)。对于α-SMA,与模型组相比,模型+PM ID 5mg·kg-1组在气管周有少量的阳性表达(P<0.05),模型+PMID 15和20mg·kg-1组肺组织结构正常,阳性表达明显少于模型组(P<0.01),并且与模型+PFD组相比,表达明显减少(P<0.05)。对于TGF-β,与模型组相比,模型+PM ID 5m g·kg-1组有少量阳性表达(P<0.05),其余各给药组肺组织结构正常,无阳性表达(P<0.01)。对于ColⅠA2,与模型组相比,模型+PM ID 5,15和20m g·kg-1组及模型+PFD组表达均明显减少(P<0.05)。
2.3 PM lD显著降低SiO2引发的肺部炎症反应
2.3.1 PMlD降低BALF中炎症相关免疫细胞的数量
图5结果显示,与正常对照组相比,模型组BALF中有大量T和B细胞聚集及炎症细胞多形核中性粒细胞(PMN)和巨噬细胞(MΦ)浸润(P<0.01)。与模型组相比,模型+PMID 5和20mg·kg-1组T和B细胞百分比显著降低(P<0.05);且模型+PMID 20 mg·kg-1组较模型+PFD组亦显著降低(P<0.01)。与模型组相比,模型+PMID 5,15和20 mg·kg-1组PMN和MΦ百分比均明显降低(P<0.05)。提示PMID可以通过抑制炎症细胞浸润缓解肺纤维化。
2.3.2 PMlD可降低肺组织中CD11b和F4/80的表达
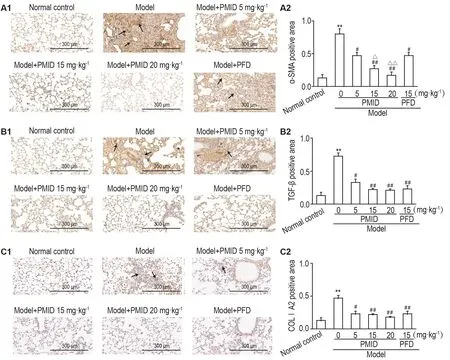
Fig.4 Effect of PM lD on expression ofα-sm oo th m usc le ac tin(α-SMA)(A),trans form ing g row th fac to r-β(TGF-β)(B)and co llagen alpha-2 typeⅠ(Co lⅠA2)(C)in lung tissue ofmice with pulmonary fibrosis induced by SiO2 by lmm unohistochem ical staining.See Fig.2 for the mouse treatment.A2,B2 and C2 was the sem iquantitative result of A1,B1 and C1,respective ly.The arrows show the positive expression area.x±s,n=3.**P<0.01,com pared with norm al control group;#P<0.05,##P<0.01,com pared with m odelgroup;△P<0.05,△△P<0.01,com pared with m odel+PFD group.
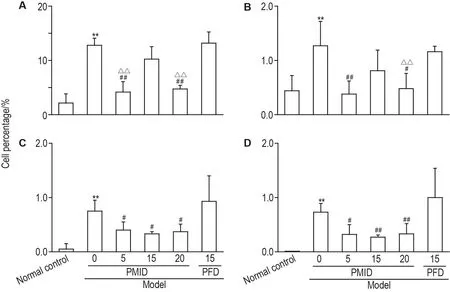
Fig.5 Effect of PM lD on inflamm atory related imm une cells inc luding T cells(A),B cells(B),po lym o rphonuc lear neu trophils(PMN)(C),and m ac rophage(MΦ)(D)in b ronchoalveo lar lavage fluid(BALF)ofmice with pulmonary fibrosis induced by SiO2.See Fig.2 for the m ouse treatm ent.x± s,n=4-6. **P<0.01,com pared with norm al control group;#P<0.05,##P<0.01,compared withmodelgroup;△△P<0.01,com pared withmodel+PFD group.
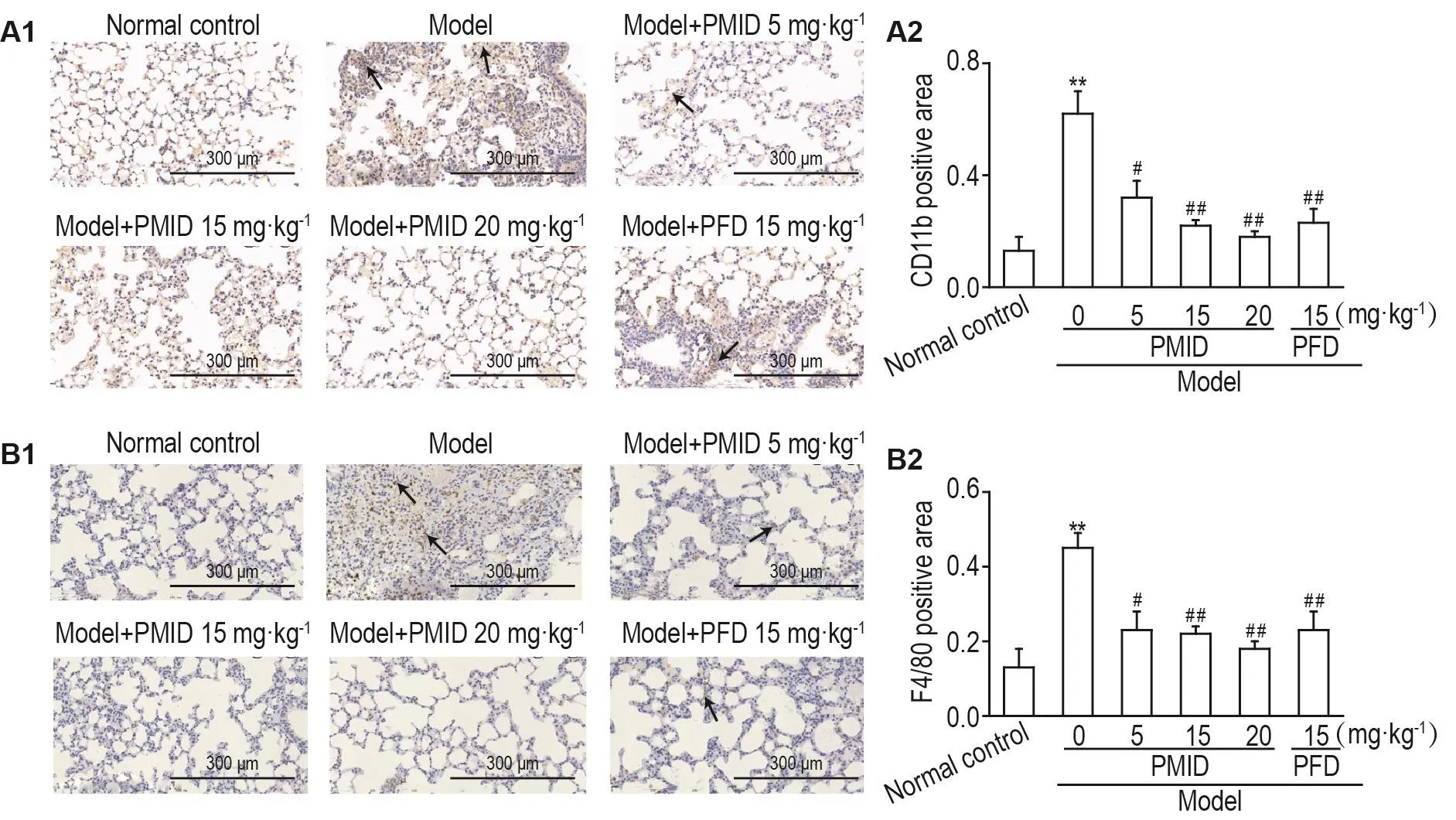
Fig.6 Effect of PMlD on expression of CD11b(A)and F4/80(B)in lung tissue ofmice with pu lmonary fibrosis induced by SiO2 by lmm unohistochem ical staining.See Fig.2 for the mouse treatment.A2 and B2 was the sem iquantitative results of A1 and B1,respective ly.The arrows show the positive expression area.x±s,n=3.**P<0.01,com pared with norm a lcontrolgroup;#P<0.05,##P<0.01,com pared with m odelgroup.
图6结果所示,正常对照组肺组织肺泡腔呈空泡状薄壁结构,支气管为纤毛柱状上皮结构,肺泡壁结构清晰。与正常对照组相比,模型组有大量CD11b和F4/80的表达,表明肺纤维化过程中有大量炎症细胞浸润。与模型组比较,模型+PMID 5mg·kg-1组有少量细胞染成深棕色,有少量阳性表达(P<0.05);模型+PMID 15和20 mg·kg-1组及模型+PFD组肺组织CD11b和F4/80几乎无阳性表达,炎症细胞数量较少(P<0.01)。
2.3.3 PMlD降低肺组织中的lL-6m RNA水平
实时定量PCR分析结果(图7)显示,与正常对照组相比,模型组肺组织IL-6m RNA水平明显升高(P<0.01);与模型组相比,模型+PMID 5,15和20 mg·kg-1组和模型+PFD组IL-6 m RNA水平降低(P<0.01)。

Fig.7 Effect of PM lD on level of in terleukin-6(lL-6)m RNA in lung tissue ofmice with pulmonary fibrosis.See Fig.2 for the m ouse treatm ent.x ± s,n=3. **P<0.01,com pared with normal control group;##P<0.01,com pared with modelgroup.
3 讨论
本研究通过对C57BL/6J小鼠进行气管内喷雾SiO2的方式制备稳定的肺纤维化模型。模型制备后,ig给药观察PMID对SiO2所致小鼠肺纤维化的预防作用。结果表明,PMID可有效缓解小鼠的肺损伤,降低肺组织胶原物质含量,降低相关免疫分子的表达,提示PM ID对SiO2所致小鼠肺纤维化有良好的预防效果。
SiO2诱发的矽肺病主要分为2个阶段,炎症是SiO2诱发肺纤维化的重要病理阶段。在SiO2诱发肺纤维化的炎症阶段,PMN和MΦ大量聚集,产生大量炎症细胞因子,从而使上皮细胞大量凋亡,TGF-β和α-SMA的表达明显上调,从而使得成纤维细胞不断增殖和转化,由成纤维细胞转化为肌成纤维细胞,从而形成肺纤维化。在细胞水平和分子水平对炎症细胞的种类及炎症相关因子的表达进行分析,发现PM ID给药组中PMN和MΦ数量显著降低,组织中IL-6 mRNA表达也显著降低。提示PM ID可以通过抑制肺纤维化过程中的炎症阶段抑制肺纤维化。
氧化应激是矽肺病发生的重要分子机制。在矽肺患者中,由于吸入SiO2粒子,导致肺泡MΦ、上皮细胞和成纤维细胞释放ROS和活性氮等[9],这些分子招募炎症细胞如PMN和淋巴细胞,炎症反应不断进行,释放大量的细胞因子,进一步导致上皮细胞的持续性微小损伤,引起上皮细胞的大量凋亡,细胞间充质转化,组织修复,促使成纤维细胞向肌成纤维细胞转化,胶原物质的大量积累,从而形成肺纤维化[10]。 Nrf2/Kelch样ECH相关蛋白1(Kelch-like ECH associating p rotein 1,Keap1)是机体最重要的抗氧化信号通路,可以被氧化应激所诱导,Nrf2转录因子被激活后入核,与ARE序列结合进而调节下游靶基因的表达[11-12]。这些靶基因的表达可有效抵御氧化应激损伤[13]。研究表明,Nrf2信号通路激活能够抵御肺纤维化的形成[14],并且在肺纤维化严重的组织中,Nrf2下游靶基因的表达明显下调血红素加氧酶-1和超氧化物歧化酶等,而激活Nrf2下游靶基因能够明显抑制肺纤维化的形成[15]。Nrf2敲除小鼠对各种因素诱发的肺纤维化更加敏感[14]。因此,Nrf2/Keap1信号通路很可能成为肺纤维化新的干预靶点。PMID是我们前期基于Nrf2/Keap1信号通路筛选出来的抗氧化化合物,PMID可有效激活抗氧化信号通路Nrf2/ARE[7],并促进抗氧化基因超氧化物歧化酶和NQO1的表达。本研究结果显示,PMID可对SiO2致小鼠肺纤维化具有很好的预防效果,提示PMID作为新的肺纤维化治疗候选药物,具有重要的应用前景。
Nrf2/Keap1信号通路对炎症反应具有调控作用[16]。该通路的活化可抑制NF-κB,负向调控炎症反应[17]。Nrf2敲除小鼠对炎症更加敏感[18]。本研究发现,PMID可显著抑制SiO2诱发的肺部炎症反应,降低炎症细胞浸润,抑制炎症因子的表达,表明PMID预防肺纤维化作用可能与调控炎症反应有关,推测PMID很可能在其他氧化应激相关炎症疾病中发挥重要作用。
综上所述,新结构化合物PM ID可有效防护SiO2所致的小鼠肺纤维化,活性优于阳性药物PFD,具有重要的开发价值。

