铝对斑马鱼幼鱼运动行为的影响及其机制
谈 勇,许梦川,王 远,张 芳,李小满,陈 豪,赵宝全,汪雪雁
(1.安徽农业大学茶与食品科技学院,安徽合肥 230036;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;3.解放军总医院肾脏疾病国家重点实验室,北京 100853)
铝是地壳中除氧、硅之外最多的元素,也是最丰富的金属元素,铝在人们的日常生活中得到广泛使用,尤其在食品、饮用水和药品等方面[1]。然而,铝离子一旦进入人体,可在大脑内沉积,造成严重的记忆力丧失。已发现铝具有毒性,在体内蓄积后会引发一系列疾病,如抑制软骨细胞活性和软骨胶原的合成,增强软骨基质降解,导致软骨损伤;引起尿钙排泄量增加,导致人体内钙量不足等,进而导致一系列疾病,尤其是神经毒性疾病[2-3]。然而现在很多市售食品铝含量超标[4],长期食用后会对身体健康造成不可逆的伤害,需要引起高度重视。铝超标造成儿童的神经毒害研究鲜有报道,相关动物模型非常有限。近年来,斑马鱼作为神经毒性研究的模型动物发展迅速,与其他模型动物相比斑马鱼具有独特优势:①常年产卵、体型小、发育快、易于饲养、体外受精,早期胚胎透明,易于观察[5];②与人类的基因具有很高同源性[6];③在神经生理、解剖以及基因结构功能上,与髙等动物具有高度相似性[7]。因此,本研究以斑马鱼幼鱼为模型探讨铝对其运动行为的影响及其分子机制。
1 材料与方法
1.1 试剂和仪器
无水氯化铝(AlCl3)、无水氯化镁、蔗糖和二甲亚砜(DMSO)中国国药集团;二氯荧光素二乙酸酯(DCFH-DA)上海碧云天生物技术有限公司;通用型组织固定液,武汉谷歌生物科技有限公司;总RNA提取试剂盒和SYBR Prem ix Ex Taq,天根生化科技(北京)有限公司;逆转录试剂盒,美国Prom ega公司;引物合成由北京赛百盛基因技术有限公司完成。斑马鱼循环水养殖系统,北京爱生科技公司;微量移液器,德国Eppendorf公司;X221942H型光学显微镜,日本尼康公司;多功能酶标仪,美国Molecular Devices公司;LightCycler®96实时荧光定量PCR仪,瑞士Roche公司;DVOC-0040 Daniovision行为学系统,荷兰Noldus公司。
1.2 实验动物
AB系成年斑马鱼由北京大学生命科学学院提供,本实验室循环养殖系统饲养,循环养殖水按照Brand等[8]的方法配制:毎1000 L去离子水中含NaHCO375 g,海盐 18 g和 CaSO48.4 g,水温28~29℃,pH值约7.2,总硬度62m g·L-1(以CaCO3计),电导率485 μS,光照/黑暗周期为14 h/10 h。斑马鱼胚胎由E3培养液培养,E3培养液亦按照上述Brand等[8]方法配制:每1000 L去离子水中含NaCl292.5 g,KCl12.67 g,CaCl236.63 g和,MgSO439.6 g,并用NaHCO3溶液调pH值至7.2,电导率600μS,斑马鱼胚胎置于生化恒温培养箱中,温度控制在28~29℃,光照/黑暗周期为14 h/10 h。
1.3 斑马鱼幼鱼AlCl3暴露实验
AlCl3水中易发生水解,用 0.1mmol·L-1稀盐酸溶解,加水配制成1 g·L-1的母液备用,实验前用E3培养液稀释成 50,100和150 μg·L-1,调 pH 至5.8[9-10]。选取受精3 d且表型正常的斑马鱼幼鱼,随机分为AlCl30(正常对照),50,100和150 μg·L-1组,分别用100 mm培养皿培养,每皿放入50条幼鱼和含不同浓度AlCl3的E3培养液10m L,置生化恒温培养箱中分别暴露48,72和96 h。实验重复3次。
1.4 斑马鱼幼鱼运动行为测定
AlCl3暴露后,每组随机选取8条斑马鱼幼鱼置于96孔平板中,每孔1条。将96孔平板放入Noldus视频采集系统观测平台,采用Ethovision XT10.0软件追踪采集3m in内斑马鱼幼鱼的自发运动路线图,并计算各组总移动距离和平均运动速度。实验重复3次。
1.5 HE染色检测斑马鱼幼鱼眼组织病理变化
AlCl3暴露48,72和96 h后,随机选取正常对照和AlCl3150μg·L-1暴露组的斑马鱼幼鱼各6条,置4%多聚甲醛溶液中固定,制成石蜡切片(5μm),HE染色,显微镜观察眼组织病理变化。
1.6 斑马鱼幼鱼体内活性氧(reac tive oxygen species,ROS)的检测[11]
每组取10条幼鱼放入1.5 m L离心管中,用预冷的PBS(pH值7.4)洗涤2次,然后在预冷的缓冲液(蔗糖 0.32 mmol·L-1,HEPES 20 mmol·L-1,MgCl21 mmol·L-1和苯甲基磺酰氟 0.5 mmol·L-1,pH值7.4)中研磨均匀。15 000×g,4℃下离心20 m in,将上清液转移到新的离心管中待用。分别取20μL上清液于96孔板中,室温下放置5 m in,接着每孔加入100 μL PBS(pH 7.4)和8.3 μLDCFHDA原液(DMSO溶解,10 g·L-1),37℃温育30 m in。最后,用多功能酶标仪(激发光485 nm,发射光530 nm)测定荧光强度,以反映ROS浓度(单位:kDCF·g-1蛋白质)。实验重复3次。
1.7 荧光定量PCR测定斑马鱼血脑屏障及神经相关基因m RNA水平
每组各取30条斑马鱼幼鱼置于1.5m L离心管中,按总RNA提取试剂盒说明书提取总RNA。以总RNA为模板,逆转录合成cDNA,按照逆转录试剂盒的操作说明书进行。荧光定量PCR反应体系20μL:SYBR Mix 10 μL,无 RNA 酶水 6.8 μL,上 下 游 引 物(表1)各0.6 μL,cDNA 2 μL。反应条件为:94℃,5m in;94℃,30 s;60℃,30 s;40个循环。反应结束后,用LightCycler®96 Application Software软件对实时荧光定量PCR反应的结果进行分析。以β-肌动蛋白(β-actin)为内参,2-ΔΔCt法计算mRNA相对表达水平。

Tab.1 Prim er sequence for quan titative reverse transcrip tion-po lym erase chain reac tion(qPCR)
1.8 统计学分析
2 结果
2.1 A lCl3对斑马鱼幼鱼运动行为的影响
AlCl3暴露48 h时,各组斑马鱼幼鱼的运动情况相似;而暴露72和96 h时,与正常对照组相比,AlCl3暴露组斑马鱼幼鱼运动情况有所不同,部分个体存在运动轨迹杂乱,甚至停滞不动。如图1所示,与正常对照组相比较,AlCl3暴露48 h,AlCl3暴露组的斑马鱼幼鱼都出现了移动距离变短和移动速度降低的情况。其中,在AlCl350和100μg·L-1组斑马鱼幼鱼移动距离和移动速度无统计学意义,AlCl3150μg·L-1组具有极显著差异(P<0.01)。而在AlCl3暴露72和96 h,各浓度组斑马鱼幼鱼的游动距离和速度相比正常对照组都出现明显下降(P<0.01)。提示长期高浓度AlCl3的暴露可导致斑马鱼幼鱼运动障碍。
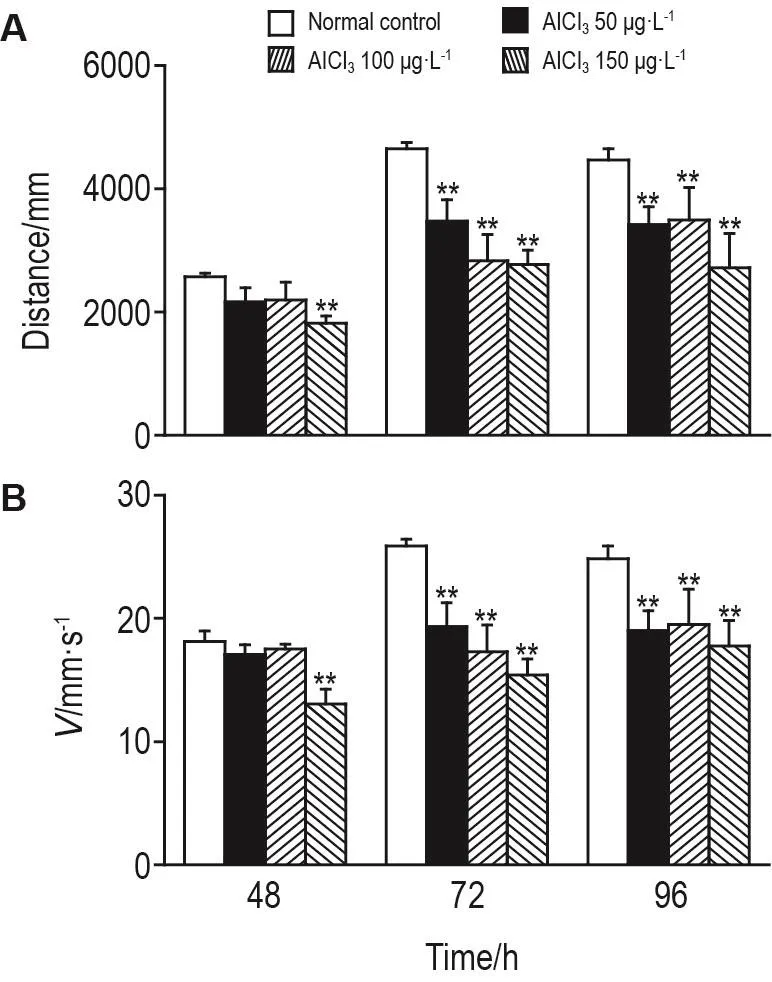
Fig.1 Effect of AlCl3 on m ovement d istance(A)and speed(B)of zeb rafish larvae.The locom otor activity of zebrafish larvae was recorded by Noldus Tracking System for 3 min.x±s,n=24.**P<0.01,compared with normalcontrolgroup.
2.2 A lCl3对斑马鱼幼鱼眼组织病理结构的影响
病理结果显示,与正常对照组相比,AlCl3暴露组斑马鱼幼鱼眼晶状体、神经节细胞、内网层、内核层和视网膜色素层各部分的结构均保持完整,未出现明显的组织病理损伤(图2)。提示AlCl3暴露对斑马鱼幼鱼的视觉可能无明显影响。
2.3 A lCl3对斑马鱼幼鱼体内ROS水平的影响
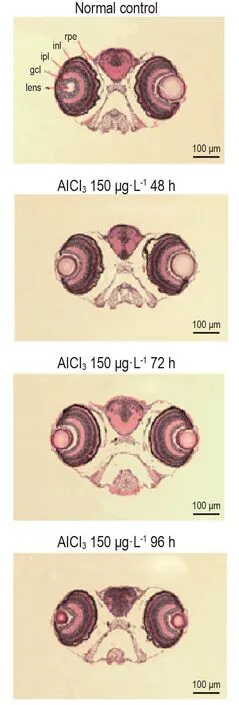
Fig.2 Effect of A lCl3 on histopatho logical changes in zebrafish larvae eyes by HE staining.Rpe:retinal pigment epithelium layer;inl:inner nuclear layer;ipl:inner plexiform layer;gcl:ganglion cell layer.
与正常对照组比较,AlCl3暴露48 h,100和150μg·L-1组斑马鱼幼鱼体内ROS显著升高(P<0.05,P<0.01);暴露72 和96 h,各浓度组的ROS水平均显著增加(P<0.01)(图3)。
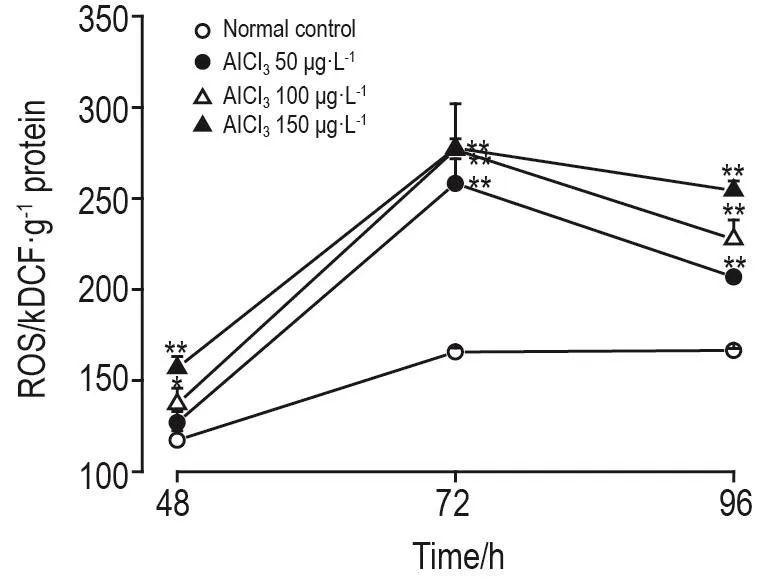
Fig.3 Effect of AlCl3 on levelof reactive oxygen species(ROS)in zeb rafish larvae.,n=10.*P<0.05,**P<0.01,compared with norm alcontrolgroup.
2.4 A lCl3对血脑屏障及神经相关基因m RNA表达的影响
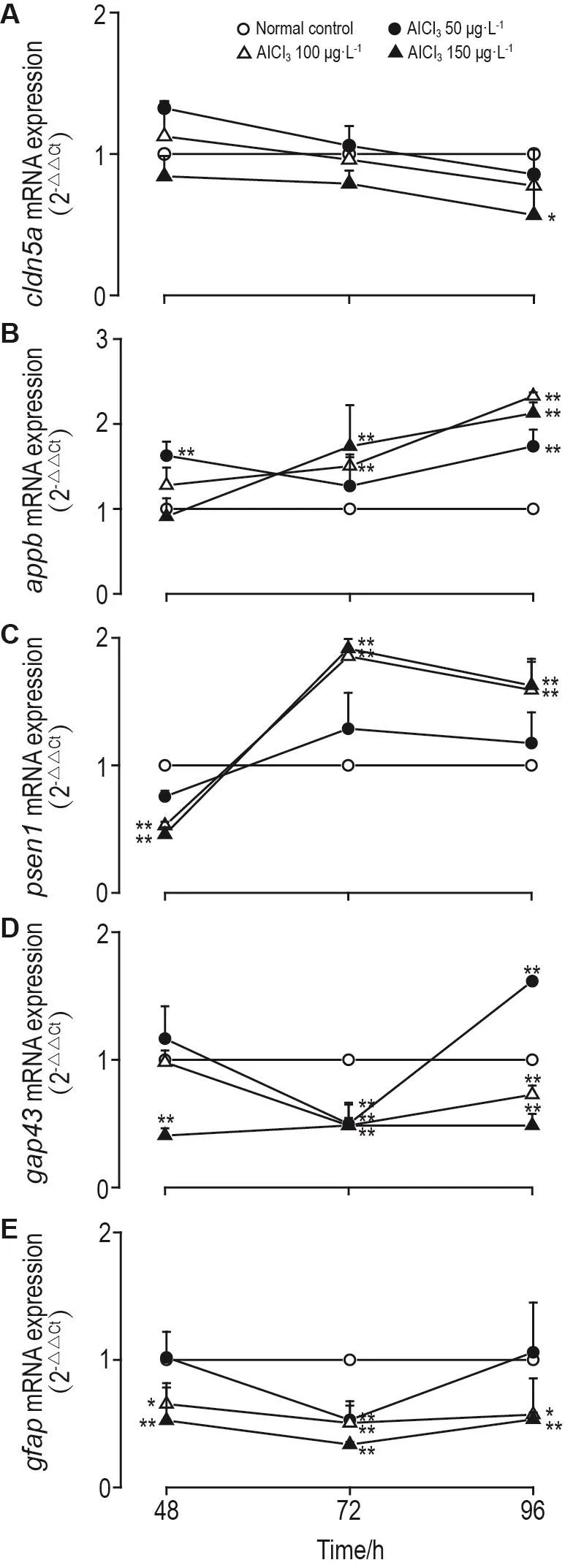
Fig.4 Effect of AlCl3 on m RNA expression of genes related to b lood-brain barrier and nervous system in zebrafish larvae by quantitative po lym erase chain reaction(qPCR).,n=30.*P<0.05,**P<0.01,com pared with norm a lcontro lgroup.
如图4A所示,与正常对照组相比,AlCl3暴露48 h,50 μg·L-1组淀粉样前体蛋白b(amyloid precursor protein b,appb)m RNA表达明显升高(P<0.01),密封蛋白5a(claudin 5a,cldn5a)、早老素1(presenilin 1,psen1)、生长相关蛋白43(grow th-associated protein 43,gap43)和胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,gfap)m RNA表达变化不明显;100μg·L-1组psen1和gfap mRNA表达显著下调(P<0.01,P<0.05);150 μg·L-1组psen1,gap43和gfap m RNA水平明显降低(P<0.01),cldn5a和appb表达无显著变化。AlCl3暴露72 h,50 μg·L-1组gap43和gfap m RNA表达明显降低(P<0.01),而cldn5a,appb和psen1m RNA表达变化不明显;100和150 μg·L-1组appb和psen1 mRNA表达显著升高(P<0.01),gap43和 gfap m RNA表达明显降低(P<0.01),而cldn5a表达无显著变化。AlCl3暴露96 h,50 μg·L-1组appb和gap43 mRNA表达显著升高(P<0.01);100 μg·L-1组appb和psen1 mRNA表达显著升高(P<0.01),gap43和gfap m RNA表达明显降低(P<0.01,P<0.05),cldn5a表达下调不显著;150 μg·L-1组appb和psen1 m RNA表达显著升高(P<0.01),cldn5a,gap43和gfap m RNA表达明显降低(P<0.01,P<0.05)。提示长期高浓度AlCl3暴露可导致斑马鱼appb和psen1表达上调以及cldn5a,gap43和gfap表达下调。
3 讨论
铝是人类生活中不可或缺的物质,但大量的铝进入人体会对机体产生毒害作用。国家标准规定食品中铝含量不要超过100 mg·kg-1,但现实生活中食品铝含量超标现象普遍存在。此外,铝相关产业及环境周边区域铝含量往往较高,经检测从事铝职业工作人员血铝浓度高达50μg·L-1以上,且认知功能出现变化[12]。铝对神经系统产生毒害作用已得到证实,但对发育期儿童的神经毒性如何却鲜有报道。本文利用酸性AlCl3暴露处理斑马鱼幼鱼研究铝对神经系统的毒性作用。
行为学检测结果发现,铝暴露后斑马鱼幼鱼运动速度变慢、运动距离变短,表明铝对斑马鱼幼鱼运动行为产生了影响,这与神经疾病的一些行为表现极为相似[13]。病理观察结果显示,铝暴露对斑马鱼幼鱼眼球组织结构无明显损伤,提示铝暴露产生的行为变化可能与视觉并无直接关系。本研究还发现,AlCl3暴露组斑马鱼幼鱼体内ROS水平明显升高,而ROS的增加往往会引起线粒体功能的丧失、金属离子动态平衡的改变以及降低抗氧化防御,直接影响神经元的突触活动和神经递质传递,进而导致认知及运动功能障碍[14],表明ROS过量产生可能是导致斑马鱼幼鱼行为异常的原因之一。此外,已有文献报道,铝能渗透血脑屏障进入大脑[15],在整个脑内积累,特别是海马区[16];可能导致神经元凋亡[17]、Aβ异常沉积[18]和神经炎症[19],最终造成学习记忆及运动行为的改变。但对于铝通过血脑屏障进入脑内的机制尚不清楚,因此本研究从构成血脑屏障主要的紧密连接相关蛋白密封蛋白(claudin)的基因表达入手,发现cldn5a mRNA水平在低浓度AlCl3暴露时变化并不明显,但在高浓度长时间作用下明显降低。而紧密连接相关蛋白家族表达下调,会引发紧密连接结构疏松,基膜结构破坏,内皮细胞皱缩,使血脑屏障作用减弱[20],使铝离子入脑。另外,本研究从Aβ蛋白和神经发育方面研究发现,长期高浓度AlCl3暴露的斑马鱼幼鱼appb和psen1 m RNA水平明显上调,gap43和gfap m RNA水平明显下调。psen1可调控γ分泌酶的合成,引起Aβ沉积,而Aβ具有较广泛的细胞毒性,是阿尔茨海默病致病的主要因素之一[21-22];gap43主要表达在再生轴突生长圆锥部位,对神经纤维生长、发育、再生及突触功能维持和递质释放都起重要作用[23];gfap是星形胶质细胞的骨架中间丝蛋白和专门的中枢神经系统表达蛋白,其基因表达下调反映星形胶质细胞处于非活化和非分裂状态,表明神经细胞再生与神经组织修复可能处于抑制状态[24]。
综上,本研究结果证实,AlCl3暴露可抑制斑马鱼幼鱼的运动行为,其机制可能与促进体内ROS水平升高,影响血脑屏障及神经发育相关基因表达有关,为研究铝致神经毒性作用机制提供了理论依据。

