探讨内科胸腔镜与胸水癌胚抗原检测在不明原因胸腔积液中的诊断价值
吴淑红 荣福 欧阳雁弟
胸膜和胸腔疾病是呼吸科的常见问题, 胸腔积液则是最常见的表现, 而胸腔积液的病因繁多, 其中以肿瘤、结核、炎症最为常见, 其他还见于心功能不全、低蛋白血症等。常规胸腔穿刺术行胸水生化等检查可达到近75%的诊断率[1],近年, CEA的检测也广泛应用于临床, 而内科胸腔镜操作简单、安全, 是一种效的微有创诊疗手段, 也是诊断胸腔积液病因的重要手段[2]。本文通过分析160例不明原因胸腔积液患者的胸水CEA值, 结合内科胸腔镜胸膜活检病理结果, 评价其在不明原因胸腔积液中的诊断价值。现报告如下。
1 资料与方法
1.1 一般资料 收集本院2014年1月~2017年7月收治的160例不明原因胸腔积液患者, 其中男102例, 女58例, 年龄18~80岁, 平均年龄(47.50±18.90)岁, 均为单侧胸腔积液, 所有患者均完善胸水常规、生化、胸水CEA检查, 按照Light标准判断为渗出液, 且经影像学检查及胸水实验室检查未能确诊病因。该研究已经经相关医学伦理委员会批准。
1.2 方法
1.2.1 器械 CEA检测使用东槽AIA1800全自动免疫分析仪免疫荧光法检测, 试剂为配套提供。检查胸腔镜为Olympus公司生产BF-240型, 其他包括活检钳(康进医疗器械, 型号FB-A-1)、胸腔闭式引流套管(广州市凌捷医疗器械有限公司, W型)及引流瓶(苏州晶乐高分子医疗器械有限公司, Ⅱ型)等。
1.2.2 术前准备 术前常规进行血常规、凝血功能、心电图、B超胸水定位检查, 并行人工气胸术, 人工气胸术后予行健侧卧位水平投射体位的胸片检查。
1.2.3 操作过程 术前30 min肌内注射哌替啶(人福医药集团股份公司)50~75 mg, 静脉推注咪达唑仑咪达唑仑注射液(江苏恩华药业股份有限公司, 国药准字H19990027)3 mg, 患者取健侧卧位, 常规选择患侧腋前线至腋后线第4~7肋间,若胸片见胸膜粘连明显, 可根据胸片人工气胸位置选择切口。常规消毒铺巾, 予2%利多卡因于切口处行浸润麻醉, 并于切口点平行肋骨方向切开皮肤1.0~1.5 cm, 用止血钳钝性分离胸壁至壁层胸膜, 然后垂直插入套管针, 取出针芯后插入胸腔镜观察。抽吸部分胸水至胸膜腔良好暴露, 镜下按照一定顺序, 肺表面、肋胸膜、膈胸膜、肋膈窦均详细观察, 发现异常病灶要仔细观察部位、质地、大小等, 并进行多处多次活检3~4次。术后留置胸腔闭式引流管继续持续引流, 并观察是否会出现出血、复张性肺水肿、胸痛等不良反应。
1.3 观察指标及判定标准 观察胸腔镜下的胸膜表现及良恶性胸腔积液的特征, 并多次活检取得胸膜病理标本, 胸膜病理结果为确诊诊断标准。胸水CEA正常范围为0~5 μg/ml,CEA含量>5.0 μg/ml为阳性判定标准。判定胸水CEA诊断恶性胸腔积液的敏感性、特异性、PPV及NPV。
1.4 统计学方法 采用SPSS22.0统计学软件进行数据统计分析。计量资料以均数±标准差()表示, 采用t检验;不满足正态分布的计量资料采用中位数和四分位数表示, 采用Mann-Whitney U检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 160 例患者胸腔镜下病理活检结果 非恶性胸腔积液122例, 其中结核性胸膜炎102例, 炎症性胸腔积液20例(脓胸4例, 肺炎旁胸腔积液 16例);恶性胸腔积液38例, 其中鳞癌2例, 腺癌35例, 恶性淋巴瘤1例。
2.2 不同病因胸膜病变的镜下表现
2.2.1 恶性胸腔积液 表现多为胸膜广泛分布的大小不均匀的结节影, 可呈菜花状、葡萄状, 部分可融合, 可伴有胸膜粘连, 部分可表现为充血、水肿或弥漫性小结节。胸腔积液多为血性, 部分为黄色胸腔积液。见图1。
2.2.2 结核性胸膜炎 最常见的表现为壁层及脏层胸膜见多发的粟粒样小结节, 部分患者仅见胸膜弥漫性充血、水肿,胸膜粘连, 胸腔积液多为草绿色及黄色。见图2。
2.2.3 炎症性胸腔积液 多见脏层及壁层胸膜充血水肿,部分可见胸膜粘连, 脓性的患者胸腔镜下可见脓苔形成, 粘连严重, 胸膜明显增厚。见图3, 图4 。

图1 恶性胸腔积液胸膜转移镜下表现:A:胸膜广泛分布的小结节;B:胸膜弥漫性充血、水肿;C:胸膜广泛分布大小不均匀的结节影, 呈菜花样
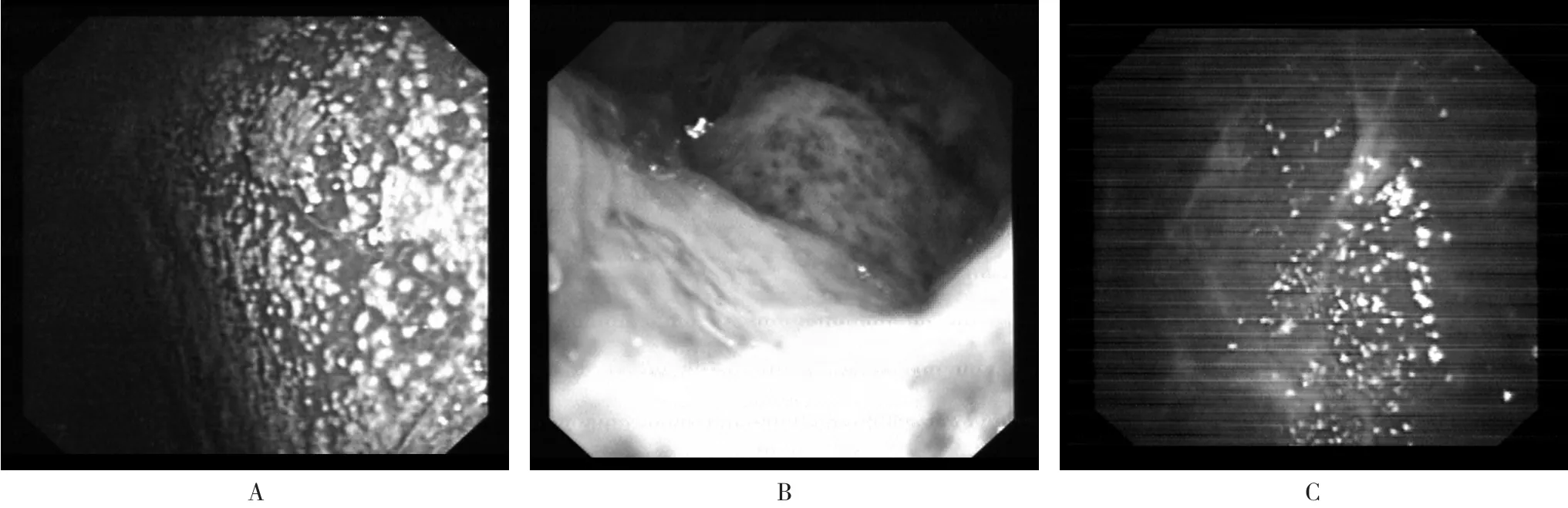
图2 结核性胸膜炎镜下表现:A:胸膜多发粟粒样小结节;B:胸膜广泛粘连;C:胸膜弥漫性充血、水肿, 胸膜粘连

图3 炎症性胸腔积液的镜下表现:A:胸膜充血水肿;B、C:胸膜充血及粘连
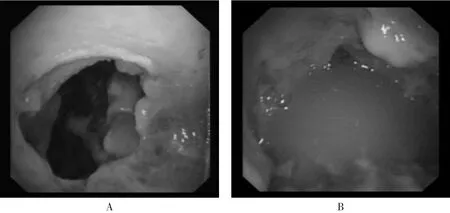
图4 脓胸的镜下表现:A、B均表现为胸膜明显增厚, 脓苔形成, 粘连严重
2.3 恶性胸腔积液与非恶性胸腔积液(结核性胸腔积液、炎症性胸腔积液)胸水CEA的水平比较 160例胸腔积液患者均完善胸水CEA检测, 恶性胸腔积液患者的CEA水平为105.95(16.60, 903.75)μg/ml, 非恶性胸腔积液患者的 CEA水平为1.60(1.10, 2.70)μg/ml, 恶性胸腔积液患者的CEA水平明显高于非恶性胸腔积液, 差异有统计学意义(Z=7.880, P<0.05)。胸水CEA诊断恶性胸腔积液的敏感性、特异性、PPV、NPV分别为86.8%、86.9%、67.3%、95.5%。见表1。

表1 胸水CEA对恶性胸腔积液的诊断价值(%)
3 讨论
内科胸腔镜可以直视胸膜, 能观察脏层胸膜、壁层胸膜、肺部表面和肋胸膜、膈胸膜、肋膈窦, 并且可以直视下行胸膜多处活检, 提高了活检的准确性, 相比胸水细胞学检查和闭式胸膜活检, 能改善胸腔积液诊断的精确性[3,4]。内科胸腔镜在不明原因胸腔积液的诊断阳性率, 各文献报道不一, Casal等[5]报道可达到90%, 国内也有作者显示内科胸腔镜检查的阳性率达到81.9%~92.3%[6,7], 本研究中内科胸腔镜检查的阳性率为100.0%。内科胸腔镜诊断的阳性率比闭式胸膜活检高, 并发症发生率低[8]。因此对于两次胸腔积液细胞学检查无结果的患者, 2010年英国胸科协会指南[9]推荐,若无禁忌证, 应积极行内科胸腔镜或者是经皮胸膜活检组织检查。
本研究发现, 胸腔积液最常见的原因为胸膜转移瘤及结核性胸膜炎, 其中胸膜转移瘤为38例(23.75%), 结核性胸膜炎为102例(63.75%), 与山东省立医院呼吸科报道有所不同,其研究当中, 2380例胸腔积液患者, 胸膜转移瘤占1338例(56.2%), 结核性胸膜炎514例(21.6%)[10]。胸腔积液诊断的过程当中, 鉴别胸腔积液的良恶性非常重要[11]。本研究发现, 胸水CEA诊断恶性胸腔积液的敏感性、特异性、PPV、NPV分别为86.8%、86.9%、67.3%、95.5%。恶性胸腔积液患者的CEA水平明显高于非恶性胸腔积液, 差异有统计学意义(P<0.05)。对于不能接受或者不能耐受胸腔镜的患者, 检测胸腔积液中的CEA值是鉴别良恶性胸水的有效手段。
CEA是一种富含多糖的蛋白复合物, 分子量大, 一旦在闭合的胸腔中产生, 就不易进入血液循环, 胸膜原发及转移的肿瘤细胞产生CEA后则聚集在胸腔积液中, 测定胸水中的CEA比血CEA更有意义[12]。在本研究当中, 胸水CEA对恶性胸腔积液诊断的敏感性为86.8%, 特异性为86.9%, 是诊断恶性胸腔积液最好的标志物之一[13], 且谢昭宁等[14]报道, 对比胸腔积液中的CA125、CA199等肿瘤标志物, 胸水CEA的敏感性及特异性也是最高的。而CEA的阳性阀值仍需要进一步探讨, 需要收集更多的临床数据分析。有报道[15]CEA的阳性阀值为23.152 μg/ml时, CEA的特异性达100%。同时, 本研究发现, 4例脓胸患者胸水中的CEA也有所增高,与谢昭宁等[14]报道相似, 对于脓性的胸水若出现胸水CEA高,则不一定是恶性胸腔积液, 需要结合其他资料再做出判断。
综上所述, 内科胸腔镜检查操作简单, 并发症的发生率低, 耐受性高, 且阳性率高, 对不明原因胸腔积液, 特别恶性胸腔积液及结核性胸腔积液的诊断及鉴别诊断有重要的应用价值, 同时还可减少患者胸膜粘连, 促进肺功能恢复。检测胸腔积液中的CEA, 有较高的敏感性和特异性, 是鉴别良恶性胸腔积液的重要指标, 并提供重要的参考价值, 对于不能耐受内科胸腔镜的患者, 联合胸水CEA检查等是一种较好的鉴别良恶性胸水的诊断方法。由于本组样本仅160例, 今后有必要继续扩大样本量, 进行多中心的研究, 以进一步确立恰当的诊断阈值。

