人参皂苷对脑缺血再灌注损伤星形胶质细胞增殖的影响及机制
任德启 孟 毅 郑伟峰 关东升 崔应麟
(河南省中医院脑二病区,河南 郑州 450000)
脑血管病具有高发病率、高致残率、高死亡率的特点,其中最为常见的是缺血性脑血管疾病〔1〕。脑缺血发生后,可引起机体发生一系列的变化,包括葡萄糖和氧气供应中断、线粒体功能障碍、酸中毒、氧化应激、炎症等,最终使神经元死亡〔2〕。在治疗缺血性脑血管疾病时经常采用再灌注的方法,但会引起脑缺血再灌注损伤〔3〕。研究显示,星形胶质细胞在保护神经元和脑损伤修复过程中发挥重要作用,例如产生抗氧化物质谷胱甘肽、分泌神经营养因子、促红细胞生成素等〔4〕。实验发现人参皂苷对大鼠大脑中动脉缺血引起神经元死亡具有阻止作用〔5〕。本实验旨在研究人参皂苷对体外培养的脑缺血再灌注损伤星形胶质细胞增殖、凋亡、活性氧(ROS)的影响及作用机制。
1 材料与方法
1.1材料 出生1~3 d的SD大鼠购自上海凯学生物科技有限公司;DMEM/F-12培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司;人参皂苷购自浙江亚克药业有限公司;Cell Counting Kit-8 (CCK-8试剂盒)、Annexin V-FITC细胞凋亡检测试剂盒均购自上海碧云天科技有限公司;B细胞淋巴瘤/白血病(Bcl)-2一抗、Bcl-2相关X蛋白(Bax)一抗、细胞周期蛋白(Cyclin)D1一抗、甘油醛-3-磷酸脱氢酶(GAPDH )一抗、辣根过氧化物酶标记的二抗均购自美国Sigma公司。
1.2细胞的分离与培养 在无菌条件下分离出SD大鼠脑组织,立即用冰冷的解剖液清洗去除残留血液,显微镜下分离出大脑皮质,眼科剪剪成1 mm3左右的碎块,玻璃吸管反复吹打,加入0.25%的胰酶常温下消化20 min,反复4次,离心,弃上清,将洗涤后的星形胶质细胞制成单细胞悬液,接种于含10%胎牛血清(FBS)和双抗的细胞培养瓶中,置于37℃、5%CO2培养箱中培养,每天观察细胞生长状态,每2~3 d更换一次培养基,待细胞融合度达到80%左右时,胰酶消化传代。待对数期细胞的纯度达到90%可用于后续实验。
1.3星形胶质细胞缺血再灌注损伤模型的建立 将细胞浓度调整为1×105/ml接种于96孔板中,采用无糖DMEM培养基培养,将其放入恒温培养箱中,充入5%CO2、1%O2、94%N2培养2 h,然后将培养基更换为含有10% FBS的高糖培养基,放入37℃、5%CO2培养箱中继续培养4 h,即为缺血再灌注模型。
1.4实验分组和药物干预 取100 μl 1×105/ml的细胞接种于96孔板中,37℃、5%CO2培养箱中培养24 h,分别加入5、10、20、40、80 μg/ml的人参皂苷,每孔5个复孔,放入37℃、5%CO2培养箱中培养3 d。实验分为3组:对照组为未经处理的细胞;模型组为缺血再灌注细胞,不加药物处理;给药组为缺血再灌注细胞,分别加入人参皂苷。
1.5噻唑蓝(MTT)法检测细胞增殖 取1×105个各组对数期细胞接种于96孔板中,培养48 h,每孔5个复孔,根据试剂说明书进行实验,加入500 μl MTT溶液,37℃孵育4 h,直至出现结晶紫后终止实验,在570 nm波长下记录各孔的吸光值(OD值)。
1.6流式细胞仪检测细胞凋亡 取对照组、模型组、给药组(20 μg/ml)细胞培养48 h,0.25%胰蛋白酶消化,离心收集细胞,调整细胞浓度1×106/ml,加入5 μl Annexin V-FITC,避光条件下置于37℃下孵育30 min,加入5 μl碘化丙啶(PI),避光反应5 min。置于流式细胞仪检测细胞凋亡率。
1.7ROS检测 对照组、模型组、给药组(20 μg/ml)对数期细胞密度调整为1×105/ml接种于6孔培养板,分组处理后,磷酸盐缓冲液(PBS)清洗2次,离心,弃上清,加入10 μmol/L DCFH-DA悬浮细胞,常温下避光反应30 min,PBS清洗2次,上流式细胞仪检测细胞内ROS的水平。
1.8Western印迹检测细胞中Bcl-2、Bax、CyclinD1蛋白表达 收集对照组、模型组、给药组(20 μg/ml)细胞,加入0.5 μmol蛋白酶抑制剂,振荡混合均匀,置于冰上反应10 min,16 000 r/min离心10 min,所得上清即为所需蛋白,根据聚氰丙烯酸正丁酯(BCA)试剂说明书检测蛋白浓度。在蛋白样品中加入4倍体积的5×十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)蛋白缓冲液,100℃煮沸10 min。配制10%分离胶和5%浓缩胶加入玻璃板中,置于电泳池中,80 V电泳20 min,然后120 V电泳至溴酚兰到达分离胶底部,停止电泳。将SDS-PAGE 120 V电压转膜150 min,取出转膜后的硝酸纤维素膜,使用5%脱脂奶粉置于摇床上封闭60 min,PBST清洗3次×5 min,加入提前稀释的一抗,4℃冰箱中孵育过夜,然后37℃恒温箱中复温,PBST清洗3次×5 min,加入辣根过氧化物酶标记的二抗,37℃下孵育60 min,PBST清洗3次×5 min,滴加电化学发光(ECL)发光液,暗室中曝光,加入显影液和定影液,晾干胶片,Image J软件分析目的蛋白表达水平。
1.9统计学分析 采用SPSS22.0统计软件进行单因素方差分析和t检验。
2 结 果
2.1不同浓度人参皂苷对细胞增殖的影响 与对照组(0.684±0.076)相比,模型组细胞OD值(0.340±0.021)显著降低(t=7.557,P=0.002),人参皂苷只有20 μg/ml时OD值(0.882±0.083)显著高于对照组(t=3.047,P=0.038),与模型组相比,给药组细胞OD值显著增高(F=20.384,P=0.000),其中5 μg/ml时0.709±0.075,10 μg/ml时0.747±0.068,40 μg/ml时0.721±0.090,80 μg/ml时0.715±0.058,20 μg/ml为人参皂苷的最佳给药量,后续实验均以20 μg/ml人参皂苷为实验对象。
2.2人参皂苷对细胞凋亡的影响 与对照组(10.356%±1.428%)相比,模型组和给药组细胞凋亡率(42.486%±6.753%,20.145%±4.657%)显著增高(t=8.063,3.481;P=0.001,0.025);与模型组相比,给药组显著降低(t=4.717,P=0.009)。
2.3人参皂苷对ROS水平的影响 与对照组(100.036%±0.012%)相比,模型组和给药组ROS的表达量(254.353%±6.879%,150.521%±10.639%)显著增加(t=15.835,8.219,P=0.000,0.001),与模型组相比,给药组显著降低(t=9.014,P=0.001)。
2.4人参皂苷对细胞中Bcl-2、Bax、CyclinD1蛋白水平的影响 与对照组相比,模型组和给药组Bcl-2(t=11.357,3.130;P=0.000,0.035)、CyclinD1(t=10.880,6.574;P=0.000,0.003)蛋白表达量显著降低,Bax蛋白表达量显著升高(t=7.715,5.626;P=0.002,0.005);与模型组相比,给药组Bcl-2、CyclinD1蛋白表达量显著升高(t=10.212,4.545;P=0.001,0.011),Bax蛋白表达量显著降低(t=3.656,P=0.022)。见图1,表1。
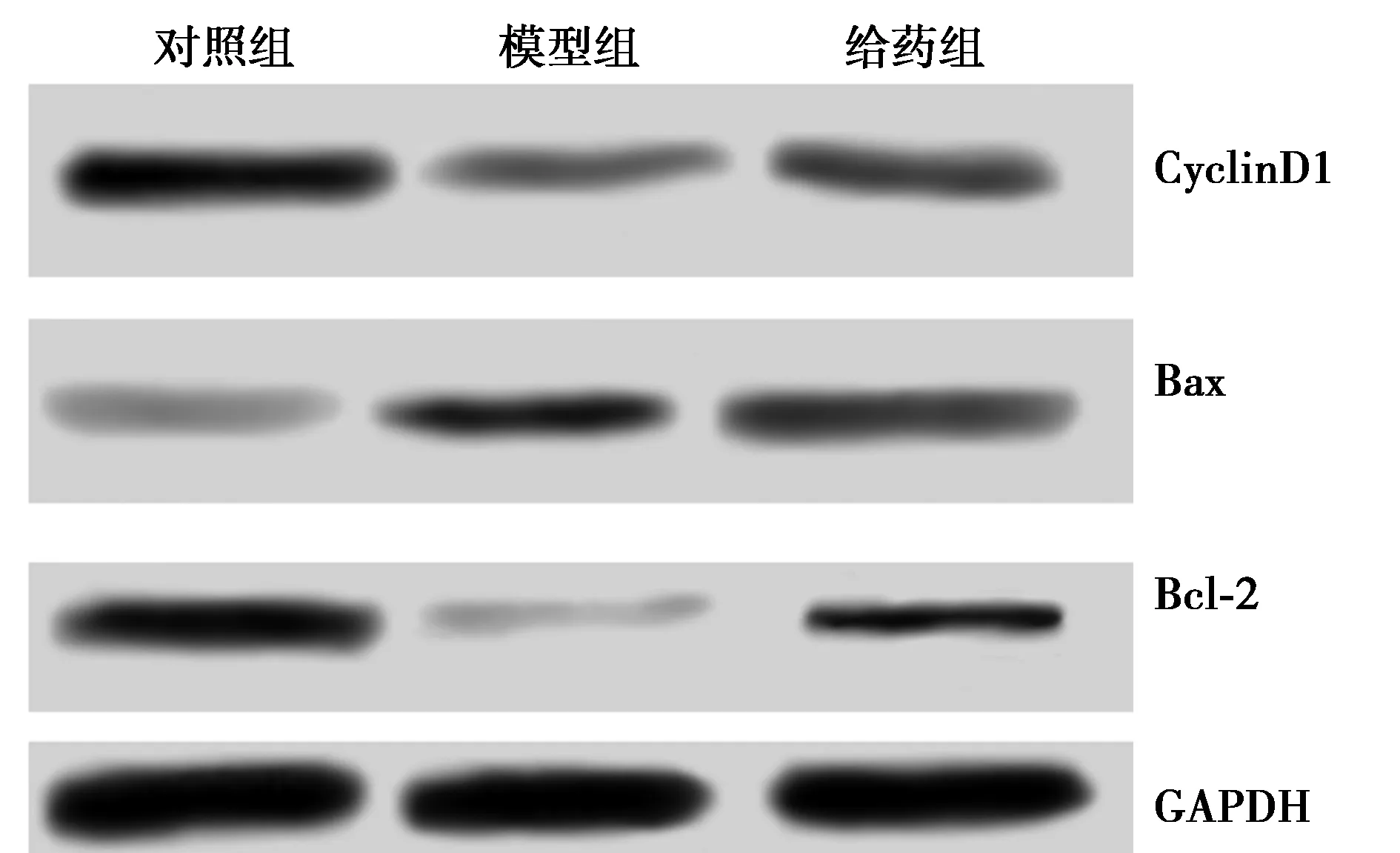
图1 人参皂苷对细胞中Bcl-2、Bax、CyclinD1蛋白水平的影响

组别Bcl-2BaxCyclinD1对照组0.765±0.0730.285±0.0160.822±0.069模型组0.272±0.0181)0.553±0.0581)0.361±0.0251)给药组0.602±0.0531)2)0.410±0.0351)2)0.503±0.0481)2)
与对照组比较:1)P<0.05;与模型组比较:2)P<0.05
3 讨 论
临床上最常见的脑血管疾病是缺血性脑血管病变〔6〕。脑缺血再灌注能够引起神经中毒、组织出血、氧化损伤、炎症反应、胶质细胞坏死等,严重影响患者的预后〔7〕。研究表明,星形胶质细胞对脑缺血再灌注损伤过程中的神经功能恢复具有积极或消极的作用〔8〕。星形胶质细胞是神经细胞中数量较多的一类细胞,对神经元功能的维持、神经细胞内pH值和体液平衡、离子浓度、血流量具有重要作用,参与新陈代谢、形成血脑屏障等生物学作用〔9〕。大量研究表明,星形胶质细胞在脑缺血再灌注损伤中的细胞内产生一定量的功能因子,如多种功能的神经营养因子、细胞因子,当细胞的通透性增强时,这些因子以胞吐等形式进入细胞液中,发挥对神经元的保护作用〔10,11〕。研究表明以天麻和钩藤(主要成分为天麻素和钩藤碱)为主的中药制剂对脑缺血再灌注4 h的星形胶质细胞的存活率具有一定保护作用,说明某些中药可缓解脑缺血再灌注损伤导致的星形胶质细胞的凋亡作用〔12〕。拟人参皂苷在大鼠脑缺血组织损伤的病理过程中,可减小脑梗死的面积,增强抗氧化能力〔13〕,但其具体的作用机制不太清楚。本实验结果发现脑缺血再灌注损伤促进星形胶质细胞凋亡,抑制其增殖,人参皂苷对星形胶质细胞具有一定的保护作用。
细胞凋亡是正常细胞为维持内环境稳定而发生的自主、有序性死亡,受多种基因的调控,如Bcl-2、Bax、CyclinD1等〔14〕。凋亡相关基因的变化在细胞凋亡中起重要作用。Bcl-2基因表达量升高可抑制细胞的凋亡,是一种抑制凋亡的癌基因;Bax表达水平的升高可促进细胞的凋亡,是一种促细胞凋亡基因〔15〕。 在调节细胞凋亡的过程中,Bcl-2和Bax可形成二聚体而发挥作用〔16〕。CyclinD1是一种原癌基因,调控细胞的生长、分化过程,通过与CDK6结合形成复合物,促进细胞有丝分裂从G1期向S期转变,缩短细胞周期,从而促进细胞增殖〔17〕。ROS参与细胞氧化应激过程是脑缺血再灌注损伤的重要机制之一,正常状态下,机体内的ROS含量处于动态平衡状态,但当机体受到异常刺激时,如再灌注时机体内的分子氧大量增加,ROS大量产生,超出机体的清除能力,导致ROS在细胞内累积并释放细胞毒,诱导细胞凋亡〔18〕。所以ROS的产生是脑缺血再灌注损伤的一个重要过程。本实验结果发现,脑缺血再灌注损伤使星形胶质细胞中ROS、Bax的含量显著增加,Bcl-2、CyclinD1的表达量显著降低,但人参皂苷可逆转再灌注损伤的作用。
综上,脑缺血再灌注损伤可促进星形胶质细胞凋亡,抑制其增殖,但人参皂苷具有抗星形胶质细胞再灌注损伤的作用,其作用机制可能是通过调节细胞内氧化应激、凋亡相关蛋白的表达来发挥作用。

