蔬菜菌核病菌对氟吡菌酰胺的敏感性及防病应用潜力评估
黄学屏,宋昱菲,罗健,赵时峰,慕卫,刘峰
(1山东农业大学植物保护学院/山东省蔬菜病虫生物学重点实验室/山东省高校农药毒理与应用技术重点实验室,山东泰安 271018;2莘县农业局,山东莘县 252400)
0 引言
【研究意义】菌核病是由核盘菌(Sclerotinia sclerotiorum)引起的一种世界性植物病害。由于该菌寄主范围广,可侵染全球75科270属的400多种作物,同时能够产生抗逆能力超强的菌核从而拥有较强的逆境存活力,加之作物抗病品种选育困难等,导致该病呈加重发展趋势[1-3]。在我国,菌核病是长江中下游油菜产区的主要病害[4];近年来,随着连作年限的延长,该病在山东部分番茄、茄子、辣椒等设施蔬菜产区逐渐成为影响蔬菜产量和品质的重要病害。目前,生产上主要使用杀菌剂防治菌核病,但登记品种少,常用药剂包括苯并咪唑类(如多菌灵)和二甲酰亚胺类(如菌核净)等,但由于长期单一使用这些药剂,病原菌已经产生了不同程度的抗药性[5-7],因此亟需筛选新型杀菌剂。【前人研究进展】琥珀酸脱氢酶抑制剂类(SDHI)杀菌剂作用于菌体线粒体上的电子传递链蛋白复合体II,通过抑制琥珀酸脱氢酶(SDH)的活性,影响病原菌呼吸链上的电子传递,抑制呼吸,阻断能量代谢,从而抑制病原菌生长[8-9]。目前,该类药剂在多种病原菌的防治上发挥着重要的作用[10]。由巴斯夫公司开发的新型烟酰胺类内吸性杀菌剂啶酰菌胺,被广泛应用于水果及蔬菜上的灰霉病。WANG等[11]研究发现,啶酰菌胺对油菜菌核病也具有较高的防治效果,该药剂250 g a.i./hm2处理对油菜菌核病的田间防治效果为75.10%。此外,由先正达公司开发的新型SDHI类杀菌剂吡唑萘菌胺对子囊菌类(Ascomycetes)及担子菌类(Basidipmycetes)均具有很高的抑制活性[12]。但该类药剂在中国仅有啶酰菌胺登记在油菜菌核病防治上,尚未见防治蔬菜菌核病的登记及应用。【本研究切入点】氟吡菌酰胺(fluopyram)是由德国拜耳公司开发的一种吡啶-乙基-苯甲酰胺类琥珀酸脱氢酶抑制剂[13],在中国已被登记用于防治番茄根结线虫、黄瓜灰霉病和白粉病[14];近年来,在蔬菜上的应用范围在不断扩大,其防治蔬菜菌核病的作用值得明确。【拟解决的关键问题】测定不同发育阶段的菌核病菌对氟吡菌酰胺的敏感性,并通过田间药效试验评价其对菌核病的防治效果,以期全面了解该药剂防治菌核病的潜力,为其进一步应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试病原菌 2016—2017年,采自山东省昌乐、寿光、青州、临朐和泰安等地的黄瓜、番茄、茄子、西葫芦、芸豆、辣椒等作物,共获得173个核盘菌株。
1.1.2 供试药剂 96%氟吡菌酰胺原药和 41.7%氟吡菌酰胺悬浮剂(拜耳作物科学有限公司),40%菌核净可湿性粉剂(江西禾益化工股份有限公司),50%多菌灵可湿性粉剂(浙江新安化工集团股份有限公司)。
1.1.3 供试培养基 马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,去离子水1 L。
1.2 方法
1.2.1 菌核病菌对氟吡菌酰胺的敏感性测定 采用菌丝生长速率法[15]。将 96%的氟吡菌酰胺原药用甲醇溶解,配成 1.0×104μg·mL-1的母液,再用含有0.1%吐温-80的无菌水稀释成系列浓度的氟吡菌酰胺标准溶液,最后与加热冷却至 45℃左右的 PDA培养基混合,制成浓度为0.005、0.01、0.02、0.04、0.08、0.16、0.32 μg·mL-1的含药平板。将供试菌株在PDA平板上纯化培养3 d后,在菌落边缘打取直径为5 mm的菌饼,然后将菌饼的菌丝面朝下接种在平板中央。每处理设 4次重复,并设不含药剂的空白溶剂对照。于25℃培养2 d后,用十字交叉法测定菌落直径并计算氟吡菌酰胺对菌核病菌菌丝生长的抑制中浓度(EC50)。
1.2.2 氟吡菌酰胺对菌核病菌菌核产量的影响 随机选取来自不同作物的菌核病菌菌株(QZ5、CL22、LQ3)用于测定。从培养3 d的菌落边缘打取直径为5 mm 的菌饼,并接种到含 0.4、0.8、1.6 μg·mL-1氟吡菌酰胺的PDA平板上。每处理设4次重复,并设不含药
剂的空白溶剂对照。试验进行3次。于25℃培养30 d后,测定每皿的菌核数量和菌核干重[16]。
1.2.3 氟吡菌酰胺对菌核菌丝型萌发的抑制活性随机选取来自不同作物的菌核病菌菌株(QZ5、CL22、LQ3),在PDA平板上培养15 d后,收集直径为3—5 mm的菌核,然后经0.5% NaClO消毒3 min后,用无菌蒸馏水冲洗3次,然后在室温下用滤纸擦干。将处理后的菌核嵌入到含 0.5、1、2、5 μg·mL-1氟吡菌酰胺的PDA平板上,每皿接5个菌核,每30个菌核设为一个重复,每处理设4次重复,并设不含药剂的空白溶剂对照,试验进行3次。于25℃培养3、4、5 d后,在光学显微镜下观察菌核萌发出的菌丝。若菌丝长度超过2 mm则视为萌发,连续3 d记录萌发的菌核数,计算氟吡菌酰胺对菌核菌丝型萌发的抑制率[17]。菌核萌发抑制率(%)=(对照菌核萌发数-处理菌核萌发数)/对照菌核萌发数×100。
1.2.4 氟吡菌酰胺对菌核病的保护与治疗作用 保护与治疗作用的测定参照KUANG等[18]的方法,略作改进。选取大小一致、叶龄一致的茄子叶片(品种黑旋风),经0.5% NaClO消毒1 min后,用无菌蒸馏水冲洗3次,自然晾干后放置于铺有湿润滤纸的直径9 cm的培养皿中。用无菌水将41.5%的氟吡菌酰胺悬浮剂稀释成 5、10、20、40 μg·mL-1系列浓度的药液,对照药剂40%菌核净可湿性粉剂和50%多菌灵可湿性粉剂均配成浓度为40 μg·mL-1的药液,无菌水为空白对照,每处理设6个重复。试验进行3次。随机选取一个菌核病菌菌株(QZ22)用于接种试验。保护作用于施药24 h后接菌,治疗作用于施药前24 h接菌,处理叶片放置于培养箱(25℃,光周期12 h/12 h;相对湿度80%)中培养3 d,用十字交叉法测量病斑直径,计算氟吡菌酰胺对菌核病的防治效果。菌落增长直径(mm)=菌落直径-菌饼直径;相对防治效果(%)=(对照菌落增长直径-处理菌落增长直径)/对照菌落增长直径×100。
1.2.5 氟吡菌酰胺防治茄子菌核病田间药效试验参照《农药田间药效试验准则》进行[19]。分别于2016年11月和2017年11月在山东省昌乐市三河村的拱棚中进行;供试茄子品种均为黑旋风。共设置6个处理,有效成分浓度依次为:(1)氟吡菌酰胺 100 g·hm-2;(2)氟吡菌酰胺 150 g·hm-2;(3)氟吡菌酰胺 200 g·hm-2;(4)菌核净 600 g·hm-2;(5)多菌灵 1 125 g·hm-2;(6)清水对照,喷液量为750 L·hm-2。每小区面积为32 m2,采用随机区组排列,每处理设4个重复。于零星发病初期进行施药,每隔7 d施药1次,共喷施2次,于末次施药后14 d调查植株的病情指数,计算防治效果。病情指数分级标准参照油菜菌核病分级标准:0级,无病斑;1级,发病面积占主茎表面积的5%以下;3级,发病面积占主茎表面积的6%—15%;5级,发病面积占主茎表面积的 16%—30%;7级,发病面积占主茎表面积的 31%—50%;9级,发病面积占主茎表面积的50%以上。病情指数= Σ[(病级数×各病级株数)/(调查总株数×9)]×100;防治效果(%)=(对照组病情指数-处理组病情指数)/对照组病情指数×100。
1.3 数据分析
采用DPS 7.05软件计算氟吡菌酰胺的EC50,采用最小显著差异法(LSD法)进行差异显著性分析(P<0.05)。
2 结果
2.1 山东地区蔬菜菌核病菌对氟吡菌酰胺的敏感性
来自 6种作物上的菌核病菌对氟吡菌酰胺均敏感,且其平均 EC50无显著差异(表 1),表明这 173株菌核病菌可以被用来分析蔬菜菌核病菌对氟吡菌酰胺的敏感性水平。氟吡菌酰胺对 173个菌核病菌的EC50值分布范围为 0.02—0.30 μg·mL-1,均值为(0.11±0.01)μg·mL-1,变异系数为 17,EC50频率分布呈单峰偏正态曲线分布(图1),表明该地区的蔬菜菌核病菌对氟吡菌酰胺的敏感性未出现明显分化,未发现敏感性下降的亚群体。
2.2 氟吡菌酰胺对菌核病菌菌核产量的影响
菌株QZ5、CL22、LQ3的菌核生长的表观形态各不相同(图2-A),但随着氟吡菌酰胺浓度的增加,同一菌株的菌核数量和干重均表现出相同的下降趋势(图2-C、2-D)。氟吡菌酰胺处理浓度为1.6 μg·mL-1时,3个菌株的菌核产量均明显少于其他处理组的对应菌株。且与对照组的菌核相比,药剂处理后菌株QZ5、CL22、LQ3的菌核体积变小(图2-B),表明该药剂能够影响菌核的活力[20]。
2.3 氟吡菌酰胺对菌核菌丝型萌发的影响
随着浓度的提高,氟吡菌酰胺对菌核菌丝型萌发的抑制作用逐渐增强。在黑暗条件下培养3、4、5 d时,5 μg·mL-1氟吡菌酰胺对菌核萌发的抑制率分别为100.00%、98.33%、96.67%(菌株 QZ5),100.00%、97.50%、95.83%(菌株CL22)和100.00%、100.00%、95.83%(菌株LQ3),显著高于其他处理组(表2)。随着时间的延长,氟吡菌酰胺对菌核萌发的抑制率逐渐降低,表明不同菌株菌核的敏感性存在一定差异。
2.4 氟吡菌酰胺对菌核病的保护与治疗作用
随着浓度提高,氟吡菌酰胺对菌核病的保护作用与治疗作用逐渐增强。当处理浓度达到40 μg·mL-1,氟吡菌酰胺对菌核病的保护作用防治效果达到100%,能够完全抑制病斑扩展,而其治疗作用防治效果为88.81%,低于其保护作用防治效果,但是显著高于对照药剂多菌灵和菌核净的防治效果(表3)。由此可见,氟吡菌酰胺同时具有保护与治疗防治效果,且保护作用优于治疗作用。

图2 氟吡菌酰胺对菌核病菌菌核产量的影响Fig. 2 Effect of fluopyram on sclerotial prudction of S. sclerotiorum

表2 氟吡菌酰胺对菌核菌丝型萌发的抑制作用Table 2 Effect of fluopyram on myceliogenic germination of sclerotia of S. sclerotiorum
2.5 氟吡菌酰胺对茄子菌核病的田间防治效果
5种药剂处理对茄子菌核病均有一定的防治效果。当氟吡菌酰胺的施用剂量为200 g a.i./hm2时对茄子菌核病的防治效果分别为90.30%(2016年)和87.60%(2017年),显著高于氟吡菌酰胺其他施用剂量以及对照药剂菌核净600 g a.i./hm2、多菌灵1 150 g a.i./hm2的防治效果(表4)。
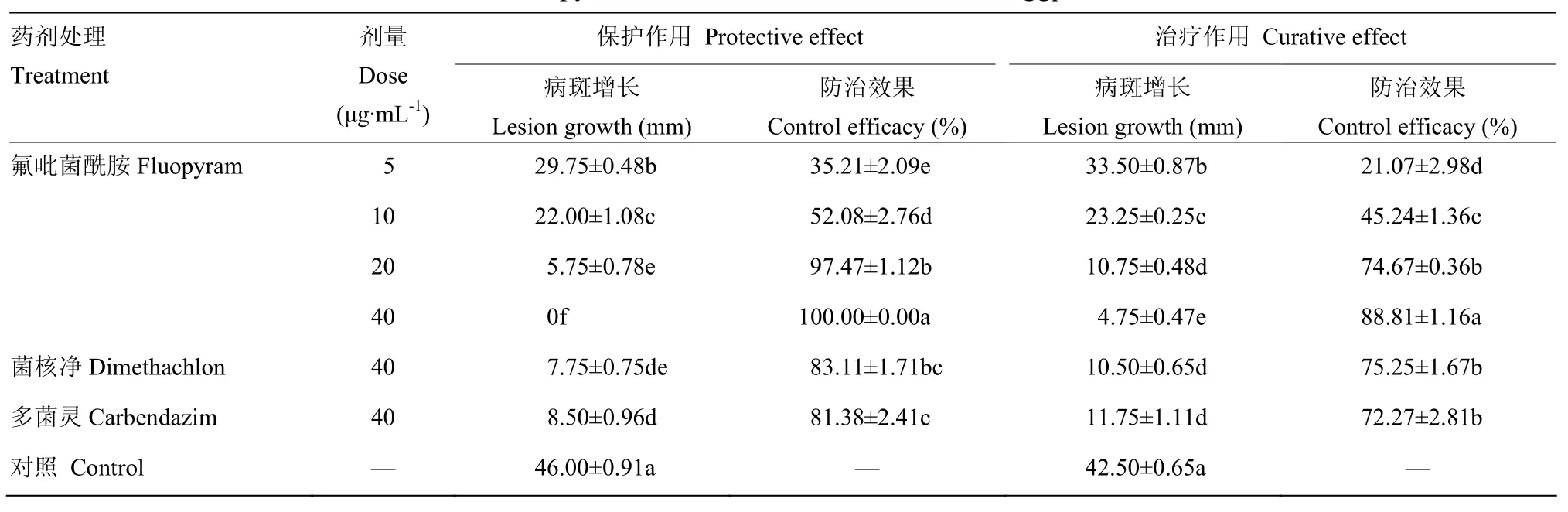
表3 氟吡菌酰胺对菌核病的保护与治疗作用Table 3 Protective and curative effects of fluopyram on S. sclerotiorum on leaves of eggplants

表4 氟吡菌酰胺对茄子菌核病的田间防治效果Table 4 Control efficacy of fluopyram on Sclerotinia stem rot of eggplant in the field
3 讨论
近年来,随着设施蔬菜的种植面积不断扩大以及复种指数的提高,菌核病危害日趋严重。菌核病难防的主要原因首先是菌核作为病害循环的初侵染源以及病原菌存活的主要形式,可以在不良环境中存活8年之久[21-22];其次菌核可以萌发形成子囊盘,释放子囊孢子,并随气流传播数千米,随后生成菌丝侵染寄主的茎、叶、果实,这是菌核病大范围发生的主要原因[23];最后菌核还可萌发生成菌丝直接侵染作物根部,导致根腐或茎腐,严重时造成寄主整株死亡[24-25]。因此好的防治药剂应该对菌核各个发育阶段均能够有效控制。本研究中,氟吡菌酰胺对菌核病菌的菌丝生长、菌核产量以及菌核的菌丝型萌发均具有较好的抑制效果,因此,其有可能保护寄主免受菌丝侵染,减少再侵染的菌核数量,切断其侵染循环。XU等[17,26]研究发现,新型 QoI类杀菌剂苯噻菌酯在 5 μg·mL-1的剂量下对菌核菌丝型萌发的抑制率在80%以上,而且经药剂处理后,菌核数量减少,但体积变大。然而本研究发现,氟吡菌酰胺在5 μg·mL-1的剂量下对菌核菌丝型萌发的抑制率在95%以上,而且在1.6 μg·mL-1的剂量下,菌核的数量和干重明显减少,且体积变小,严重影响菌核的活力。根据氟吡菌酰胺对不同发育阶段菌核病菌所表现出的良好生物活性可以推断该药剂对于菌核病防治具有较大的应用潜力。
由于氟吡菌酰胺属于单作用位点杀菌剂,潜在抗性风险相对较高[27]。因此,在其上市之前,了解菌核病菌对该药剂的敏感性对今后制定科学的使用策略及进行相关的抗性管理具有重要作用[28]。本研究表明,采自不同地区和不同作物上的173株核盘菌对氟吡菌酰胺均敏感,且变异系数较小,说明山东地区蔬菜菌核病菌对氟吡菌酰胺目前还处在敏感水平,未发现敏感性下降的群体。然而蔬菜菌核病菌对该药剂的EC50频率分布呈单峰偏正态曲线分布,这与已报道的油菜菌核病菌对氟硅唑[29]、氟环唑[30]、氟啶胺[31]、吡唑醚菌酯[15]、肟菌酯[32]等药剂的 EC50频率分布图结果相似,但同样不能说明菌株的敏感性水平存在向抗性转移的风险[33]。
氟吡菌酰胺防治菌核病的保护作用优于其治疗作用,这与多数杀菌剂作用方式一致。所以,为保证氟吡菌酰胺田间防病效果,在田间应尽量在发病前或发病初期使用。两年的田间试验中,200 g a.i./hm2氟吡菌酰胺在田间有零星病株时施用的防治效果均高达85%以上,显著高于对照药剂菌核净以及多菌灵。而在室内离体叶片接种试验中,菌核净和多菌灵对菌核病的防治效果与氟吡菌酰胺的防治效果差距不太大。这种现象可能与田间菌核病在叶片和茎秆均有发生,二者对药剂的附着和吸收传导程度不同,以及药剂在环境中的稳定性存在差别有关。此外,考虑到 SDHI类杀菌剂被FRAC列为具有中度或高度抗性风险的杀菌剂[34],所以在实际应用时建议氟吡菌酰胺与其他杀菌剂复配使用,并控制单一生长季节的使用次数,以延缓抗药性的产生。
4 结论
新型琥珀酸脱氢酶抑制剂氟吡菌酰胺对菌核病菌的菌丝生长、菌核形成及萌发均具有较高的抑制活性,在田间能够有效地控制菌核病发生,因此该药剂防治菌核病具有很高的应用潜力,可作为防治作物菌核病的候选药剂。

