藁本内酯抑制小胶质细胞中NF-κB介导的趋化因子表达*
汪 雪 赵林霞 张志军 高永静 △
(1南通大学航海医学研究所,南通 226019;2南通大学医学院人体解剖学系,南通 226001)
慢性疼痛在临床上非常常见,但还缺乏有效的治疗方法。中药是中国传统的药材,具有广泛的药理作用,能治疗多种疾病。近年来,中药缓解和治疗慢性疼痛的作用和机制逐渐被揭示。比如左旋紫堇达明(levo-corydalmine) 是中药元胡中含量最高的成分,通过抑制脊髓中NF-κB介导的神经炎症因子表达,缓解化疗引起的疼痛[1];姜黄素 (curcumin)能够有效缓解炎症性疼痛,并能抑制脊髓小胶质细胞和星形胶质细胞中多种炎症介质的产生[2,3]。藁本内酯 (z-ligustilide,LIG) 是中药当归挥发油中的主要活性成分,它具有较强的免疫药理作用。LIG经口服或者鼻腔吸入后能透过血脑屏障到达中枢神经系统,具有神经保护作用[4]。文献报道及本课题组前期的实验表明,口服或者静脉给于LIG后,能减轻乙酸、福尔马林以及完全弗氏佐剂诱导的急慢性炎症性疼痛,而且LIG的镇痛作用与抑制脊髓中星形胶质细胞和小胶质细胞的激活有关[5~8]。
小胶质细胞是中枢神经系统中常驻免疫细胞,其数量约占中枢神经系统神经胶质细胞总数的10%~20%,正常情况下小胶质细胞起免疫监视作用,其对中枢神经系统的微环境变化非常敏感[9]。小胶质细胞能被脂多糖、β-淀粉样蛋白、干扰素-γ所诱导激活,激活的小胶质细胞呈现出形态学的改变,从静止的分支状形态变成阿米巴样激活形态。在体内,组织损伤或神经损伤引起小鼠脊髓中小胶质细胞明显激活;而且使用小胶质细胞特异性抑制剂米诺环素 (minocycline) 能延缓慢性疼痛的发生[10,11]。激活的小胶质细胞可以释放多种促炎细胞因子和趋化因子,在慢性疼痛的产生和维持中起重要作用[10,12,13]。
趋化因子 (chemokines) 是一类具有多种生物学功能的小分子分泌性蛋白质,参与神经炎症反应和慢性疼痛的发生与发展过程[14]。角质细胞起源趋化因子 (keratinocyte-derived chemokine,KC)、单核细胞趋化蛋白-1 (monocyte chemoattractant protein-1,MCP-1)、巨噬细胞炎性蛋白1α (macrophage inflammatory protein-1α,MIP-1α) 是参与外周炎症或慢性疼痛的重要趋化因子。LIG的镇痛作用是否与抑制小胶细胞中趋化因子表达有关,NF-κB是否介导了趋化因子的表达,尚不清楚,我们对此进行了研究。
方 法
1.主要试剂和仪器
LIG由当归提取获得,纯度99%以上;LPS和DMSO购自sigma公司;高糖DMEM培养基和胎牛血清购自Gibco公司;Trizol试剂、逆转录试剂盒、以及实时荧光定量PCR试剂盒购自Takara公司;蛋白酶抑制剂和磷酸酶抑制剂购自Sigma公司;BCA蛋白分析试剂盒购自Pierce公司;兔抗磷酸化NF-κB抗体购自Cell Signaling公司;NF-kB抑制剂BAY11-7082购自Merk公司;CO2细胞培养箱购自Thermo Electron公司;实时荧光定量PCR仪Rotor-Gene 6000购自Corbett Life Science公司;NanoDrop分光光度计购自Thermo Fisher公司。
2.方法
(1)BV2小胶质细胞的培养和处理
BV2小胶质细胞使用含10% FBS的高糖DMEM培养基,在37℃,5% CO2培养箱中进行培养。LPS (1 mg/ml)分别刺激BV2小胶质细胞15 min、0.5 h、1 h、3 h、6 h,提取RNA或蛋白;LIG预孵育BV2小胶质细胞30 min后,加入LPS (1 mg/ml) 继续刺激细胞一定的时间,用裂解液收细胞,提RNA或蛋白。BAY11-7082预孵育细胞的方法同LIG。
(2)原代小胶质细胞的培养和处理
取新生1~2 d红皮小鼠大脑皮层于装有预冷D-Hanks液的小培养皿中,置于冰上。在解剖显微镜下剥除脑膜,收集好所有的大脑皮层后,用剪刀剪碎组织,将组织转移至事先吸入少许完全培养基的50 ml离心管中。用移液器吹打分散组织至无碎块,100 mm孔径网筛过滤。在4℃环境中,在离心力3 000 g条件下,离心5 min。弃上清,加入完全培养基重悬细胞,10 mm孔径滤器过滤。将5 ml细胞悬液 (约107个细胞) 接种于75 cm2培养瓶中。次日换液,以后3~4 d换液一次。培养10天左右后可见贴附瓶底生长的星形胶质细胞和贴在星形胶质细胞表层的小胶质细胞。将培养瓶放入37℃的摇床中,转速300 rpm,摇 6~10 h,使小胶质细胞悬浮到培养基中。之后倒出培养液,离心(1 000 rpm) 5 min。弃上清,用完全培养基重新悬浮获得的小胶质细胞,计数,以3.5 × 105个/孔细胞数种到6孔板中。以上方法可得到纯度大于95%的小胶质细胞[15]。用LIG预孵育小胶质细胞30 min后,加入LPS (1 mg/ml)继续刺激细胞一定的时间,提RNA。
(3)Real-Time PCR
用TRIZOL法提取各组的总RNA,每组用3个复孔。用NanoDrop分光光度计测量总RNA的含量和质量。用1 µg的RNA进行逆转录 (Takara逆转录试剂盒),随后按照SYBR®Premix Ex TaqTMⅡPCR试剂盒的说明配制反应混合液。PCR引物序列如下:GAPDH(Forward:5'-AAATGGTGAAGGTCGGTGTGAAC-3',Reverse:5'-CAACAATCTCCACTTTGCCACTG-3');KC(Forward:5'-GCTTGA AGGTGTTGCCCTCAG-3',Reverse:5'-AGAAGCCAGCGTTCACCAGAC-3');MCP-1(Forward:5'-GCATCCACGTGTTGGCTCA-3',Reverse:5'-CTCCAGCCTACTCATTGGGATCA-3');MIP-1α(Forward:5- CATGACACTCTGCAACCAAGTCTTC-3',Reverse:5'- GAGCAAAGGCTGCTGGTTTCA-3')。在Rotor-Gene 6000 PCR仪上进行扩增,Hold:95℃ 30 s;40个循环(95℃ 5 s;60℃ 30 s;72℃ 30 s);Melt:72℃ - 95℃。
溶解曲线检测和分析PCR产物的特异性。PCR产物表达量结果分析采用2-DDCT(Livak法):用Rotor-Gene 6000 Software软件进行统计分析,设定荧光域值在0.1左右,得到CT值;DCT= 每个样品检测的目的基因CT值-各自内参基因CT值;DDCT= 各处理组DCT值-对照组DCT值;计算目的基因相对于内参的表达比率,即2-DDCT。
3.Western blot
用含有蛋白酶抑制剂和磷酸酶抑制剂的蛋白裂解液提取蛋白质,蛋白质浓度用BCA蛋白分析试剂盒测定。各蛋白泳道使用30 µg总蛋白,用SDS聚丙烯酰胺凝胶分离后转移到PVDF膜上。电泳时,蛋白在浓缩胶时选用90 V,持续30 min;蛋白到达分离胶时改用120 V进行电泳直至溴酚蓝到达底部。转膜在冰浴中进行,选用恒流400 mA,持续90 min。转膜后用5%的脱脂牛奶封闭抗体非特异性结合位点。2 h后加入兔抗pNF-κB抗体 (1:1 000) 或者兔抗GAPDH抗体 (作为内参,1:20 000),一抗4 ℃孵育过夜后洗膜。二抗选用辣根过氧化物酶标记的山羊抗兔抗体 (1:3 000),二抗室温孵育2 h后洗膜,加入 ECL发光剂,立即用Chemidoc XRS system(Bio-Rad) 凝胶成像系统进行拍照。用Image J 图像软件分析条件的特异性,并计算pNF-κB蛋白条带与相应的GAPDH内参条带的灰度值,以两者比值作为pNF-κB蛋白的表达量数值。
4.统计方法
所有计量资料数据均采用均数±标准误(±SEM)表示,各组间比较用重复测量方差分析,两两比较用Bonferoni分析,P< 0.05为差异有统计学意义。
结 果
1.LIG抑制LPS诱导的小胶质细胞中促炎趋化因子的表达
(1)LPS刺激BV2小胶质细胞中促炎趋化因子的表达
用LPS (1 µg/ml) 分别刺激BV2小胶质细胞0.5 h,1 h,3 h,6 h后,检测小胶质细胞中促炎趋化因子KC、MCP-1、MIP-1α的mRNA表达情况。Real-time PCR结果显示:KC mRNA在LPS刺激0.5 h时表达明显增加,在LPS刺激6 h时依然显著增加 (见图1A)。MCP-1 mRNA在LPS刺激1 h时开始增加,在1 h, 3 h,6 h时持续增加,呈现时间依赖性 (见图1B)。MIP-1α mRNA在LPS刺激的0.5 h到6 h也呈现时间依赖性增加 (见图1C)。
(2)LIG抑制LPS诱导的BV2和原代培养的小胶质细胞中促炎趋化因子的表达
LIG (1 µM、10 µM、50 µM) 预孵育 BV2 小胶质细胞30 min后,再用LPS (1 µg/ml) 刺激细胞6 h。观察到LIG在10 µM时就能抑制趋化因子KC和MIP-1α的mRNA的表达,而在高剂量50 µM时才能抑制趋化因子MCP-1的mRNA的表达 (见图2 A,B,C)。
为了验证BV2是否能替代原代培养的小胶质细胞进行体外实验研究,我们培养了原代小胶质细胞,用50 µM的LIG预孵育30 min后,再用LPS(1 µg/ml) 刺激细胞 6小时。结果显示,50 µM LIG抑制了LPS诱导的原代培养的小鼠小胶质细胞中趋化因子KC、MCP-1、MIP-1α的mRNA的表达,结果与BV2细胞一致 (见图2 D,E,F)。
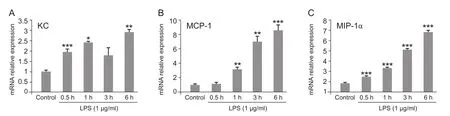
图1 Real-time PCR结果显示LPS增加小胶质细胞中促炎趋化因子的表达(±SEM)LPS (1 µg/ml) 刺激BV2小胶质细胞后不同时间,显著上调KC (A)、MCP-1 (B)、MIP-1α (C) mRNA的表达* P < 0.05,** P < 0.01,*** P < 0.001,与对照组相比Fig.1 Real-time PCR results show that LPS increases the mRNA expression of pro-inflammatory chemokines (±SEM)LPS (1 µg/ml) dramatically increased KC (A)、MCP-1 (B)、MIP-1α (C) mRNA expression in the BV2 microglia after incubation for different times.*P < 0.05,**P < 0.01,***P < 0.001,compared with control.
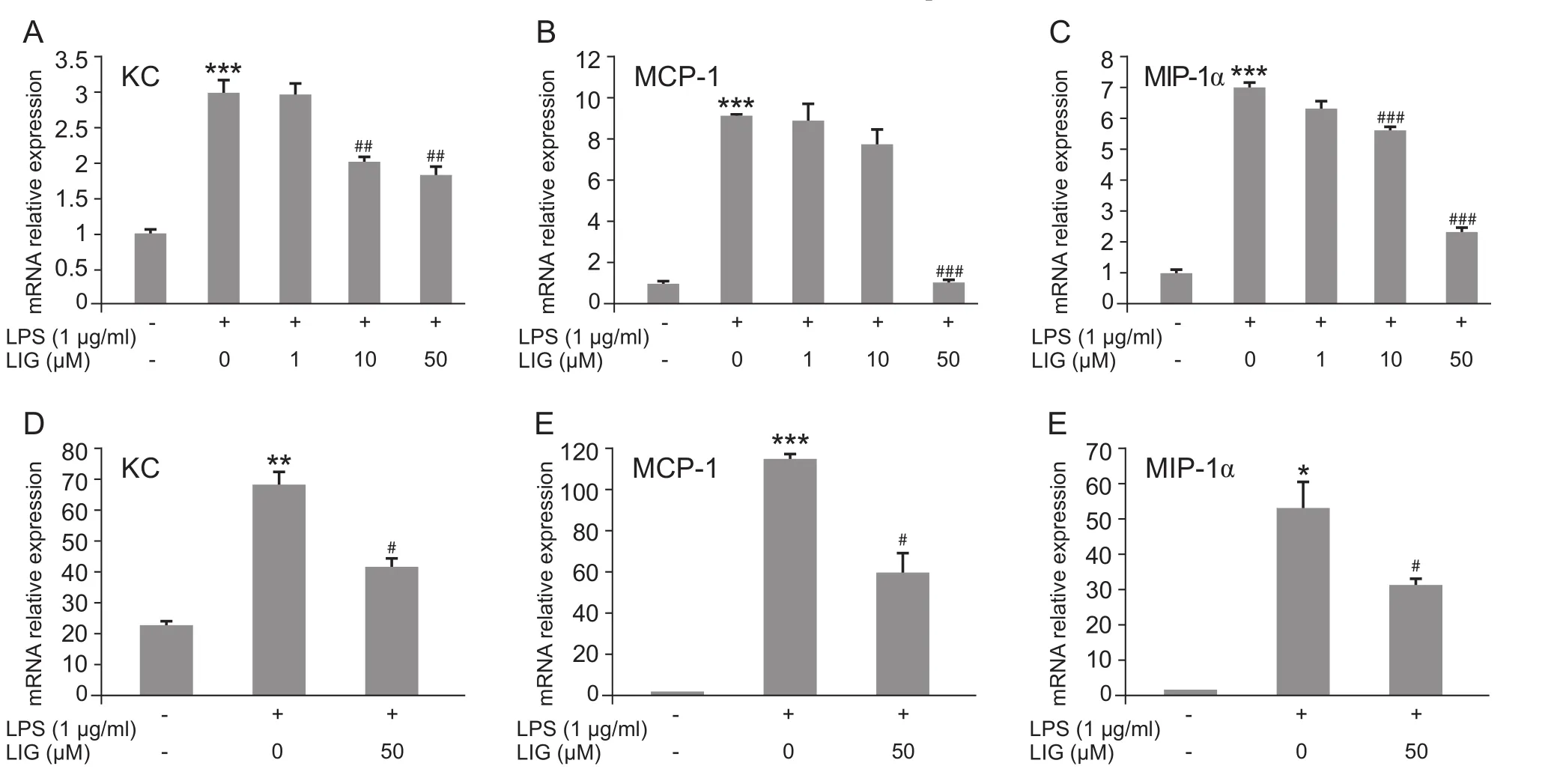
图2 LIG减轻 LPS诱导的体外培养的BV2小胶质细胞和原代培养的小胶质细胞中促炎趋化因子的表达(±SEM)LIG预孵育BV2小胶质细胞后呈剂量依赖性地降低LPS诱导的KC (A)、MCP-1 (B)和MIP-1α (C)的mRNA的表达LIG预孵育原代培养的小胶质细胞后,也能降低LPS诱导的KC (D)、MCP-1 (E)和MIP-1α (F)的mRNA的表达*P < 0.05,**P < 0.01,***P < 0.001,与对照组 (无 LPS 和 LIG 处理 )相比;#P < 0.05,##P < 0.01,### P < 0.001,与LPS组(单纯LPS处理)相比Fig.2 LIG decreases LPS-induced chemokines expression in BV2 and primary cultured microglia (±SEM)LIG dose-dependently decreased LPS-induced upregulation of chemokines KC (A)、MCP-1 (B)、MIP-1α (C) mRNA expressed in BV2 microglia.LIG pre-treatment also decreased LPS-induced upregulation of KC (D)、MCP-1 (E)、MIP-1α (F) mRNA in primary cultured microglia.*P < 0.05、**P < 0.01、***P < 0.001,compared with control (without LPS or LIG treatment); #P < 0.05,##P < 0.01,###P < 0.001,compared with LPS group (LPS treatment only).
2.LIG抑制LPS诱导的小胶质细胞中NF-κB的激活
(1)LPS诱导BV2小胶质细胞中pNF-κB的表达
NF-κB是参与疼痛调制的一个重要的转录因子。我们用LPS (1 µg/ml) 刺激BV2小胶质细胞15 min,30 min,60 min后,检测了pNF-κB的表达。Western blot结果显示,LPS诱导BV2小胶质细胞中pNF-κB的表达上调,且在15 min时诱导的pNF-κB表达最多,在刺激60 min后表达仍然显著增加 (见图3 A,B)。
(2)LIG抑制LPS诱导的BV2小胶质细胞中pNF-κB 的表达
根据以上的结果,实验选用LPS刺激BV2小胶质细胞15 min时间点,检测了预孵育LIG对LPS诱导的 pNF-κB 表达的抑制作用。LIG (50 µM) 预孵育BV2小胶质细胞30 min显著降低了LPS诱导的pNF-κB 的表达 (见图4 A,B)。
3.NF-κB的抑制剂BAY11-7082抑制LPS诱导的BV2小胶质细胞中促炎趋化因子的表达
NF-κB 抑 制 剂 BAY11-7082 (1 µM,10 µM,20 µM)预孵育BV2小胶质细胞30 min后,再用LPS (1 µg/ml)刺激细胞6 h,之后检测趋化因子的表达。结果显示:BAY11-7082对KC的表达无抑制效果 (见图5 A)。但剂量依赖性地抑制了趋化因子MCP-1、MIP-1α的mRNA的表达 (见图5 B,C)。
讨 论
以往的研究证明,外周神经或中枢神经系统损伤能快速激活小胶质细胞,并且外周神经损伤引起的小胶质细胞激活早于星形胶质细胞[16],而且小胶质细胞激活的抑制剂米诺环素能延迟慢性疼痛的发生,但对已经形成的慢性疼痛没有缓解作用[11]。因此,本研究选择了小胶质细胞作为研究对象,并且采用了LIG和NF-κB抑制剂预处理方式观察它们对LPS引起的小胶质细胞内趋化因子表达的影响。BV-2小胶质细胞系是用反转录病毒感染原代培养的小鼠小胶质细胞而获得的永生细胞系,该细胞系不仅高度纯化,而且细胞本身具备了原代培养的小胶质细胞的形态学和表型以及各项功能,培养相对较易,目前被国外许多学者所应用。小胶质细胞原代培养周期长,每次培养获得的细胞量有限,本实验中需要观察多个时间点及LIG不同浓度对多种趋化因子的影响,我们首先用BV2小胶质细胞来研究LIG的作用时间和剂量的效应情况,然后再选择用原代培养的小胶质细胞来观察特定时间点和LIG特定剂量对趋化因子表达的影响。LPS是革兰氏阴性细菌细胞壁的主要组成成分,能诱导神经炎症反应。实验结果显示LPS能诱导BV2小胶质细胞系和原代培养的小胶质细胞上调表达促炎趋化因子KC、MCP-1、MIP-1α。说明小胶质细胞在激活状态下能产生这些促炎趋化因子。趋化因子是细胞因子家族的一部分星形胶质细胞激活较晚,但激活的星形胶质细胞也能产生多种促炎细胞因子和趋化因子,这些炎症因子参与了慢性疼痛的发展过程[17]。激活的小胶质细胞通过释放炎症前细胞因子 (如:IL-1b、TNF-α、IL-6)诱导神经炎症反应。,神经系统在病理状态下(如:损伤、缺血、感染)激活的小胶质细胞不但能释放炎症前细胞因子(如:IL-1b、TNF-α、IL-6),还能释放趋化因子(如:MCP-1、BCA-1、MIP-1a等),这些趋化因子进而能激活星形胶质细胞,并能调节神经元活动[16,18,19]。趋化因子和细胞因子诱导的神经炎症过程参与了多种神经疾病的病理过程(如自闭症、老年性痴呆和帕金森病等神经退行性疾病的发生)[9,20,21]。脊髓部位的胶质细胞释放的趋化因子(如:MCP-1、KC、MIP-1a等)参与了慢性疼痛的发生发展,抑制这些趋化因子能缓解神经病理性疼痛和慢性炎症性疼痛[14,22~26]。因而抑制小胶质细胞诱导的神经炎症反应可以缓解这些慢性神经疾病的进程和缓解慢性疼痛的发生和发展[16,20,22,27]。
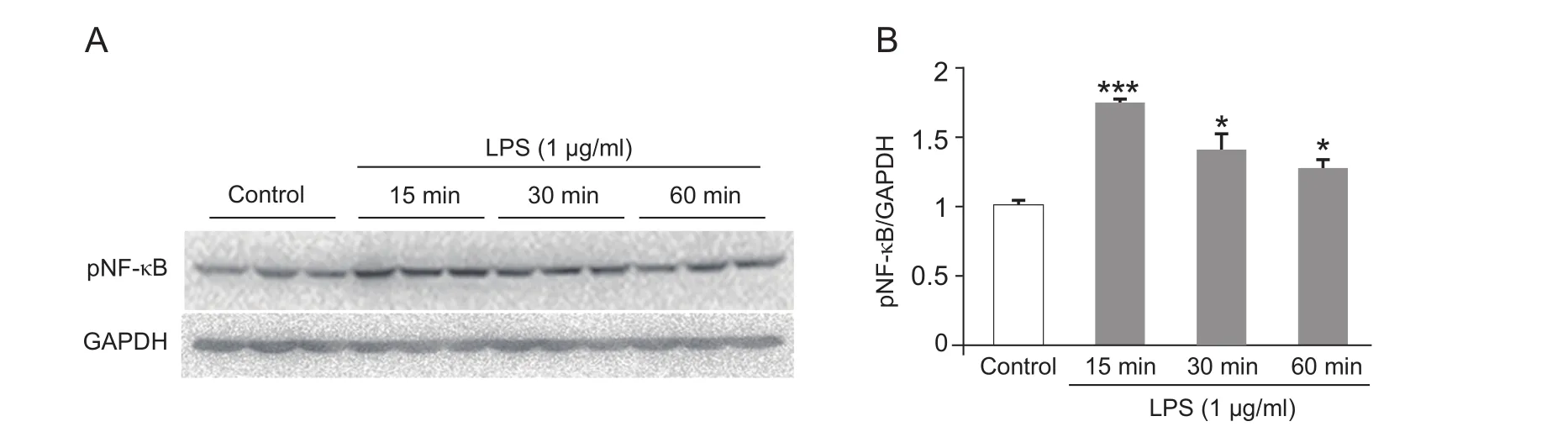
图3 LPS诱导体外培养的BV2小胶质细胞中pNF-κB蛋白在15 min、30 min、60 min的表达增加(±SEM)(A)Western Blot原图;(B)pNF-κB 表达统计图 *P < 0.05,***P < 0.001,与对照组相比Fig.3 LPS increases pNF-κB expression in BV2 microglia at 15 min,30 min,60 min (±SEM)(A) Western blot gel image; (B) Statistical data shows the expression of pNF-κB.*P < 0.05,***P < 0.001,compared with control.
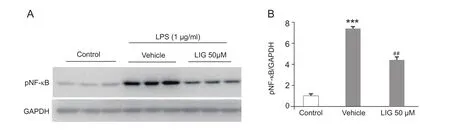
图4 LIG预孵育降低了LPS诱导的体外培养的BV2小胶质细胞中pNF-κB蛋白表达(±SEM)(A)Western Blot原图;(B)pNF-κB表达统计图 ***P < 0.001,与对照组相比;##P < 0.01,与溶剂组相比Fig.4 LIG pretreatment decreases LPS-induced upregulation of pNF-κB in BV2 microglia (±SEM)(A) Western blot gel image; (B) Statistical data shows the expression of pNF-κB.***P < 0.001,compared with control;##P < 0.01,compared with vehicle.
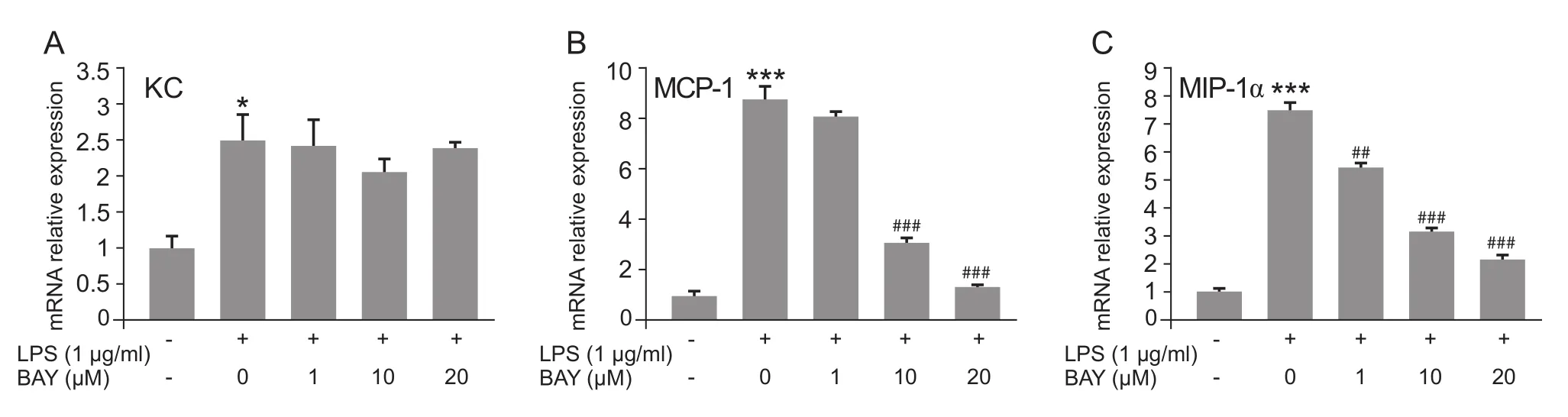
图5 NF-κB抑制剂降低LPS诱导的趋化因子表达(±SEM)BAY11-7082预孵育剂量依赖性地降低了LPS诱导BV2小胶质细胞中MCP-1(B) 和 MIP-1α (C) mRNA的表达,但不影响KC (A) mRNA的表达 *P < 0.05,***P < 0.001与对照组相比;##P < 0.01,###P < 0.001与LPS组相比Fig.5 NF-κB inhibitor reduces LPS-induced chemokines expression( ±SEM)RT-PCR results show that BAY11-7082 pretreatment dose-dependently decreased LPS-induced upregulation of MCP-1(B) and MIP-1a (C) mRNA except KC (A) mRNA in BV2 microglia.*P < 0.05,***P < 0.001,compared with control;##P < 0.01,###P < 0.001,compared with LPS.
目前关于LIG的神经保护作用和镇痛作用已有一些报道。我们以往的研究显示,静脉注射LIG有效缓解了完全弗氏佐剂诱导的慢性炎症性疼痛,而且反复给药的镇痛作用逐渐增强,且不引起耐受。进一步的机制研究表明,LIG预处理减轻了完全弗氏佐剂引起的脊髓小胶质细胞的激活,并且抑制了脊髓中炎症前细胞因子IL-1b、TNF-α、IL-6的表达[7,16]。本研究进一步揭示了LIG对小胶质细胞中趋化因子表达的抑制作用,表明LIG对小胶质细胞内的炎症因子表达有广泛抑制作用,很可能作用于这些炎症因子表达的上游信号通路。另外,LIG也能抑制完全弗氏佐剂引起的脊髓星形胶质细胞的激活以及星形胶质细胞中一些趋化因子的表达。由于小胶质细胞在慢性疼痛的早期启动中起重要作用,而星形胶质细胞主要参与慢性疼痛的维持,因此LIG可能通过同时抑制小胶质细胞和星形胶质细胞的激活和它们胞内的炎症因子表达,起到延缓疼痛产生并长期镇痛的作用。已有研究报道显示LIG能抑制小胶质细胞产生的细胞因子IL-1b、TNF-α、IL-6[25],而且能抑制激活的星形胶质细胞表面LPS受体TLR4的上调表达[16]。说明LIG能广泛的作用于参与神经炎症反应的小胶质细胞和星形胶质细胞,本实验结果还显示LIG能抑制小胶质细胞的促炎趋化因子KC、MCP-1、MIP-1α表达。
NF-κB是炎症反应调控的重要信号系统,LPS刺激诱导IκB磷酸化并降解,NF-kB的激活一般指p65磷酸化后从胞浆转运入核,启动和调控多种基因的转录表达,包括趋化因子的表达。在本实验中NF-kB抑制剂BAY11-7082预孵育小胶质细胞后抑制了LPS诱导的MCP-1、MIP-1a的表达,但没有抑制KC的表达,这可能是由于BV2小胶质细胞中表达KC含量较低,或者LPS诱导的KC表达不依赖于NF-κB信号的激活。LIG能下调这三种促炎趋化因子在LPS刺激后小胶质细胞的表达,同时还能下调pNF-κB的表达。这些结果说明LIG通过抑制小胶质细胞中NF-κB抑制了炎症因子的表达。
总之,本实验发现LIG可通过抑制激活小胶质细胞中NF-κB的激活,并显著地降低了激活的小胶质细胞的促炎趋化因子的表达。这为LIG参与抑制神经炎症提供一个可能的机制,并有望用来治疗和预防神经炎性疾病和慢性疼痛。

