MicroRNA-125a-5p表达对弥漫大B细胞淋巴瘤耐药及临床预后的影响*
韩莹,杨文秀,濮珍红,万珑
(1.贵州医科大学 病理学教研室,贵州 贵阳 550004;2.贵州医科大学附属医院病理科,贵州 贵阳 550004)
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是成人最常见的非霍奇金淋巴瘤,其发病占非霍奇金淋巴瘤的30%~40%[1]。由于分子遗传学、临床过程和预后、形态学及免疫表型等方面的差异,DLBCL是一组异质性的淋巴瘤。目前,利妥昔单抗+CHOP方案为DLBCL的标准治疗方案,只能使50%的患者得到持续缓解,约45%患者则表现出原发耐药和缓解后复发[2]。肿瘤的临床分期、国际预后指数(international prognosis index, IPI)和增殖活性等是恶性肿瘤常用的预后评估因素,DLBCL的遗传学改变和肿瘤细胞的免疫表型对其临床预后和治疗效果有明显影响,但发现IPI同分值的DLBCL患者预后差异较大[3]。因此,寻找DLBCL的新型预后评估因素很有意义。MiRNA是非编码调控型RNA分子,可影响肿瘤发生、发展及临床进程。MicroRNA-125a(miR-125a)在DLBCL细胞群中能靶向抑制肿瘤坏死因子α诱导蛋白3基因(the tumor necrosis factor,alpha-induced protein 3 gene, TNFAIP3, A20),进而激活NF-κB通路而影响肿瘤细胞的增殖和凋亡,肿瘤的侵袭性和耐药性等[4-6]。有研究证明[7],多药耐药基因1(multi-drugs resistance gene, MDR1)启动子上存在一个NF-κB结合位点,同时在预后不良的DLBCL患者中miR-125b表达上调。据此,本研究通过检测DLBCL患者肿瘤组织中miR-125a-5p的mRNA水平以及P糖蛋白(P-glycoprotein, P-gp)表达、细胞增殖核抗原(nuclcar-associated antigen, Ki-67)蛋白表达对预后的影响,探讨miR-125a-5p表达在DLBCL临床过程和预后评估中的意义。
1 资料与方法
1.1 一般资料
选取2006年1月-2016年12月于贵州医科大学附属医院病理科诊断的弥漫大B细胞淋巴瘤患者和档案石蜡标本,按照WHO 2016年淋巴瘤分类更新的标准,筛选出非特指的DLBCL患者,将肿瘤组织大小超过0.5 cm直径的90例DLBCL纳入研究(DLBCL组),并以8例淋巴结反应性增生患者作为研究对照(对照组)。
1.2 方法
1.2.1 试剂与仪器P-gp单克隆抗体(英国Abcam公司),Ki67单抗、二抗及其他免疫组织化学检测试剂(北京中杉金桥公司),Trizol试剂盒(美国Invitrogen公司),DEPC水(日本Sigma公司),miRNA逆转录试剂盒(美国Gene Copoeia公司)。紫外分光光度计(Nano Drop1000,美国Thermo Sciencific公司),CFX Connect Real-time PCR检测系统(美国Bio-Rad 公司)。
1.2.2 苏木素-伊红染色 按照常规病理操作规范进行[8-9]。
1.2.3 免疫组织化学染色 采用PV二步法,以枸橼酸盐(pH=6.0)进行高压热修复。一抗稀释度:P-gp单克隆抗体1∶50,Ki67单抗1∶100。二抗及其他免疫组织化学检测试剂遵循实验步骤,按照说明书依次添加。P-gp阳性对照为心肌组织,Ki67阳性对照为反应性增生淋巴结,空白对照以0.01 mol PBS(pH=7.2)代替一抗。
判读标准:随机选择10个高倍镜视野(×400)计数1 000个细胞中的阳性细胞数,取10个高倍镜视野均数为其阳性率。P-gp阳性信号定位在细胞膜和细胞浆,以肿瘤细胞阳性率>20%为阳性,<20%为阴性。
1.2.4 miR-125a-5p检测 ①总RNA提取:石蜡组织切片、脱蜡、组织消化,采用Trizol试剂盒提取DLBCL及淋巴结反应性增生石蜡组织的总RNA,将提取的总RNA溶解至0.1%的DEPC水中,采用紫外分光光度计测定RNA浓度和纯度,在260~280 nm波长范围检测光密度值,控制在1.8~2.0之间以满足检测所需RNA质量;②RNA逆转录:将模板总RNA置于冰上溶解,采用miRNA逆转录试剂盒进行逆转录,严格按照说明书操作。在冰上配制反应体系:1 μl 205 u/μl poly A polymerase、1 μl RTase Mix、5 μl 5×PAP/RT Buffer、不同体积总RNA,以ddH2O补足反应体系,总体积达到25 μl。轻柔混匀,12 000 r/min离心2 min后将反应液置于PCR仪,37℃孵育60 min,然后85℃孵育5 min终止反应,置入4℃保存;③实时荧光定量聚合酶链反应(qRT-PCR):选用All-in-OneTMmiRNA qPCR Mix试剂盒,内参基因选用U6,按照试剂盒说明书操作。内参U6引物和目的has-miR-125a-5p引物购自美国Gene Copoeia公司,严格遵照试剂盒操作说明书,每个样本设置3个复孔,于八联管中配制反应体系 :10 μl All-in-One qPCR Mix、2 μl All-in-oneTMmiRNA qPCR Primer、2 μl Universal Adaptor PCR Primer、2 μl cDNA、4 μl ddH2O,总体积达20 μl;轻柔混匀,12 000 r/min离心2 min,CFX Connect real-time PCR检测系统中进行,设置反应程序:95℃ 10 min,95℃ 10 s,60℃ 20 s,72℃(收集荧光信号)10 s 45个循环,95℃ 10 s,熔解曲线温度:65~95℃,每5秒升高0.5℃;④分析每个样本的Ct值,以U6作为内参,由公式2-ΔΔCt计算miR-125a-5p的相对表达量。ΔCt=miR-125a-5p Ct平均值-U6 Ct平均值,ΔΔCt=DLBCL组ΔCt-对照组ΔCt。以2-ΔΔCt中位数作为分界值,将DLBCL患者组分为miR-125a-5p高表达组和低表达组。
1.3 随访
主要采用电话随访、门诊及住院病例复查及信访。随访开始时间为首次明确病理诊断,随访截止时间为2016年12月31日,总生存期(overall survival,OS)时间计算从诊断确立到DLBCL引起的死亡或随访终止,无复发生存期(relapse free survival,RFS)时间计算从诊断确立到DLBCL复发、死亡或随访终止,与本病不相关的死亡算为截尾。
1.4 统计学方法
数据分析采用SPSS 21.0统计软件,两组间独立样本采用Mann-WhitneyU检验,miR-125a-5p表达与临床病理特征参数统计采用χ2检验,生存分析采用Kaplan-Meier法及Log-rank检验,采用COX风险比例模型对各个协变量进行效应分析,P<0.05为差异有统计学意义。
2 结果
2.1 临床病理特征
90例DLBCL中,男性55例,女性35例,男女比为1.6∶1.0;发病年龄20~85岁,中位年龄64岁;原发于淋巴结内41例,淋巴结外49例;non-GCB DLBCL型64例,GCB-DLBCL型26例;Ann Arbor临床分期Ⅰ期27例,Ⅱ期33例,Ⅲ期6例,Ⅳ期24例;乳酸脱氢酶(LDH) 109~245 u/L 68例,<245 u/L 22例;IPI评分0~1分25例,2分32例,3分26例,4~5分7例。
2.2 miR-125a-5p在DLBCL组和对照组中的表达
在DLBCL组和对照组中miR-125a-5p表达量分别为3.532(0.230,10.960)和1.015(0.340,2.540),与对照组比较,miR-125a-5p在DLBCL组中高表达,差异有统计学意义(U=113.00,P=0.001),见图1。
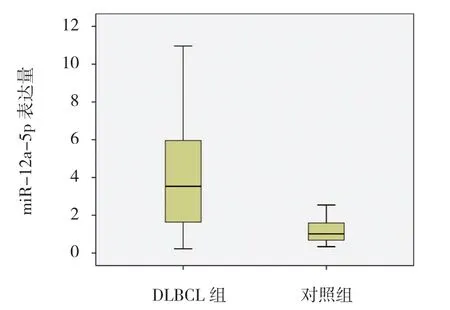
图1 两组miR-125a-5p相对表达量
2.3 miR-125a-5p表达与DLBCL患者临床病理特征的关系
根据miR-125a-5p的表达水平,以中位数值为界,将90例DLBCL患者分为miR-125a-5p高表达组(n=47)、miR-125a-5p低表达组(n=43)。结果发现,miR-125a-5p的表达在正常LDH与LDH升高患者之间差异有统计学意义(χ2=5.427,P=0.020),在GCB与non-GCB患者中差异有统计学意义(χ2=6.744,P=0.009),而在不同年龄(<60岁 vs >60岁)、性别、原发部位、Ann Arbor临床分期和IPI评分差异无统计学意义(P>0.05)。见表1。
2.4 miR-125a-5p表达对P-gp蛋白表达的影响
在miR-125a-5p高表达组中P-gp蛋白阳性表达率为61.7%(29/47),而低表达组P-gp蛋白阳性率为39.5%(17/43),两组比较差异有统计学意义(P<0.05),且高表达组高于低表达组。见图2和表2。

表1 DLBCL患者中miR-125a-5p表达与临床病理相关性

图2 DLBCL中P-gp表达情况 (PV×400)
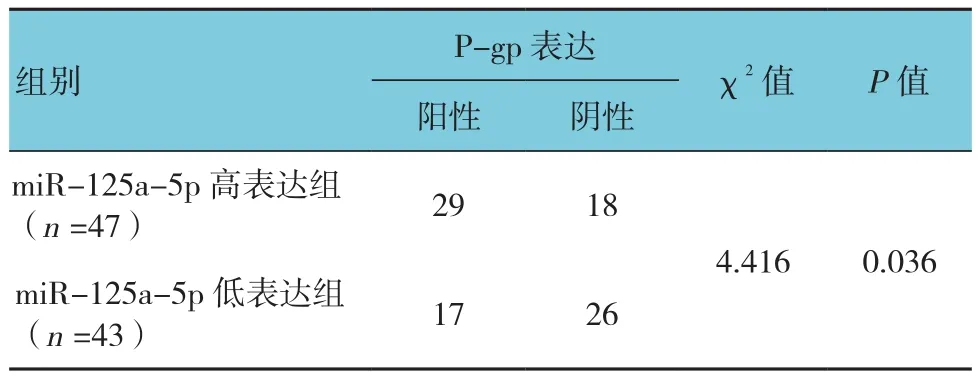
表2 miR-125a-5p与P-gp的表达 例
2.5 miR-125a-5p表达水平对患者预后的影响
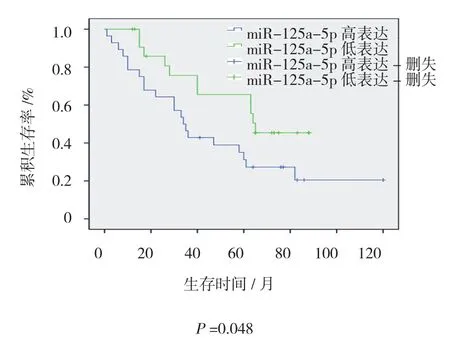
图3 两组生存曲线图

图4 两组生存曲线图
在90例DLBCL患者中,完整随访资料的有51例,随访率达到56.7%,随访时间0.5~120.5个月(中位随访时间58个月)。本研究以51例患者miR-125a-5p表达水平的中位数值为界,分为miR-125a-5p的mRNA的高表达组和低表达组,Kaplan-Meier及Log-rank检验分析结果显示,miR-125a-5p低表达组的中位生存时间65个月高于高表达组34个月,低表达组中位无复发生存时间60个月高于高表达组36个月,差异有统计学意义(P<0.05)(见图3、4)。单因素COX回归分析显示:Ann Arbor分期Ⅲ、Ⅳ期、miR-125a-5p高表达与不良预后相关;多因素COX风险模型分析显示,Ann Arbor分期Ⅲ、Ⅳ期和miR-125a-5p高表达均可作为DLBCL患者评估预后的因素(见表3、4)。

表3 总生存期单因素COX风险模型回归分析

表4 总生存期多因素COX风险模型回归分析
3 讨论
DLBCL是一组生长迅速、侵袭性高、预后具有高度异质性的恶性非霍奇金淋巴瘤。近年来,IPI评分已经成为评价DLBCL患者预后的金标准,尽管IPI评分能够预测某些特定免疫亚型患者的病情进展,但是对于患病早期就需要了解病情变化以便进行早期治疗的患者却受到很多限制[10-11]。根据基因表达谱分型发现,相对non-GCB DLBCL、GCB-DLBCL患者有更好的预后,但是检测价格过于昂贵不利于临床上广泛应用和开展[12]。因此,对于能够真正指导个体化治疗和影响临床进程的指标,需要进一步探索和发现。
miRNA分子在转录后水平作用于靶标mRNA,调控细胞的增殖凋亡及耐药等生物学特征,同时作为抑癌基因或者癌基因影响肿瘤发生、发展[13]。多种miRNA分子在DLBCL中都有异常表达,其表达水平直接影响DLBCL的预后。LAWRIE等[14]曾经分析80例DLBCL患者中464种不同miRNA分子,发现miRNA能够相对准确地预测淋巴瘤的分型,有效地表明miRNA与淋巴瘤分化之间存在着密切的关系,为疾病早期诊断提供依据。miR-125家族包括miR-125a和miR-125b,WANG等[15]研究发现,高表达miR-125b的DLBCL患者预示复发、不良预后,它的失调先于临床表现的出现和影像学诊断,可作为评价治疗效果的新型预后靶向分子。
有报道认为[16-17],早期非小肺癌患者和肺癌细胞株中miR-125a-5p的表达量降低,在肺癌细胞中的表达水平可影响P53的表达和细胞凋亡。目前,miR-125a在DLBCL中的表达及其在药物抵抗和风险评估等方面中的作用少见报道。
NF-κB通路是本课题组研究DLBCL的发生、耐药及预后等临床进程中涉及的最重要的通路,A20基因TNFAIP3,是一个新的肿瘤抑制基因,它编码的A20蛋白是一种具有双重功能的锌指蛋白,它通过裂解MALT1泛素链(一种NFκB活化相关因子)或通过抑制IκB的磷酸化而抑制NFκB的活化[18]。国内外和本课题组前期的研究都发现,部分DLBCL中存在A20基因的缺失突变、错义突变和甲基化,且ABCDLBCL中A20甲基化发生率高于GCB-DLBCL,还发现A20的突变和甲基化与NF-κB活化及其下游靶基因MDR1编码的P-gp蛋白表达上调有关,A20突变的DLBCL中MDR1编码的产物P-gp蛋白表达增多[19]。有研究报道[4]A20基因是miR-125a和miR-125b的直接靶标,后两者经常在DLBCL中获得和/或过表达,这种异常表达抑制A20而导致NF-κB异常活化。本研究通过检测DLBCL肿瘤组织发现,DLBCL中miR-125a-5p的表达水平升高,且miR-125a-5p与肿瘤免疫表型之间存在相关性,推测miR-125a-5p在DLBCL中的上调表达也通过抑制A20的表达而促进NFκB的活化,异常活化的NFκ-B通过调节其下游靶基因而影响DLBCL的发生和发展。本研究发现,90例非特指DLBCL病例中,miR-125a-5p上调表达病例的耐药蛋白P-gp的表达明显升高,推测这可能是miR-125a-5p抑制A20表达而间接活化NF-κB的结果,并可能与DLBCL耐药有关。
近年来,在CHOP方案和利妥昔单抗+CHOP方案治疗DLBCL过程中,miRNA分子所发挥的预后潜在诊断价值越来越受到关注[20-21],本研究通过追踪51例DLBCL患者10年以上的生存及复发等情况,以miR-125a-5p表达的中位数为阈值,发现高表达组患者的OS和RFS均低于低表达组,且差异有统计学意义;单因素及多因素COX生存分析:患者的性别、年龄、免疫分型、原发部位、LDH、IPI评分及Ki67表达高低均与DLBCL预后没有相关性,而高表达miR-125a-5p、Ann Arbor分期Ⅲ、Ⅳ可作为预后危险指标。本研究发现,miR-125a-5p表达与Ann Arbor临床分期不存在相关性,而两者均与不良预后相关可能原因是,淋巴瘤Ann Arbor分期是按照病变累及的部位和范围进行划分,miR-125a-5p表达与DLBCL累及的部位和范围无相关,而它们对预后的影响可能分别各自存在着一定的机制和原因,等待进一步去探索和发现。同本实验结果不同的是,黄然欣等[22]发现,血清LDH水平可影响非霍奇金淋巴瘤(NHL)预后,正常血清LDH组比高LDH组药物治疗的有效率高。有研究发现[23],将miRNA分子与IPI结合来建立存活率模型进行肿瘤的临床结局评判会比单个模型更有利,而本实验中并未发现IPI评分与DLBCL患者预后存在相关性,联合评判到底取决于miRNA分子类别,还是与miRNA与IPI评分之间建立的关系模型有关,有待进一步研究。
综上所述,miR-125a-5p在DLBCL中发挥着类似癌基因的作用,且可能靶向作用于A20基因,活化NF-κB通路介导MDR1/P-gp途径,使患者对化疗药物产生抵抗影响预后,同时miR-125a-5p可作为评判DLBCL预后的分子标志物,未来的实验研究可一步步证实该结果的可靠性。

