没食子酸诱导非小细胞肺癌A549细胞凋亡的机制研究
张庭秀,马李杰,范贤明,肖贞良
(1.西南医科大学附属医院 呼吸内科,四川 泸州 646000;2.中国人民解放军成都军区总医院 呼吸内科,四川 成都 610083)
肺癌是呼吸系统最常见的恶性肿瘤之一,其发病率和死亡率在各系统肿瘤中均居首位,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌病例的85%以上,是肺癌中最常见的类型[1],且NSCLC发病机制复杂,尚无根治疗法。目前,NSCLC的临床治疗手段主要包括手术、放疗、化疗、靶向治疗等,均取得了一定疗效。但NSCLC 5年生存率仍低于15%[2],且很多患者不能耐受放化疗带来的毒副作用,同时对靶向药物产生耐药现象。中药多取自于各种天然物质,对人体的副作用小,在抗肿瘤方面已展现出独有特色。没食子酸(gallic acid, GA)是广泛存在于绿茶、葡萄等植物中的一种天然植物多酚化合物,在抗炎、抗菌、抗病毒、抗肿瘤等方面具有广泛的生物学效应[3]。近年来,其抗肿瘤活性已在宫颈癌、口腔鳞癌、胰腺癌及胶质瘤等多种类型的肿瘤细胞中得到证实[4],但其对NSCLC的作用及机制的相关报道较少。本研究目的在于探究GA对NSCLC A549细胞凋亡的影响及其可能的分子机制,为没食子酸应用于NSCLC的治疗提供可靠的理论依据。
1 材料与方法
1.1 试剂与仪器
A549细胞(上海拜力生物科技有限公司),无血清细胞冷冻保存培养基(RPMI 1640)及胰蛋白酶(美国Hyclone公司),青霉素链霉素溶液及胎牛血清(美国Gibco公司),Annexinv-FITC/PI凋亡检测试剂盒、MTT细胞增殖及细胞毒性检测试剂盒、增强化学发光试剂盒(北京索莱宝科技有限公司),没食子酸(纯度>98%)(上海源叶生物科技有限公司),qRT-PCR引物(成都擎科梓熙生物科技有限公司),β-actin及磷酸化酪氨酸激酶1(p-JAK1)抗体(武汉伊莱瑞特生物科技有限公司),酪氨酸激酶1(JAK1)、B淋巴细胞瘤2基因(Bcl-2)、Bcl-2相关X蛋白(Bax)、磷酸化信号转导与转录激活因子3(p-STAT3)抗体及辣根过氧化物酶标记二抗IgG(武汉博士德生物科技有限公司),信号转导与转录激活因子3(STAT3)抗体(美国Omnimabs公司),超净工作台(苏州安泰空气技术有限公司),二氧化碳培养箱及酶标仪(美国Thermo公司),流式细胞仪(德国Tecpar公司),全自动凝胶成像分析系统(美国UVP公司)。
1.2 细胞培养
A549细胞用含10%胎牛血清、100 μ/ml青霉素、100 μg/ml链霉素的RPMI 1640培养基于5%二氧化碳、37℃、饱和湿度条件下培养,每隔2~3 d用含EDTA的0.25%胰蛋白酶消化,按1︰2传代,取对数生长期细胞进行实验。
1.3 MTT法检测GA对A549细胞增殖的影响
采用RPM 1640完全培养基调整A549细胞密度至1×106个/ml,每孔200 μl接种于96孔板中,当细胞生长至70%时去除培养基,随机分为对照组与不同浓度GA组,GA组每孔分别加入GA终浓度为12、20和28 μg/ml的培养基200 μl;对照组每孔加入200 μl完全培养基,每组3个复孔。培养24 h后,去除培养基,每孔加入90 μl正常培养基及10μl MTT溶液,继续培养4 h后去除培养液,每孔加入二甲基亚砜110 μl,摇床上低速振荡10 min,酶标仪检测492 nm各孔吸光度(OD)。细胞生存率=(药物组OD值/对照组OD值)×100%,以上实验重复3次。
1.4 流式细胞术检测细胞凋亡
调整A549细胞密度至2×106个/ml,接种于6孔板中,每孔2 ml,培养至细胞长满底部70%时去除培养基,随机分为对照组与不同浓度GA组,GA组分别加入GA终浓度为12~28 μg/ml的培养基2 ml,对照组加入完全培养基2 ml。培养24 h后收集细胞,4℃预冷磷酸盐缓冲溶液(PBS)洗涤、离心、收集细胞,重悬于1×Blinding Buffer液中,调整细胞密度至2×106个/ml,取100μl细胞悬液加入5 μl Annexin V-FITC混匀,室温避光孵育10 min,再加入5 μl PI溶液,室温避光孵育5 min,立即用流式细胞仪检测细胞凋亡情况。
1.5 Western blot检测细胞中JAK1、STAT3、p-JAK1、p-STAT3、Bax及Bcl-2蛋白表达
收集正常培养基与不同浓度GA干预24 h后的A549细胞,按全蛋白提取试剂盒提取总蛋白,并依据BCA蛋白定量试剂盒进行蛋白定量。将上样缓冲液与蛋白样品按1︰5比例混合,100℃水煮10 min使蛋白充分变性。根据蛋白定量检测结果,按等量上样原则,SDS-PAGE凝胶电泳,电泳后转膜至硝酸纤维素膜上,5%脱脂奶粉或牛血清白蛋白封闭2 h,加入一抗稀释液4℃孵育过夜,复温,洗涤,二抗稀释液室温孵育1 h,洗涤,化学发光试剂盒显色,全自动凝胶成像分析系统测定电泳条带灰度积分。
1.6 qRT-PCR检测细胞中JAK1、STAT3、Bax、Bcl-2 mRNA的表达
给予A549细胞不同浓度GA干预24 h后,Trizol法提取各组细胞总RNA,再逆转录为cDNA,以GAPDH为内参,采用qRT-PCR法测量JAK1、STAT3、Bax、Bcl-2 mRNA表达量。GAPDH引物序列正向 :5'-ACTTTGGTATCGTGGAAGGACTCAT-3',反向 :5'-GTTTTTCTAGACGGCAGGTCAGG-3'。STAT3引物序列正向:5'-ACCAAGCGAGGACTGAGCATC-3',反向:5'-CAGCCAGACCCAGAAGGAGAA-3'。JAK1引物序列正向:5'-ACCAGGATGCGGATAAATAATG-3',反 向 :5'-GTTTCCAAGGTAGCCAAGTATTT-3'。Bax引物序列正向:5'-TTTTGCTTCAGGGTTTCATCCA-3',反向引物为5'-TGCCACTCGGAAAAAGACCTC-3'。Bcl-2引物序列正向:5'-ATCGCCCTGTGGATGACT GA-3',反向 :5'-GAGACAGCCAGGAGAAATCAAAC-3',用基因相对定量法(2-ΔΔCt)计算目的基因表达量。
1.7 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,均进行正态性检验,多组间样本均数比较前行方差齐性检验,组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 GA抑制A549细胞的增殖
实验中予以正常培养基、不同浓度GA干预A549细胞24 h后,MTT法检测细胞生存率,结果显示,12~28μg/ml GA作用24 h后,相对于对照组,GA组中A549细胞生存率分别降低至(80.49±0.17)%、(66.57±0.38)%和(51.81±3.04)%,经方差分析,差异有统计学意义(P<0.05),提示GA能抑制A549细胞增殖。进一步两两比较,12 μg/ml组与20μg/ml组和28μg/ml组比较,经LSD-t检验,差异有统计学意义(t=4.164和6.910,P=0.014和0.002);说明GA能抑制A549细胞增殖,且随着GA浓度的增加,其对A549细胞生长抑制作用逐渐增强(见表1)。此外,为进一步明确GA干预时间对A549细胞生长的影响,给予A549细胞28μg/ml GA干预6~48 h,结果显示,随着干预时间的延长,A549细胞生存率逐渐降低,经方差分析,差异有统计学意义(P<0.05),进一步两两比较,0 h组与6 h组比较,6 h组中细胞生存率降低(t=7.878,P=0.001);6 h组与24 h组比较,细胞生存率下降(t=5.329,P=0.006);6 h组与48 h组比较,48 h组中细胞生存率进一步下降(t=7.630,P=0.002)(见表2)。结果表明,GA呈浓度、时间依赖性抑制A549细胞生长。
2.2 GA浓度依赖性诱导A549细胞凋亡
给予A549细胞正常培养基、不同浓度GA干预24 h,流式细胞术Annexin V-FITC双染法检测细胞凋亡率(见图1A),结果显示,对照组细胞凋亡率为(8.06±0.48)%,12~28 μg/m GA组细胞凋亡率依次为(9.77±0.11)%、(13.89±0.47)%和(20.56±0.51)%,经方差分析,差异有统计学意义(F=118.689,P=0.000),进一步两两比较,12μg/ml GA组与对照组比较,差异无统计学意义(t=-1.667,P=0.171);20μg/ml GA组与对照组比较,细胞凋亡率增加(5.83±0.45)%(t=-7.867,P=0.001);28 μg/ml GA组与20 μg/ml GA组比较,细胞凋亡率增加(6.67±0.49)%(t=-9.150,P=0.001),结果表明,GA呈浓度依赖性诱导A549细胞凋亡,见图1B。
表1 不同浓度GA干预A549细胞24 h后各组细胞生存率比较 (%,±s)
表1 不同浓度GA干预A549细胞24 h后各组细胞生存率比较 (%,±s)
组别 细胞生存率对照组100.00±0.00 12 μg/ml GA组80.49±0.17 20 μg/ml GA组66.57±0.38 28 μg/ml GA组51.81±3.04 F值489.203 P值0.000
表2 28μg/ml GA干预不同时间后各组细胞生存率比较(%,±s)
表2 28μg/ml GA干预不同时间后各组细胞生存率比较(%,±s)
组别 细胞生存率0 h组100.00±0.00 6 h组64.45±2.56 24 h组51.81±3.04 48 h组48.50±1.85 F值94.809 P值0.000
2.3 GA对各组细胞中JAK1、STAT3、Bax、Bcl-2 mRNA表达水平的影响
给予A549细胞正常培养基、12~28 μg/ml GA干预24 h后,qRT-PCR检测细胞中JAK1、STAT3、Bax、Bcl-2 mRNA表达,结果显示,12 μg/ml GA组与对照组、28μg/ml GA组比较,随着GA浓度增加,GA组中BaxmRNA表达逐渐升高(t=-4.721和-7.149,P=0.002和0.000),Bcl-2 mRNA表达逐渐降低(t=3.641和7.715,P=0.007和0.000),但各组细胞中JAK1、STAT3 mRNA表达差异无统计学意义(F=1.012和0.081,P=0.436和0.968)。见图2。
2.4 GA对A549细胞中JAK1、STAT3、p-JAK1、p-STAT3及Bax、Bcl-2蛋白表达的影响
通过Western blot检测不同浓度GA干预24 h对A549细胞中JAK1、STAT3及其磷酸化活性形式和凋亡相关蛋白Bax、Bcl-2表达的影响,探究其凋亡相关机制。结果显示,随着GA浓度的增加,12μg/ml GA组与对照组、28μg/ml GA组比较,GA浓度依赖性降低细胞中p-JAK1(t=2.978和8.212,P=0.041和0.001)及Bcl-2蛋白表达(t=7.520和2.932,P=0.002和0.043),增加Bax蛋白表达(t=-2.901和-4.647,P=0.044和0.010);此外,12μg/ml GA组与对照组比较,p-STAT3表达差异无统计学意义(t=0.728,P=0.507),但20 μg/ml GA组与对照组、28μg/ml GA组比较,p-STAT3的表达逐渐降低(t=6.907和4.874,P=0.002和0.008),见图3、4。
图1 各组细胞凋亡率

图2 各组细胞中STAT3、JAK1、Bax、Bcl-2 mRNA表达
图3 不同浓度GA对A549细胞中Bax、Bcl-2蛋白表达的影响
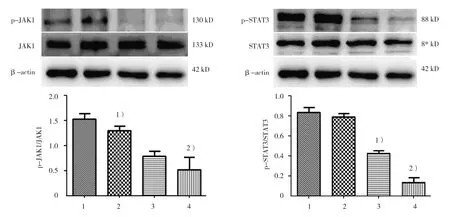
图4 不同浓度GA对A549细胞中JAK1、p-JAK1、STAT3、p-STAT3蛋白表达的影响
3 讨论
细胞死亡有2种途径,①病理性死亡,即坏死;②生理性死亡,即凋亡。细胞凋亡是细胞在一定条件下遵循自身遗传基因决定的调控程序,自动结束生命周期的过程。但细胞凋亡并非全都是自发的程序性死亡,当外界环境影响细胞后,也会诱导细胞凋亡。而肿瘤的发生不仅与细胞的增殖和分化异常有关,也与细胞的异常凋亡有关,因此,诱导肿瘤细胞凋亡也是许多抗肿瘤药物主要作用机制[5-7]。本研究采用MTT法及流式细胞术观察不同浓度GA干预A549细胞不同时间对A549细胞增殖、凋亡的影响。结果显示,随着GA浓度的增加,干预时间的延长,A549细胞存活率逐渐降低,而凋亡率逐渐增加,且GA与A549细胞存活率及凋亡率之间存在浓度、时间依赖关系,与郗艳丽等[8]研究结果一致。以上结果表明,GA通过抑制A549细胞增殖、诱导其凋亡实现抗肿瘤作用,但具体机制有待进一步研究。
肿瘤的发生是多因素、多机制参与的结果,涉及到一系列信号通路的改变,如MAPK、PI3K/AKT/mTOR、JAK/STAT3等信号通路[9-10]。在GA抗肿瘤作用的相关研究中,LIANG[11]、HE[4]等已证实,GA通过干预PI3K、MAPK等信号通路发挥其抗肿瘤作用;但尚未见GA在肿瘤细胞JAK/STAT3信号通路中作用的相关性研究报道。
JAK/STAT3信号通路主要由JAK蛋白酪氨酸激酶(JAK)及信号转导与转录激活因子3(STAT3)组成,当细胞表面受体与配体如白细胞介素6(IL-6)或表皮生长因子(EGFR)等结合时,可使受体酪氨酸激酶JAK磷酸化,进而激活胞浆中的STAT3单体,该STAT3单体被p-JAK激活后发生二聚化,形成p-STAT3,然后穿过核膜进入核内调节相关基因的表达,进而调控细胞增殖、分化、凋亡等[12-13]。在正常细胞中,STAT3蛋白呈短暂性激活,而肿瘤细胞中的STAT3蛋白则被持续性激活,以促进肿瘤细胞的生长、增殖并抑制细胞凋亡[14]。此外,有研究发现,NSCLC细胞系中普遍存在STAT3的激活,且免疫组织化学技术检测也发现55%的NSCLC组织中存在STAT3的激活[15],表明STAT3的激活与NSCLC的发生有关,而抑制STAT3的激活可阻断肿瘤细胞中STAT3信号通路,为许多癌症患者提供一种新的治疗方法。
本研究采用qRT-PCR及Western blot检测细胞中STAT3信号通路相关基因和蛋白的表达。结果显示,随GA浓度的增加,A549细胞中JAK1、STAT3基因转录及蛋白表达水平无显著变化,但GA呈剂量依赖性抑制STAT3信号通路中JAK1、STAT3蛋白的磷酸化,进而抑制STAT3信号通路的激活,下调抗凋亡蛋白Bcl-2、上调促凋亡蛋白Bax的基因转录及蛋白表达,最终启动肿瘤细胞凋亡程序,诱发细胞凋亡。
综上所述,GA对A549细胞具有生长抑制及凋亡诱导作用,该作用是通过抑制STAT3的磷酸化激活,进而抑制STAT3信号通路而实现,这进一步完善了GA抗肿瘤作用机制的研究,为GA应用于NSCLC的临床治疗奠定了理论基础,但应用于临床仍需进一步药物毒性实验及体内实验研究的支持。

