1,25-(OH)2D3对肺纤维化大鼠中PI3K、AKT、mTOR表达的影响及其机制研究*
董洪亮,刘乃国,苗双,郑静,倪娜,王楠,成苗青
(滨州医学院附属医院 1.临床医学实验室,2.肿瘤研究中心,山东 滨州 256603)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF),是一种慢性炎症性间质性肺疾病,病因不明,是一种常见的致命性肺部疾病,目前尚无有效的治疗方法[1-3]。因而探索其发病机制,寻求新的有效的治疗措施是非常必要的。
有研究发现,PI3K-AKT-mTOR通路与心脏纤维化、肝脏纤维化,以及肾脏纤维化等纤维化疾病发病机制有关[4-6]。也有报道称该通路可能与肺纤维化发病有关[7-8]。活性维生素D3[(1,25-(OH)2D3)]能够通过影响Wnt通路改善博来霉素所致的小鼠肺纤维化[9],提示1,25-(OH)2D3可能对肺纤维化有一定的治疗作用。但是1,25-(OH)2D3在大鼠IPF中是否对PI3KAKT-mTOR通路有影响尚未见报道。
本研究旨在探讨大鼠IPF发生过程中,肺组织中PI3K-AKT-mTOR信号通路的变化及1,25-(OH)2D3对此通路的影响,评价1,25-(OH)2D3对大鼠IPF的干预作用,为揭示肺纤维化的发生机制和探讨新的治疗措施提供科学依据。
1 材料与方法
1.1 材料、试剂及引物
90只6~8周龄SPF级雄性SD大鼠购自鲁抗医药实验中心(许可证号:SCXK鲁2013000),博来霉素(日本化学株式会社生产,15 mg/支,批号:030201),1,25-(OH)2D3购自德国Sigma公司,HiFi Script Quick gDNA Removal cDNA Kit、Maxima SYBR Green/Fluorescein qPCR Master Mix购自北京康为世纪生物科技有限公司,超敏二步法免疫组织化学检测试剂(PV-9001/2)、DAB试剂盒(ZLI-9019)购自北京中杉金桥生物科技有限公司。
应用Primer(version 5.0)软件,根据大鼠PI3K、AKT、mTOR的基因序列,分析设计特异性引物由上海生工生物工程技术服务有限公司合成。内参基因GAPDH的引物由上海生工生物工程技术服务有限公司,引物序列见表1。

表1 所用引物序列
1.2 动物实验分组
90只200 g左右雄性SD大鼠,随机分为模型组、治疗组、对照组,每组各10只。大鼠腹腔注射4%水合氯醛(200~300 μl/只)进行麻醉后,模型组和治疗组采用单次气管内注射博来霉素(5.0 mg/kg)的方法进行肺纤维化模型的复制[10],对照组气管内注射生理盐水(200 μl/只)。自第2天起,模型组腹腔注射1,25-(OH)2D3的溶剂(200 μl/只,0.1%乙醇和99.9%的丙二醇),1次/2 d;治疗组腹腔注射1,25-(OH)2D3[按体重2 μg/kg,1,25-(OH)2D3溶于0.1%乙醇和99.9%的丙二醇][11],1次/2 d;对照组腹腔注射生理盐水(200 μl/只),1次/2 d。各小组于第14、21和28天分别处死10只大鼠,取肺组织进行后续试验。
1.3 肺组织羟脯氨酸含量的检测
SD大鼠处死后,取肺组织100 mg,采用碱水解法,根据羟脯氨酸检测试剂盒说明书进行操作,每个样品重复检测3次,取其平均值。
1.4 Real-time PCR法检测PI3K、AKT、mTOR mRNA表达
1.4.1 肺组织总RNA的提取及cDNA的合成
Trizol法提取大鼠肺组织总RNA,用紫外分光光度计检测总RNA纯度和浓度,以OD260/280在1.8~2.0为标准。用HiFi Script Quick gDNA Removal cDNA Kit进行逆转录。合成的cDNA保存于-80℃,备用。
1.4.2 Real-time PCR检测 以GADPH作为内参基因,用Real-time PCR对肺组织中PI3K、AKT、mTOR的表达进行相对定量。反应体系:12.5 μl 2×Maxima SYBR Green Mix,1 μl Forward Primer,1 μl Reverse Primer,模板1 μl,RNase-free Water补足至25 μl。扩增反应条件:95℃ 10 min,变性95℃ 10 s,退火60℃ 10 s,延伸72℃ 15 s,40个循环。所得数据用2-△△Ct法进行统计分析。
1.5 免疫组织化学法检测PI3K、AKT、mTOR蛋白表达水平
各组肺组织,4%多聚甲醛固定48 h后,进行修块、脱水、透明、石蜡包埋;组织切片(4μm)经常规脱蜡至水后,进行抗原修复(95℃,10 min),去除内源性辣根过氧化酶(3% H2O2甲醇溶液,处理20 min);滴加一抗,4℃过夜,洗涤;滴加相应二抗,37℃。孵育1 h,洗涤;DAB显色,苏木素复染;最后脱水、透明、封片。操作过程中设阴性对照,以1%PBS代替一抗。光镜下进行组织观察、拍照,以胞质浆内出现明显的棕黄色颗粒或斑块为阳性表达。Motic Med 6.0数码医学图像分析系统进行图像分析。
1.6 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠不同时间点肺组织羟脯氨酸含量比较
实验第14、21和28天对检测到的各组羟脯氨酸(HYP)的含量进行方差分析,结果显示:第14天HYP含量差异有统计学意义(F=15.536,P=0.003);第21天HYP含量差异有统计学意义(F=39.964,P=0.000);第28天HYP含量差异有统计学意义(F=73.524,P=0.000)。两两比较采用LSD-t检验,模型组和治疗组的HYP含量均比相应时间对照组的HYP含量高,差异有统计学意义(P<0.05)。治疗组在各时间点的HYP含量比相应时间模型组的HYP含量低,差异有统计学意义(P<0.05)。见表2。
表2 各组大鼠肺组织中羟脯氨酸含量比较(n =10,μg/mg,±s)

表2 各组大鼠肺组织中羟脯氨酸含量比较(n =10,μg/mg,±s)
注:1)与对照组比较,P <0.05;2)与模型组比较,P <0.05
组别 第14天 第21天 第28天对照组481±102452±127475±129模型组832±1371)1 025±741)1 182±751)治疗组650±701)2)820±1281)2)858±851)2)F值15.53639.96473.524 P值0.0000.0000.000
2.2 各组大鼠肺组织中PI3K、AKT及mTOR mRNA表达比较
实验第14、21和28天,模型组和治疗组中PI3K、AKT及mTOR的mRNA相对表达量均高于相应时间的对照组,差异有统计学意义(P<0.05),治疗组在各时间,上述3个基因的mRNA相对表达量均低于模型组,差异有统计学意义(P<0.05)。见表3。
2.3 各组大鼠肺组织中PI3K、AKT及mTOR蛋白表达的比较
蛋白PI3K、AKT及mTOR在各组肺组织中,主要在肺泡上皮细胞、肺泡巨噬细胞、成纤维细胞和肌成纤维细胞中有明显表达。
表3 各组大鼠肺组织中PI3K、AKT及mTOR相对表达量的比较 (±s)
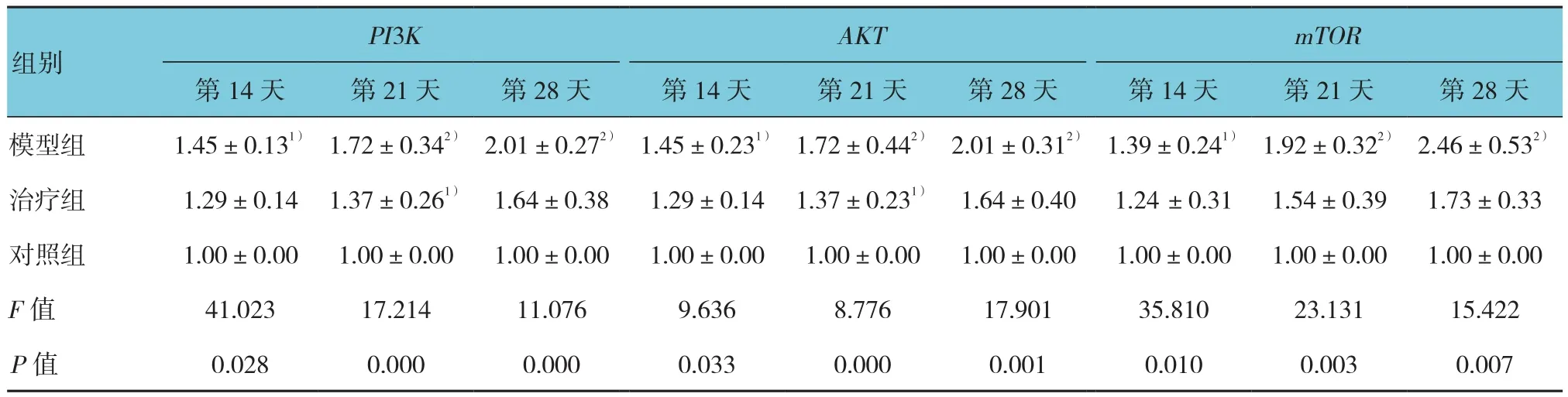
表3 各组大鼠肺组织中PI3K、AKT及mTOR相对表达量的比较 (±s)
注:1)与对照组比较,P <0.05;2)与治疗组比较,P <0.05
PI3KAKTmTOR第14天 第21天 第28天 第14天 第21天 第28天 第14天 第21天 第28天模型组1.45±0.131)1.72±0.342)2.01±0.272)1.45±0.231)1.72±0.442)2.01±0.312)1.39±0.241)1.92±0.322)2.46±0.532)治疗组1.29±0.141.37±0.261) 1.64±0.381.29±0.141.37±0.231)1.64±0.401.24 ±0.311.54±0.391.73±0.33对照组1.00±0.001.00±0.001.00±0.001.00±0.001.00±0.001.00±0.001.00±0.001.00±0.001.00±0.00 F值41.02317.21411.0769.6368.77617.90135.81023.13115.422 P值0.0280.0000.0000.0330.0000.0010.0100.0030.007组别
实验第14、21和28天,对检测的3个基因的蛋白质表达量进行方差分析,差异有统计学意义(P<0.05)。两两比较采用LSD-t检验,模型组和治疗组在各时间PI3K、AKT、mTOR 3种蛋白的表达量均高于对照组,差异有统计学意义(P<0.05),治疗组在各时间的3种蛋白的表达量均低于模型组,差异有统计学意义(P<0.05)。见表4和附图。
表4 各组大鼠肺组织中PI3K、AKT及mTOR蛋白的表达 (积分吸光度IA,±s)
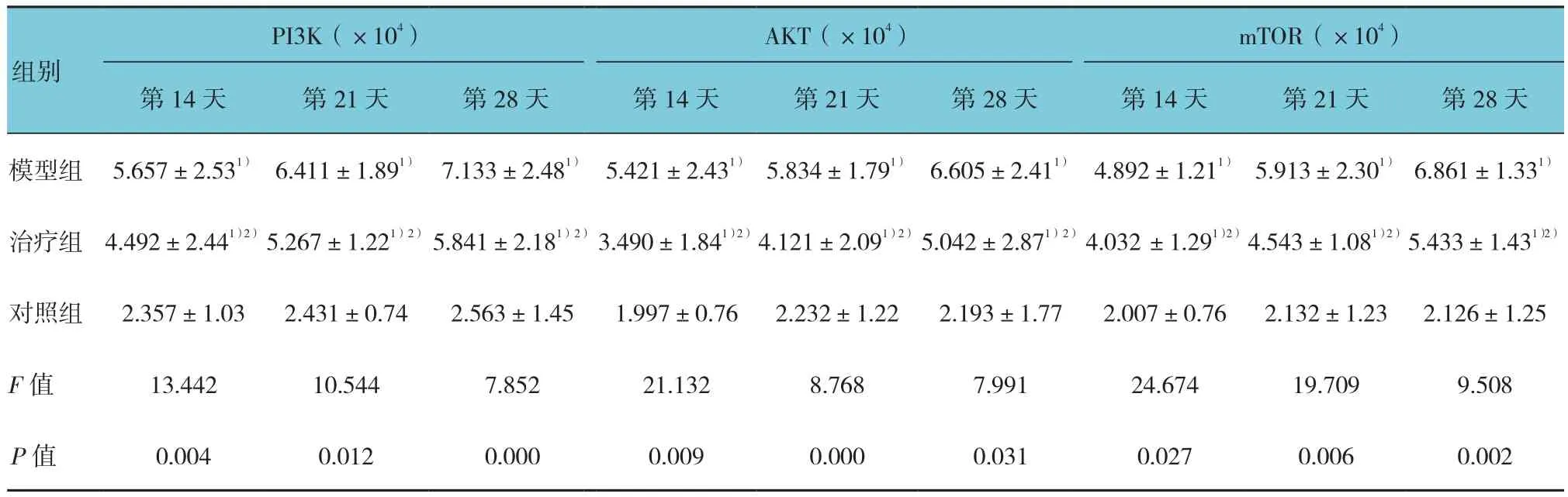
表4 各组大鼠肺组织中PI3K、AKT及mTOR蛋白的表达 (积分吸光度IA,±s)
注:1)与对照组比较,P <0.05;2)与模型组比较,P <0.05
PI3K(×104)AKT(×104)mTOR(×104)第14天 第21天 第28天 第14天 第21天 第28天 第14天 第21天 第28天模型组5.657±2.531)6.411±1.891)7.133±2.481)5.421±2.431)5.834±1.791)6.605±2.411)4.892±1.211)5.913±2.301)6.861±1.331)组别治疗组4.492±2.441)2)5.267±1.221)2)5.841±2.181)2)3.490±1.841)2)4.121±2.091)2)5.042±2.871)2)4.032 ±1.291)2)4.543±1.081)2)5.433±1.431)2)对照组2.357±1.032.431±0.742.563±1.451.997±0.762.232±1.222.193±1.772.007±0.762.132±1.232.126±1.25 F值13.44210.5447.85221.1328.7687.99124.67419.7099.508 P值0.0040.0120.0000.0090.0000.0310.0270.0060.002

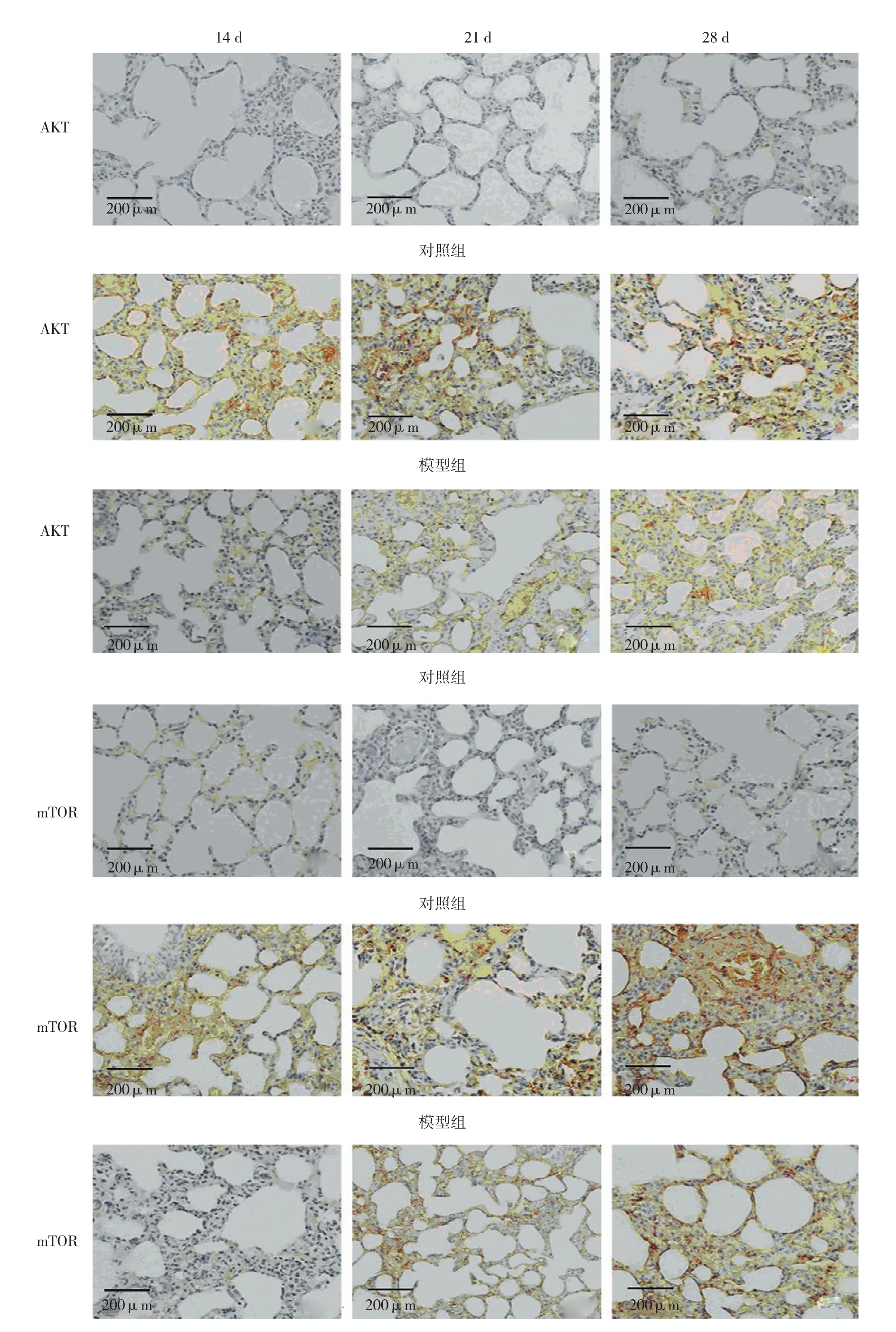
附图 PI3K、AKT及mTOR在各组大鼠肺组织中的表达
3 讨论
IPF发病隐匿,至今仍然缺乏有效治疗方法,诊断后的平均寿命仅为2~3年[12-13]。HYP含量是评价肺纤维化程度的金标准。本研究中,模型组肺组织HYP含量在实验第14、21和28天均高于对照组;而治疗组中肺组织HYP的含量在上述3个时间点均低于模型组。提示1,25-(OH)2D3对博来霉素诱导的大鼠肺纤维化有一定的干预效果。
PI3K是磷脂激酶家族中重要一员,其活化产物PIP3能够激活AKT蛋白,进一步磷酸化mTOR的Ser2448位点激活mTOR,从而增强细胞的生长与分化[14]。已有研究报道PI3K-AKT-mTOR通路参与多种器官的纤维化,本研究发现,在实验第14、21和28天,模型组肺组织中,PI3K、Akt、mTOR3种基因在mRNA水平和蛋白质水平均高于对照组;免疫组织化学结果显示,各组肺组织中PI3K、AKT、mTOR 3种蛋白在肺泡上皮细胞、肺泡巨噬细胞、成纤维细胞和肌成纤维细胞中有阳性表达,模型组各类细胞中阳性信号强于对照组。有研究报道,肺泡Ⅱ型上皮细胞、巨噬细胞、成纤维细胞及肌成纤维细胞在肺纤维化的发生发展过程中起重要作用[15],以上定量定位结果都提示PI3K-AKT-mTOR通路与大鼠肺纤维化的发生与发展有着密切联系。
给予1,25-(OH)2D3进行干预后,发现在实验第14、21和28天,治疗组肺组织中PI3K、AKT、mTOR3种基因在mRNA水平和蛋白质水平的表达均低于模型组。免疫组织化学结果显示,在上述3个时间点,治疗组中3种蛋白在肺泡Ⅱ型上皮细胞、巨噬细胞、成纤维细胞及肌成纤维细胞的表达信号也弱于模型组。说明在大鼠肺纤维化发生、发展过程中,1,25-(OH)2D3对PI3K-AKT-mTOR通路有一定的抑制作用。
综上所述,在大鼠IPF的发生、发展过程中,PI3K-AKT-mTOR通路起重要作用,1,25-(OH)2D3对大鼠IPF有一定的治疗作用,其作用机制与抑制PI3K-AKT-mTOR通路有关。

