HOXD3在乳腺癌细胞干性和化疗耐药性中的作用及机制研究*
乳腺癌是影响全球女性健康最常见的癌症,全球女性乳腺癌发病率和死亡率分别占女性癌症的25%和15%[1]。虽然随着诊疗水平的提高,其发病率和死亡率均有所改善,但肿瘤干细胞(cancer stem cells,CSCs)的存在及耐药性的发生仍给治疗带来巨大难度[2]。对于复发性乳腺癌,耐药几乎不可避免,因此了解肿瘤耐药的分子机制尤为重要。本研究旨在通过探讨同源盒基因HOXD3表达对乳腺癌细胞恶性生物学行为及耐药性的影响。
1 材料与方法
1.1 材料
1.1.1 一般资料 收集2006年1月至2008年12月于哈尔滨医科大学附属肿瘤医院行乳房切除术且病理确诊乳腺癌的组织标本87例。组织标本收集后在液氮中冷冻,并储存于-80℃用于分析。
1.1.2 主要试剂 兔抗人多克隆HOXD3抗体购自美国Santa Cruz公司;兔二抗、DAB显色剂均购自北京中杉金桥生物技术公司;DMEM培养基、PBS均购自美国Gibco公司;PVDF膜购自美国Millipore公司;Li⁃pofectamine2000购自美国Invitrogen公司。
1.2 方法
1.2.1 免疫组织化学方法 使用常规免疫组织化学方法检测乳腺癌组织中HOXD3表达。组织蜡块4 μm切片附于载玻片上,经二甲苯脱蜡、梯度酒精脱水后,于柠檬酸中高温高压修复,滴加抗HOXD3抗体,4℃孵育过夜。滴加生物素标记二抗,DAB显色,苏木素复染,甘油凝胶封片。
1.2.2 细胞培养、转染和处理 使用含10%胎牛血清的DMEM培养液培养乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-435。取对数生长期的人乳腺癌细胞,使用无血清DMEM/F12培养基培养7~10天后,光镜下观察细胞球,测量、计数、拍照。从MDA-MB-231 mRNA中扩增HOXD3 cDNA,将其克隆至pcDNA3.1载体中,生成HOXD3过表达质粒。Lipofectamine2000根据说明书用于质粒转染。转染后使用不同剂量顺铂或阿霉素处理乳腺癌细胞,检测其半抑制浓度(half maximal inhibitory concentration,IC50)。
1.2.3 RT-PCR检测 使用TRIzol提取总RNA,Takara反转录试剂盒进行反转录,获得总cDNA。分别扩增目的基因和对照内参β-actin,反应条件为预变性95℃15min、94℃ 15 s、60℃ 30 s、72℃ 60 s,40个循环,95℃ 15 s、60℃15 s、95℃15 s以验证PCR产物的特性。采用Sequence Detector System 2.0软件进行数据分析,计算相关基因的相对表达量,使用引物见表1。

表1 基因及引物序列
1.2.4 Western blot检测 使用蛋白裂解液在4℃裂解细胞30 min,提取总蛋白,BCA法进行蛋白定量分析。经SDS/PAGE凝胶电泳后转移至PVDF膜;质量分数5%脱脂奶粉封闭PVDF膜1 h,分别加入一抗,4℃过夜,洗膜后加入二抗,室温孵育2 h;洗膜后加ECL试剂,将PVDF膜放入X线暗盒,压片,显影,定影。使用GD5800分析系统对条带进行定量分析。
1.2.5 免疫荧光染色法 细胞在盖片上生长融合到85%时,从孵箱中取出;PBS洗涤后用4%甲醛固定20 min;5%BSA室温封闭30 min;加入抗HOXD3抗体于4℃温育过夜;PBS洗涤后,加二抗室温孵育30 min;DAPI核染色后封片。
1.2.6 MTT法 收集对数生长期MDA-MB-231和MDA-MB-435细胞,调整细胞浓度为5×103/mL,取500 μL接种于96孔培养板,分别在第0、1、2、5、6天每孔加入浓度为5 mg/mL MTT溶液20 μL,37℃温育4 h后移除上清,加入100 μL二甲基亚砜(DMSO),590 nm波长处测定吸光度值。
1.3 统计学分析
使用SPSS 22.0软件进行统计学分析。结果以均数±标准差()表示,采用单因素方差分析(ANO⁃VA)进行序列分析,非配对t检验进行组间比较。P<0.05为差异具有统计学意义。
2 结果
2.1 HOXD3在乳腺癌组织和细胞系中的表达
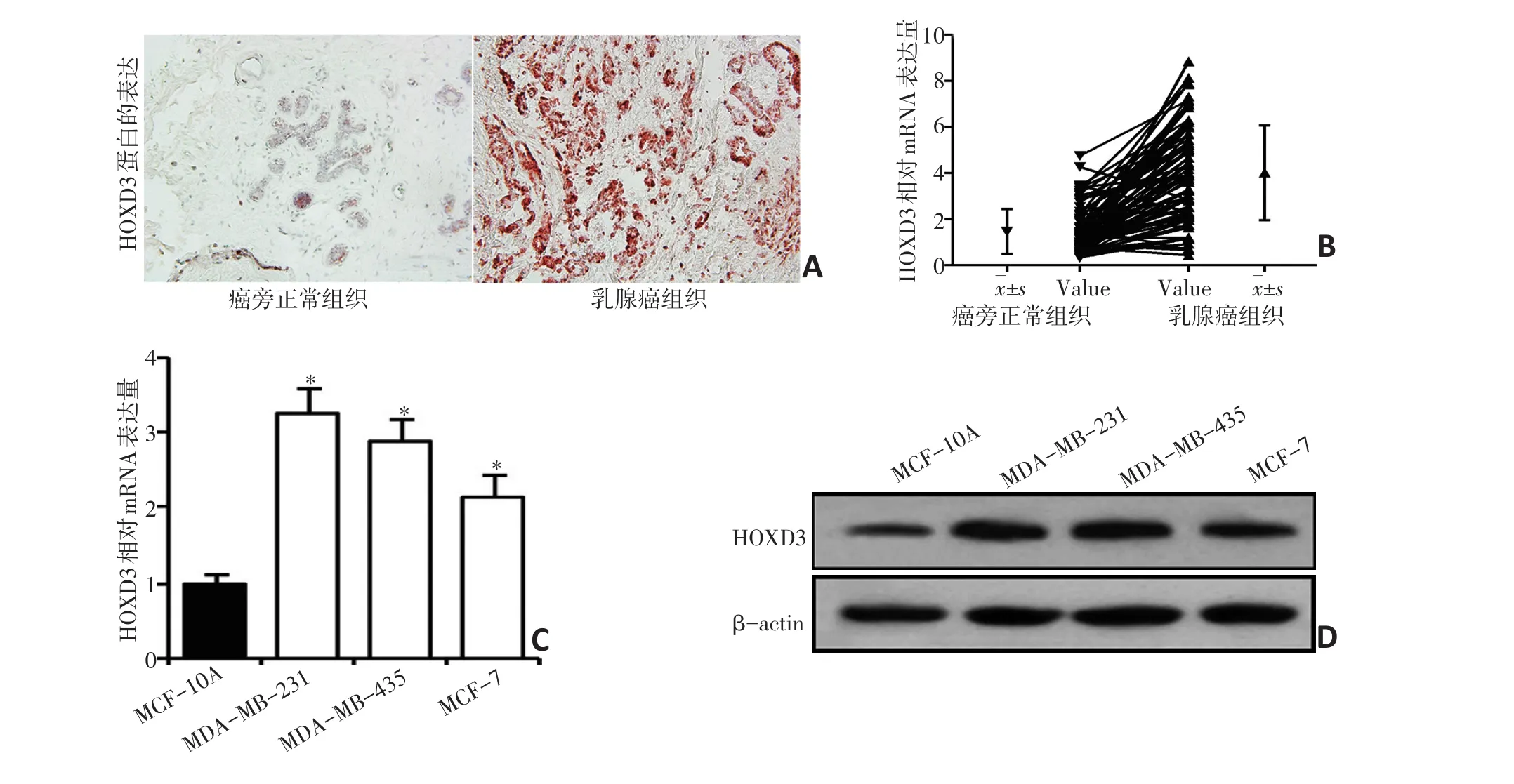
图1 87例乳腺癌组织和癌旁正常组织及乳腺癌细胞系MDA-MB-231、MDA-MB-435、MCF-7中HOXD3的mRNA和蛋白表达水平
本研究发现,HOXD3在乳腺癌组织及乳腺癌细胞系MDA-MB-231、MDA-MB-435和MCF-7中的蛋白或基因表达水平,均显著高于癌旁正常组织及正常乳腺上皮细胞系MCF-10A(均P<0.05,图1)。提示HOXD3在乳腺癌组织及细胞系中高表达可能对乳腺癌恶性生物学行为的维持起重要作用。
2.2 HOXD3在乳腺癌耐药细胞系中的表达及对耐药性的影响
本研究分别建立了对顺铂或阿霉素耐药的细胞系MDA-MB-231和MDA-MB-435,检测发现两种细胞系的IC50分别为(20.82±0.05)μmol/L和(19.69±0.47)μmol/L,或(32.26±0.23)mmol/L和(26.08±0.55)mmol/L,均高于对应原细胞系(均P<0.05),MDA-MB-231细胞的IC50更高,耐药倍数分别为2.47和3.10倍,或1.86和2.08倍(图2A)。采用RT-PCR法及免疫荧光染色法检测HOXD3在耐药细胞系中的表达发现,耐药细胞系中HOXD3的表达水平均明显高于原始细胞(均P<0.05,图2B~D)。使用HOXD3过表达质粒转染原始MDA-MB-231和MDA-MB-435细胞发现,HOXD3 mRNA和蛋白表达水平均明显增高(均P<0.01,图3A~B),随后使用顺铂或阿霉素处理,MTT法和集落形成实验表明,HOXD3过表达的MDA-MB-231和MDA-MB-435细胞活力及集落形成能力显著增加(均P<0.05,图3C~F)。

图2 顺铂或阿霉素耐药的乳腺癌细胞系MDA-MB-231和MDA-MB-435中HOXD3表达
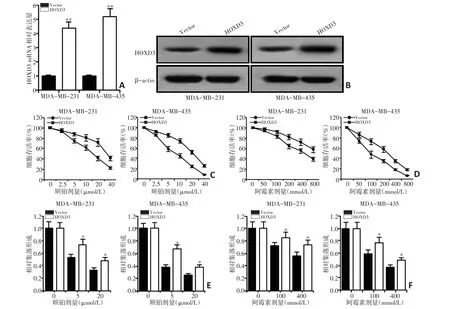
图3 乳腺癌耐药细胞系MDA-MB-231和MDA-MB-435中HOXD3表达及对耐药性的影响
2.3 HOXD3对乳腺癌细胞干性的影响
本研究发现,MDA-MB-231和MDA-MB-435细胞中HOXD3表达上调导致肿瘤球体数目显著增加(均P<0.05,图4A),HOXD3过表达的MDA-MB-231和MDA-MB-435细胞中,乳腺癌干细胞的生物标记物CD133、Nanog、Oct4和SOX2等的表达水平显著增加(均P<0.05,图4B~D),HOXD3表达上调可促进乳腺癌细胞增殖(图4E)。
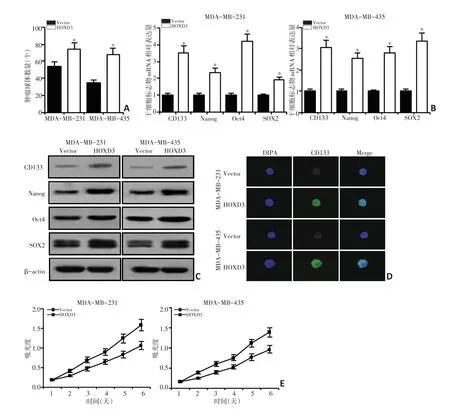
图4 HOXD3对乳腺癌MDA-MB-231和MDA-MB-435细胞干性的影响
3 讨论
既往的研究提示,乳腺癌干细胞是产生化疗耐药,造成乳腺癌复发的根源[3]。本研究结果提示,HOXD3过表达对乳腺癌细胞干性维持及耐药性的产生发挥重要的作用,HOXD3在乳腺癌组织及乳腺癌细胞系中的基因或蛋白水平显著高于癌旁正常组织及正常乳腺细胞。HOXD3可促进乳腺癌干细胞标志物的表达上调,并对乳腺癌干细胞自我更新能力的维持起着重要的作用。此外,本研究还证实HOXD3表达可促使乳腺癌细胞产生多重耐药。CSCs是肿瘤细胞内一小群具有自我更新、无限增殖及多向分化潜能的细胞,大量证据支持CSCs引起化疗耐药的理论,CSCs对常规放化疗表现出强烈的抵抗能力,被认为是肿瘤发生、发展、转移与复发的根源[4-6]。耐药分为固有耐药及获得性耐药,或两者兼有。固有耐药可能与上皮间充质转换(epithelial mesenchymal tran⁃sition,EMT)、CSCs自然静止倾向、DNA修复能力增强,以及ATP-结合盒(ATP-binding cassette,ABC)转运蛋白高表达从而导致药物外流等因素有关[5]。获得性耐药则可能与治疗过程中存活的干细胞亚群累积突变,产生耐药表型有关[7]。CSCs介导化疗耐药的机制尚未完全明确,目前已知多种信号通路Hedge⁃hog、JAK/STAT3、TGF-β、Wnt/β-catenin等可能在乳腺癌干细胞介导的化疗耐药过程中发挥重要作用[8-10]。
HOX基因家族是一个高度保守的转录因子家族,在正常生理发育过程中,HOX基因家族调控所有多细胞生物体形态发生和细胞分化[11]。此外,HOX基因家族在肺癌、乳腺癌等多种肿瘤中异常表达,且与肿瘤的预后及分期密切相关[12-13]。HOXD3是哺乳动物四种同源盒基因簇之一,在正常成人组织中的表达具有时间特异性及组织特异性,并通过调节细胞运动和细胞间相互作用维持细胞结构的完整性[14]。Miyazaki等[12]研究表明,在人红白血病和肺癌细胞中,HOXD3高表达可增加TGF-β依赖性和非依赖性信号通路的活性,增强癌细胞的运动能力和侵袭能力。本课题组既往的研究证实,HOXD3高表达乳腺癌患者的5年无进展生存及总生存显著低于HOXD3低表达者,HOXD3是乳腺癌预后不良的独立危险因素[13]。本研究进一步证实,HOXD3不仅对乳腺癌细胞干性的维持起重要的作用,同时参与乳腺癌细胞多药耐药的产生,针对该分子及其下游通路的靶向治疗,可能从根本上抑制乳腺癌细胞自我更新能力,并恢复其对化疗药物的敏感性,从而提高乳腺癌患者的预后。
HOXD3究竟通过何种分子通路发挥其恶性生物学效应,需要进一步探讨。研究发现,HOXD3表达与整合素β3呈正相关[15]。整合素β3为细胞表面受体整合素家族成员,通常与整合素αν和β亚单位形成二聚体,表达于细胞表面,参与调节细胞间、细胞与细胞外基质间的相互作用[16]。此外,整合素β3在肺癌细胞中过表达能促进肿瘤细胞产生恶性生物学行为[17]。HOXD3是否通过调节整合素β3表达进而发挥作用的假设,有待进一步探讨。
综上所述,本研究证实HOXD3表达对乳腺癌细胞干细胞样特性的影响,及HOXD3表达可促进乳腺癌细胞化疗耐药的产生,为更好地认识乳腺癌干细胞的生物学特性,更好地理解乳腺癌耐药的分子机制,制定逆转化疗耐药的靶向治疗提供潜在靶点。
(2018-02-26收稿)
(2018-06-12修回)

