全身骨显像与肿瘤标志物联合检测对NSCLC骨转移的诊断价值*
肺癌是国内外最常见的恶性肿瘤之一。肺癌是男性因癌症死亡的首要因素,同时也是女性因癌症死亡仅次于乳腺癌的次要因素[1]。据统计,2012年全球新发肺癌180万例,肺癌死亡160万例[2]。有报道[3]指出,2015年中国癌症新发病例约429.2万例,死亡病例约281.4万例,其中肺癌最常见且死亡率最高。非小细胞肺癌(non-small cell lung cancer,NSCLC)占已确诊肺癌的80%以上,且发现时多属于晚期[4]。
国内外肺癌骨转移诊疗指南均认为行全身骨显像(whole body bone scintigraphy,WBS)是骨转移的首选筛查方法。《肺癌骨转移诊疗专家共识(2014年版)》[5]明确指出有肺癌骨转移临床表现、中晚期肺癌或骨转移高危的患者均推荐行WBS进行筛查。人体内肿瘤标志物(tumor maker,TM)的含量对明确恶性肿瘤的诊断、分型、制定治疗方案、评价治疗效果、检测是否复发及判断预后具有很重要的临床价值。TM可在影像学出现异常,甚至在临床症状出现之前发生异常。因此,进行TM含量检测对肿瘤疾病的早期诊断及指导治疗具有重要实用价值。
本研究主要比较全身骨显像、TM及两者联合检测对NSCLC骨转移的诊断效能,为临床早期诊断NSCLC骨转移选择最佳检查方案提供依据。
1 材料与方法
1.1 一般资料
1.1.1 临床资料 收集2014年1月至2016年6月在广西医科大学附属肿瘤医院首次入院经病理或细胞学检查诊断为原发性NSCLC患者185例,所有患者均无心、肺、肝、肾脏及血液系统等其他严重疾病,并且未行化疗等手段治疗。年龄30~83岁,平均年龄56岁。其中NSCLC伴骨转移78例(男性44例,女性34例,年龄30~81岁),NSCLC未发生骨转移107例(男性69例,女性38例,年龄31~83岁)。
1.1.2 仪器设备与材料 单光子发射型计算机断层扫描仪(single photon emission computerized tomogra⁃phy,SPECT)采用美国GE公司的Discovery VH双探头SPECT仪,配置低能高分辨率/通用型准直器。
99mTc-亚甲基二膦酸盐(MDP)的配制:购自江苏省原子医学研究所江原制药厂,钼-锝发生器(99mMo-99mTc)购自北京原子高科有限公司,99mTc-MDP放化纯度不低于95%。
WBS技术参数:能峰140KeV,窗宽20%,采集矩阵256×1024,扫描速度为15~20 cm/min,Zoom1.0。
血清肿瘤标志物检测:采用电化学发光技术,应用全自动生化分析法进行检测,试剂及仪器均为德国罗氏公司产品(仪器型号为Cobase601)。
1.2 方法
1.2.1 肺癌骨转移诊断标准 根据《肺癌骨转移诊疗专家共识(2014年版)》[5],肺癌骨转移的诊断应至少满足以下两个条件之一:1)临床或病理诊断为肺癌,骨病变处经病理活检证实为肺癌转移;2)病理明确诊断为肺癌,并且骨转移影像学表现典型者。本研究中典型骨转移影像学表现包括:1)WBS示多发异常放射性浓聚灶,随访复查病灶不消退或范围扩大、数目增多;2)骨病灶经X线、CT或MRI检查等显示有骨质破坏或病理性骨折。
1.2.2 全身骨显像图像分析 由2名高年资核医学医师行双盲阅片,如意见一致,则以共同意见为准;如意见不同时,则经讨论达成共识。
当WBS显示局部放射性浓聚、稀疏或缺损为异常病灶。按照Krasnow等[6]描述标准将异常病灶分为以下5种:1)骨转移病灶;2)可疑骨转移病灶;3)性质待定病灶;4)可疑骨良性病灶;5)骨良性病灶。本研究中,将上述3种病灶归为骨转移阳性病灶,其余后2种病灶归为骨转移阴性病灶[7]。
1.2.3 骨转移病灶分级 参考Soloway分级标准[8],按照WBS结果将疾病的程度(the extend of disease,EOD)分为4级:EOD 0:未见异常;EOD 1:骨转移病灶1~2个;EOD 2:骨转移病灶3~5个;EOD 3:骨转移病灶>5个。
1.2.4 血清肿瘤标志物预测NSCLC骨转移标准 血清肿瘤标志物癌胚抗原(CEA)、糖类抗原125(CA125)、角蛋白片段19(CYFRA21-1)阳性值界定:CEA>6.5 ng/mL;CA125>35 U/mL;CYFRA21-1>3.3 ng/mL。
1.3 统计学分析
应用SPSS 22.0软件对各项数据进行统计学分析。CEA、CA125、CYFRA21-1水平采用中位数和四分位数描述,组间比较时应用方差分析;采用Spear⁃man相关分析评价WBS分级与CEA、CA125、CY⁃FRA21-1水平的关联性;应用ROC曲线分析单项检查及联合检查预测骨转移的效能。检验水准:α=0.05,P<0.05为差异具有统计学意义。
2 结果
2.1 NSCLC骨转移患者血清肿瘤标志物检测水平关系
NSCLC骨转移组CEA、CA125及CYFRA21-1水平均高于NSCLC无骨转移组,差异有统计学意义(Z=-4.859、-4.659、-2.383,P<0.05)。见表1。
2.2 WBS Soloway分级与血清肿瘤标志物检测水平相关性分析
78例临床确诊NSCLC骨转移患者中,其WBS结果参照Soloway分级标准,E0D 0:8.98%(7/78),E0D 1:50.00%(39/78),E0D 2:21.79%(17/78),E0D 3:19.23%(15/78)。E0D 0、EOD 1、EOD 2和EOD 3各组间CEA、CA125及CYFRA21-1水平均上升趋势(表2)。Spearman相关分析结果显示,WBS分级与CEA、CA125、CYFRA21-1水平存在相关性(rs=0.579、0.274、0.327,均P<0.05)。且各Soloway级别中TM与NSCLC无骨转移组比较,差异有统计学意义。
2.3 WBS联合CEA、CA125和CYFRA21-1检测对NSCLC骨转移评价
WBS诊断NSCLC骨转移的灵敏度和特异性分别为91.03%、85.98%;CEA、CA125、CYFRA21-1诊断NSCLC骨转移的灵敏度分别为48.70%、79.50%、85.90%;CEA、CA125、CYFRA21-1诊断NSCLC骨转移的特异性分别为86.00%、55.10%、42.10%;TM联合诊断NSCLC骨转移的灵敏度和特异性分别为85.90%、51.40%;WBS与TM联合诊断NSCLC骨转移的灵敏度和特异性分别为92.30%、86.00%(表3)。经ROC曲线分析(图1),TM联合检查曲线下面积(area under curve,AUC)为0.748,高于各项肿瘤标志物单项检测;WBS检查AUC值为0.885,高于肿瘤标志物联合检测;WBS与TM联合诊断AUC为0.922,高于肿瘤标志物联合检测和WBS单项检测。

表1 NSCLC骨转移组与NSCLC无骨转移组血清肿瘤标志物水平比较

表2 WBS Soloway分级与血清肿瘤标志物检测水平比较
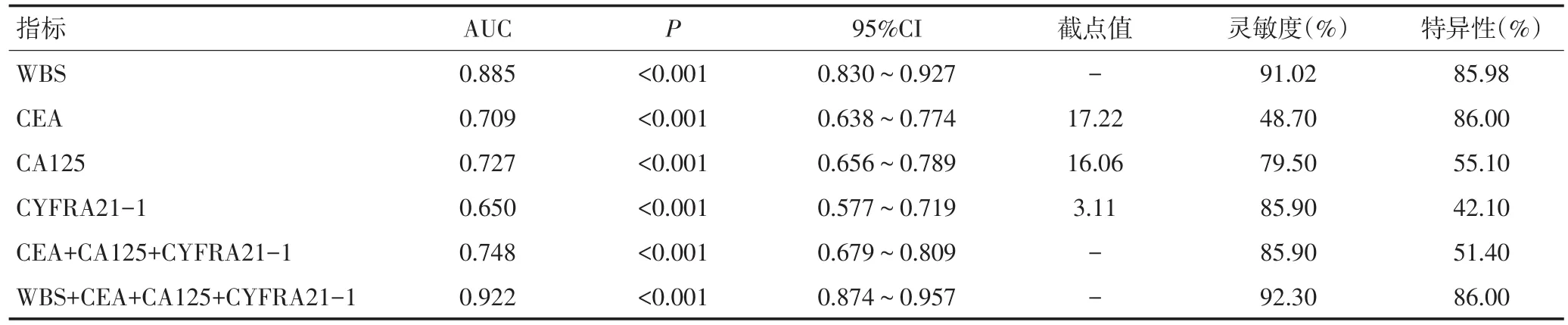
表3 WBS与CEA、CA125和CYFRA21-1单项检测及联合检测对NSCLC骨转移诊断效能
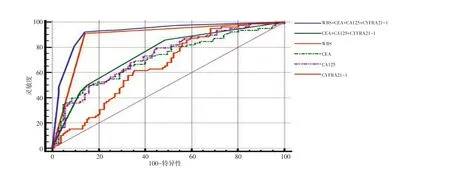
图1 WBS、CEA、CA125、CYFRA21-1和联合检测诊断NSCLC骨转移ROC曲线
3 讨论
NSCLC中肺腺癌发生骨转移较为常见。有报道[9-12]肺腺癌的骨转移率最高,可达22.9%~64.91%。本研究185例NSCLC患者中发生骨转移78例,占42.16%。
3.1 NSCLC骨转移灶WBS结果分析及临床应用价值
WBS是目前公认可早期发现骨转移瘤病灶的最灵敏的检查方法。有研究[13]发现,WBS发现肺癌骨转移的灵敏度可高达95.24%,特异性为93.72%。本研究资料显示,WBS灵敏度为91.02%,特异性为85.98%,低于文献报道,可能是由于未采用SPECT/CT同机融合显像及炎症、骨折等良性病变的影响。因为,99mTc-MDP并不是骨转移瘤的特异性显像剂。当骨骼发生病理性改变如炎症、骨折、退行性变、代谢性骨病、肿瘤等,均可因为局部血流增加、代谢加快及成骨细胞活跃而在WBS图像上呈现“热”区。因此使得WBS对骨转移瘤的诊断的假阳性率升高,特异性降低。有报道[14],WBS诊断骨转移瘤时存在4.05%~8.90%的假阴性率。本研究中假阴性率为8.97%(7/78)与其相近。产生假阴性结果主要有以下原因:1)骨转移病灶为溶骨性改变,WBS对“热”区的检出率高于“冷”区的检出率,而NSCLC骨转移主要以溶骨性病变为主。2)骨转移瘤呈高度浸润,使转移病灶的局部血流受阻或骨髓受累,致使99mTc-MDP不能进入[10]。3)SPECT空间分辨率低。
3.2 血清肿瘤标志物对NSCLC骨转移预测价值
应用于诊断肺癌常用的TM主要有CEA、CA125及CYFRA21-1。CEA主要作为结肠癌和直肠癌的最佳TM,但在胃癌、肺癌及乳腺癌等恶性肿瘤中出现升高现象。国内外报道[15-16]CEA在肺癌诊断中的重要作用,是目前诊断肺腺癌最有价值的TM。Zhang等[17]报道,在肺腺癌中CEA阳性水平主要与骨转移及肝转移相关。本研究证实NSCLC骨转移患者血清中CEA水平明显高于NSCLC无骨转移组;CEA对预测NSCLC骨转移的灵敏度和特异性分别为48.70%、86.00%。提示CEA可以作为NSCLC骨转移的辅助参考标准,当肺癌患者血清CEA浓度越高,患者肺部病情越严重且可能已经发生骨转移。
CA125是一种细胞膜上分子量高达200~1 000 kD的糖蛋白,健康人血液内的含量非常低,但当机体发生恶性病变,破坏细胞间的链接和基底膜后,可被释放进入血液,血清CA125水平将升高。本研究NSCLC骨转移患者血清中CA125水平高于无骨转移组,CA125预测NSCLC骨转移的灵敏度和特异度分别为79.50%、55.10%。与南永刚等[18]报道的CA125预测NSCLC骨转移灵敏度73.4%结果相仿。CA125诊断NSCLC骨转移的灵敏度明显高于CEA,但特异性不如CEA。
CYFRA21-1为细胞角蛋白19片段,主要分布于单层上皮细胞,如肺泡上皮、肠上皮等。有文献表明[19],对肺癌骨转移的价值较高,灵敏度可达91.80%。本研究中,NSCLC骨转移患者血清中CY⁃FRA21-1水平与NSCLC无骨转移组相比较,差异有统计学意义(Z=-2.383,P<0.05),并且CYFRA21-1预测NSCLC骨转移的灵敏度和特异性分别为85.90%、42.10%[20]。
本研究结果可见,血清CEA和CA125的AUC值更接近1.0,分别为0.709和0.727,说明其诊断NSCLC骨转移的价值均较高。CYFRA21-1的AUC值为0.650,诊断NSCLC骨转移价值较CEA、CYFRA21-1稍差。此3种TM中CYFRA21-1的灵敏度最高,血清CEA的特异性最高。说明CEA、CA125及CYFRA21-1水平对NSCLC骨转移的诊断有一定的参考价值。
本研究发现,78例NSCLC骨转移患者CEA、CA125及CYFRA21-1水平均高于无骨转移患者,与相关报道[21]结果相似。Spearman相关分析结果显示,NSCLC骨转移患者WBS分级与CA15-3、CEA及CYFRA21-1水平存在相关性,提示CA125、CEA及CYFRA21-1水平能够在一定程度上预测NSCLC骨转移的趋势;因此对于NSCLC患者,出现CEA、CA125及CYFRA21-1水平升高时应考虑其是否有发生骨转移可能。
3.3 WBS联合TM检测对NSCLC骨转移的评价
至今仍无可以准确预测NSCLC骨转移的手段,TM单项检测诊断效能较低,WBS具有一定假阳性率。本研究结果显示血清CEA、CA125及CYFRA21-1检查联检时灵敏度、特异性为85.90%、51.40%,AUC值为0.748,灵敏度比单项检测明显增高,提示3项TM联合检测比单项TM检测有助于提高对NSCLC骨转移灶诊断效能。WBS与3项TM联合检测时灵敏度、特异性分别为92.30%、86.00%,AUC值为0.922,灵敏度进一步升高。表明4项联合检测可有效地降低WBS假阳性率,明显提高WBS的诊断效能,但其本身并单独作为诊断骨转移的标准[22-23]。4项联合检测可早期诊断NSCLC骨转移并进一步指导临床制定更为合适的治疗方案。
综上所述,全身骨显像对诊断非小细胞肺癌骨转移具有较高的诊断效能,可作为非小细胞肺癌骨转移的筛选诊断方法,并具有重要临床应用价值。WBS联合CEA、CA125、CYFRA21-1检测比单项检测更有助于提高非小细胞肺癌骨转移的检出率,临床实用性强。NSCLC患者SPECT骨转移分级升高,血清CEA、CA125、CYFRA21-1也随之升高,因此,密切关注血清CEA、CA125、CYFRA21-1变化,有助于预测其骨转移发生、发展情况。
(2018-03-22收稿)
(2018-05-25修回)

