39例胃肠神经内分泌肿瘤经内镜黏膜下剥离术的治疗效果评价*
神经内分泌肿瘤(neuroendocrine neoplasms,NE⁃Ns)是由分散在各种器官中的周围神经内分泌系统引起的罕见肿瘤[1]。1808年Merling首次描述发生于胃肠道类似于癌的上皮性肿瘤,结构单一,侵袭性低于胃肠癌,1907年Oberndorfer正式将其命名为“类癌(carcinoid)”并沿用至今。现代研究已明确类癌应归属于NENs。NENs是一类起源于干细胞且具有神经内分泌标记物、能够产生生物活性胺和(或)多肽激素的肿瘤[2],具有高度异质性,其中胃肠神经内分泌肿瘤(gastrointestinal neuroendocrine neoplasms,GINENs)是最常见的类型[3]。以往对于GI-NENs的报道较少,随着内镜检查的广泛使用以及临床医生和病理学对于GI-NENs认识的逐步提高,目前对于GINENs的报道越来越多。现阶段中国对于GI-NENs的登记系统尚不完善,其临床特征仍不清晰,诊治方法存在争议。本研究回顾分析天津医科大学总医院39例经内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗GI-NENs的临床有效性和安全性。
1 材料与方法
1.1 一般资料
选取2009年10月至2017年10月天津医科大学总医院39例经ESD治疗并经病理确诊为GI-NENs患者临床资料。所有患者ESD术前均行超声内镜(endoscopic ultrasonography,EUS)以明确肿瘤位置、大小、形态、边界与回声特点,并行CT检查排除周围淋巴结及远处转移。术前患者均被告知临床获益及风险,本研究获医院伦理委员会批准(批号:200987),所有患者签署知情同意书。
1.2 方法
1.2.1 分级方法 采用2010年世界卫生组织(WHO)神经内分泌肿瘤分级[4](表1)及中国胃肠胰神经内分泌肿瘤专家共识(2016年版)[2]对天津医科大学总医院诊治的39例GI-NENs进行分级。目前对Ki-67应当采用2%还是5%区分G1/G2存在争议,但根据全球通用的指南,共识仍将2%作为G1/G2的分界标准,建议在病理报告中注明Ki-67的标记率,并通过病理免疫组织化学检测突触素(Syn)和嗜铬粒蛋白A(CgA)来确定肿瘤是否具有神经内分泌功能。最后将G1和G2统称为神经内分泌瘤(neuroen⁃docrine tumors,NETs),而 G3定义为神经内分泌癌(neuroendocrine carcinomas,NECs)。
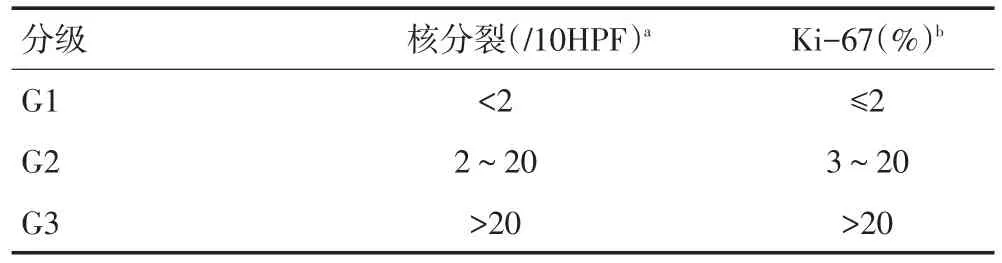
表1 2010年WHO神经内分泌肿瘤分级
1.2.2 治疗方法 39例患者均行ESD治疗,治疗方法:1)Dual刀标记边界,边界位于病灶外0.5 cm,每点间距约0.5 cm;2)局部黏膜下注射甘油果糖+美兰+肾上腺素混合液,充分抬举瘤体;3)Dual刀沿标记切开肿物边缘黏膜层,沿黏膜下层逐层分离,暴露瘤体,完整切除瘤体,肿瘤包膜完整,无残留病变,电止血钳止血并处理创面,创面无穿孔(图1~4)。最后将标本放置10%甲醛液内并标记,标本送检病理活检。
1.2.3 随访 术后1、6、12个月及之后的每年进行门诊随访并复查内镜,观察创面愈合情况及有无病灶残留和复发,随访时间为疾病诊治起至2017年12月,无法与患者或家属取得联系视为失访。随访时已向患者及家属说明随访目的,并征得其同意。
图1 术前超声内镜检查

图2 术前结肠镜表现
图3 术中剥离

图4 术后瘤体
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析。数值变量用表示,离散变量行χ2检验或Fisher确切概率法分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床特征
2.1.1 性别与年龄 本组39例GI-NENs患者,男性19例,女性20例,男女比例0.95:1,年龄22~76岁,平均年龄52岁(表2)。
2.1.2 发病部位、肿瘤大小与临床症状 发病部位:直肠23例(58.97%)、胃12例(30.77%)、十二指肠球部4例(10.26%)。肿瘤大小:直径≤1 cm 31例(79.48%),1.0~1.5 cm 5例(12.82%),≥1.5 cm 3例(7.70%)(表2,3)。临床症状:直肠患者以间断腹胀、腹痛、腹泻、便后滴血、大便性状改变较为常见。胃部患者以烧心、反酸、上腹胀痛不适较为常见,十二指肠患者以消化不良较为常见。39例患者临床表现均为非特异性消化道症状,GINENs均在胃肠镜检查发现。

表2 39例GI-NENs患者的一般资料
2.1.3 内镜检查及治疗方式 39例患者内镜检查多为息肉、隆起肿物。EUS显示35例(89.74%)病变侵及黏膜层或黏膜下层,4例(10.26%)病变侵及固有肌层。39例患者均行ESD治疗。
2.2 病理学特点
39例GI-NENs临床表现均为非特异性消化道症状,肿瘤性质的确诊仍需依赖病理检查。按核分裂象和(或)Ki-67标记率分级(表1),39例GI-NENs中G1 37例(直肠21例、胃12例、十二指肠4例),G2 2例(均为直肠),G3 0例(表3),所有GI-NENs均为NETs,其中4例(10.26%)病变侵及固有肌层,所有病例均无淋巴结及远处转移。Syn、CgA和CD56阳性率分别是97.22%(35/36)、42.22%(17/36)和93.10%(27/29)。
2.3 ESD治疗、随访及预后
39例GI-NENs均行ESD治疗,病变完整切除率100%,术中穿孔1例(侵及胃固有肌层,大小约0.5 cm×0.5 cm),行钛夹封闭切口,术中出血2例(1例侵及胃固有肌层,大小约3.5 cm×3.5 cm;1例侵及直肠黏膜下层,大小约0.5 cm×0.7 cm),术后所有患者均追踪随访。随访6~90个月,本组T1-GNETs T2患者共8例,仅1例g-NETs病变位于胃底,大小约3.5 cm×3.5 cm,EUS显示瘤体根部位于固有肌层(不除外肿瘤较大压迫固有肌层所致),因患者坚决拒绝手术,要求内镜下治疗并签署知情同意书,结合患者病变部位及整体状况,同时考虑普通手术切除后可能会出现吻合口狭窄、胃容积减少、营养吸收差等不良反应从而影响生存质量,故行ESD治疗;术后病理证实为g-NETs(G1),建议患者手术,患者拒绝,要求随访,于术后5个月和34个月在胃内不同部位分别形成2次新的病变,病变部位分别为胃体(大小约1.0 cm×1.0 cm,侵及固有肌浅层)和贲门口胃底侧(大小约1.0 cm×1.5 cm,侵及黏膜下层,局部与固有肌层粘连),原手术部位可见白色瘢痕,患者无症状也无其他部位转移证据,应该与原肿瘤无关;因患者再次坚决拒绝手术,其后均分别再次行ESD切除术,术后病理提示g-NETs(G1),目前仍在密切追踪随访,患者积极配合。39例病例均无淋巴结及远处转移,患者生存率100%。
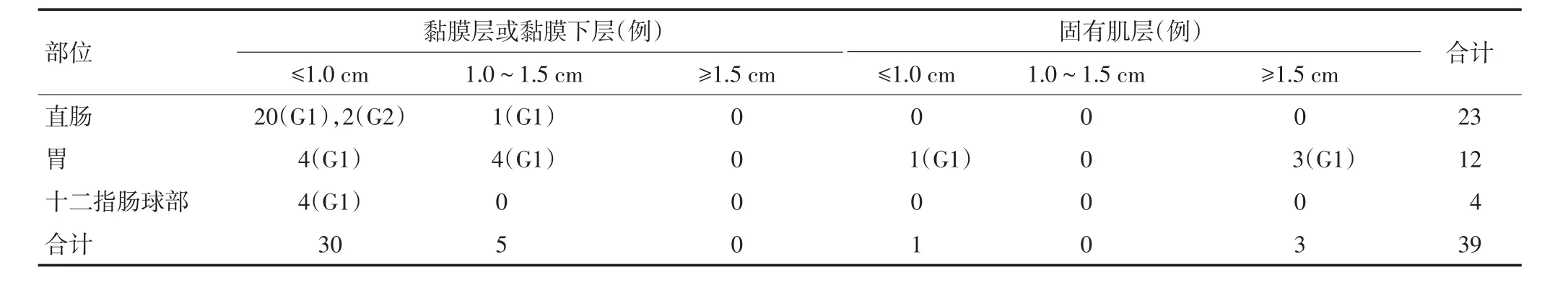
表3 39例GI-NENs患者部位和浸润深度、大小情况
3 讨论
GI-NENs是一组具有某种特质的异质性肿瘤,其中GI-NENs好发部位以直肠最多见[5]。由于GINENs临床表现多样且无特异性,因此需结合内镜及其他影像学检查发现GI-NENs,普通内镜下发现可疑病灶后如条件许可,应结合EUS进一步了解肿瘤的大小、侵及程度及组织学特点,以确定瘤体的性质。CT、MRI等也是诊断GI-NENs的重要方法,可帮助其分期并为后期的治疗选择客观的治疗方式[6]。
目前,病理学仍是确诊GI-NENs的“金标准”[7]。部分胃NENs术前诊断为息肉或者胃间质瘤。本研究中39例(100%)GI-NENs均为NETs,其中G1、G2、G3分别为37例(直肠21例、胃12例、十二指肠4例)、2例(均为直肠)、0例。Syn、CgA和CD56是诊断GI-NENs的主要免疫指标,本研究显示Syn阳性率最高,三者联合检测可有效提高临床诊断率。
对于直径<1 cm的直肠NENs建议局部切除,包括内镜治疗[ESD或胃黏膜切除术(endoscopic mucosal resection,EMR)]及外科手术,当直肠NENs>2 cm时建议外科手术切除[7-8]。而对于1~2 cm的直肠NENs治疗仍有争议。当直肠NENs>1 cm且未侵及肌层时,可选ESD治疗[9]。另有研究表明[10]直肠NENs<1.6 cm且不侵及固有肌层时,采用ESD治疗安全有效,其较常规EMR、改良EMR技术相比,在完整切除率方面有很大的优势,同时不增加总体并发症及复发率,随访期间复发率仅为0.84%。ESD对于直径<1.5 cm且未侵及固有肌层的直肠NENs是值得推荐的治疗方法[11]。本研究中23例直肠NENs均行EUS检查,病变直径均<1.5 cm且未侵及固有肌层。
关于十二指肠神经内分泌肿瘤(duodenal neuro⁃endocrine tumours,d-NETs)治疗,当病变为非壶腹部且直径<1 cm时,目前均建议行ESD,当直径1~2 cm时,采用ESD还是手术切除目前尚有争议,当病变直径>2 cm或超过黏膜下层,或伴有淋巴结及静脉浸润,应采取手术切除[12]。
对于g-NETs治疗,2015版美国国立综合癌症网络(NCCN)共识[13]显示,肿瘤直径≤2 cm时,观察或内镜切除后行肿瘤及周围黏膜活检治疗,肿瘤直径>2 cm时,如有可能则选用内镜切除或手术切除。2016版欧洲神经内分泌肿瘤学会(ENETs)共识表明[6],g-NETs通常分为3型,T1-GNETs多分化良好、Ki-67低(NET G1),应首选内镜切除,对于T2或切缘阳性的T1-GNETs,选择局部切除还是部分胃切除术仍需讨论;2型g-NETs几乎完全见于1型多发神经内分泌肿瘤的患者(multipleendocrineneoplasiatype 1,MEN-1),推荐局部切除;3型g-NETs多属于WHO分类中的NEC G3,治疗方法与胃腺癌相似,采用手术和化疗。
约25%T1-GNETs肉眼不可见,只能在组织学检查中发现,其被称为胃小类癌或黏膜内癌,直径>500 μm,常多发,惰性,局限于黏膜层[14]。因此对于早期复发的一些病变,不能排除初次诊断时其已存在而内镜漏诊未切除治疗[15]。目前对这种类型病灶在后期随访过程如何鉴别是原发还是复发尚未有明确鉴别方法,高分辨率放大内镜和窄带成像技术有助于微小类癌的发现和诊断[16],因此对于可疑病灶应做此检查,以增加微小类癌的检出率。对于病灶≥6个的T1-GNETs或频繁复发的T1-GNETs应采取胃窦切除术,但目前对于“频繁复发”定义并未有明确规定[17],而由于T1-GNETs一般小而多发,局限于黏膜层或黏膜下层,因此T1-GNETs<1 cm时可监测或内镜下切除。EMR曾是T1-GNETs推荐的内镜治疗方法,但约75%T1-GNETs侵及黏膜下层,EMR无法完全切除T1-GNETs,因此ESD目前已不是常推荐的技术[18]。另有报道[19]4例T1-GNETs<1 cm患者合并毛细血管浸润(2例浸润淋巴结、2例浸润静脉),当T1-GNETs<1 cm时应谨慎选择仅内镜监测,且部分T1-GNETs即使病变直径<1 cm也有转移的可能,同时由于内镜监测费用高,长期随访持续时间尚不清楚,并且部分肿瘤患者可能会因仅进行内镜随访而焦虑[15],因此,当T1-GNETs<1 cm时应行ESD治疗。同时T1-GNETs≤1 cm时,ESD较EMR手术时间更短,完整切除率更高,且手术并发症和风险相当,因此建议ESD治疗[20]。对于1型或2型g-NETs直径>2 cm、G2~G3分级、侵及固有肌层、脉管浸润应额外追加行外科手术治疗。基于这种迹象,本组中应额外手术干预为4例,但所有患者均拒绝进行额外手术,理由是身体状况、年龄、费用或其他原因,均积极要求随访,在随访期间仅1例胃内不同部位出现两次新的病变,考虑与原肿瘤无关,所有病例均未发生远端转移。Li等[21]同样支持此观点,而且有研究显示[19]当T1-GNETs>2 cm时分别采用ESD及外科手术治疗,疗效无差异,随访期间并未发生病变进展或转移,对于局限于黏膜下层3型g-NETs G1/G2(Ki-67<5%)病变<2 cm时,可考虑ESD治疗[22]。
目前对于T1-GNETs手术方式尚存争议,由于T1-GNETs可能不依赖胃泌素而自主生长,胃窦切除术可能不会有效阻止病变复发和(或)转移,因此胃次全切除术或全胃切除术可能是更好的手术方式,胃次全切除术可以充分去除G细胞,而当病变位于胃底时全胃切除术更为适宜[23]。但有研究显示[24]手术对于局限于胃内的T1-GNETs是一种过度治疗,且手术治疗更具有侵袭性,并伴有更高并发症的风险,因此对于侵及或起源于固有肌层而不伴有淋巴结及远处转移的T1-GNETs,初次治疗时应尽量行ESD治疗,在剥离过程中应逐层剥离,直至充分暴露瘤体全部,术后包膜完整;若伴穿孔,可行荷包缝合术而未行紧急外科手术治疗;若伴出血,则氩离子束凝固(argon plasm coagulation,APC)电凝止血,术后送检病理判断切缘有无残留及脉管浸润,若有则建议追加外科手术治疗;若患者拒绝外科手术,应加强内镜随访以便于及时发现有无病变复发和(或)转移,Li等[21]结论与此一致。本研究所有经ESD治疗病例术后送检病理均显示切缘无脉管浸润及肿瘤残留,经再次行病理复检结果仍显示阴性。
本研究39例GI-NENs均行ESD治疗,病变完整切除率100%,术中穿孔1例,行钛夹封闭切口,术中出血2例,给予APC电凝成功止血,无感染等并发症,术中出血和穿孔可能与病变深度、大小、术者操作经验等相关,所有病例均无周围淋巴结及远处转移,生存率100%。
综上所述,GI-NENs临床表现多样且无特异性,可发生于消化道的各个部位,内镜为其主要的诊断手段,病理检查是目前诊断GI-NENs的“金标准”。对于无淋巴结及远处转移的GI-NENs,病变局限于黏膜下层且直径≤1.0 cm是ESD绝对适应证;对于未侵及固有肌层且直径1.0~1.5 cm的直肠NENs或T1-GNETs T2患者,如有可能应优先考虑ESD治疗,以保留胃肠容积及功能,并积极追踪随访。
(2018-01-15收稿)
(2018-06-11修回)

