基于生命/影像组学和人工智能的精确放射治疗:思考与展望*
生命组学、液态活检、影像组学、大数据及人工智能技术、虚拟现实技术在生命科学的“落地生根”,冲击着整个医学届,正酝酿着一次新的颠覆性突破。基于物理工程技术的精准放疗,包括精确计算、精确计划及精确投照,精准度可以达到毫米级。然而,生物和影像学的进步正在把放疗带向一个新的“拐点”,即生物精准放疗,包括放疗指征的精准、精准的生物靶区、生物剂量的精准、生物评价及生物修饰的精准等。本文拟从科学背景、基本概念、现状分析及未来展望等方面探讨人工智能与放射治疗生物精准这一热点问题。
1 科学背景分析
1.1 生命组学技术日臻成熟
生命组学(omics)主要包括基因组学(genomics)、蛋白组学(proteinomics)、代谢组学(metabolomics)、转录组学(transcriptomics)、脂类组学(lipidomics)、免疫组学(immunomics)、糖组学(glycomics)和RNA组学(rnomics)学等[1]。这些组学旨在从整体上洞悉生命现象的本质和变化特征,获得对疾病过程更真实的认识。经过近三十余年的发展,组学技术已不再是“养在深闺人未识”,高通量组学技术如基因测序技术可以在短时间内,以低廉的代价获取个体基因组全部的信息,这使得组学步入临床,走近寻常百姓。因此,组学技术的成熟正在撬动着生命医学发生一场前所未有的深刻变革[2-3]。
1.2 液体活检开启了肿瘤监控的新纪元
液体活检(liquid biopsy)与传统的组织活检相比有着迅速、便捷、损伤性小等众多优点,用于监测肿瘤对治疗的反应,预测肿瘤复发,早期诊断,以及体内肿瘤原发部位的判断[4-5]。在人体内,不断有DNA片段流入到血循环中,肿瘤排出的DNA片段也夹杂在其中。下一代测序技术(next-generation sequenc⁃ing,NGS)使液体活检分析游离肿瘤DNA成为可能,因为它能够区分肿瘤DNA序列与正常DNA序列[6-7]。而且,数字PCR(digital PCR,dPCR)能够让研究人员量化检测一段特定的肿瘤DNA序列,尤其是在微量和稀有DNA检测上有明显优势。此外,从血液中收集到活的肿瘤细胞(circulating tumor cells,CTC),并对其进行DNA和RNA测序,以发现可能导致癌症的突变。随着细胞分离技术的进步,人们已经能够从患者血液中收集到足够多的CTC,研究人员通过体外培养或者将其移植到小鼠体内等方式进一步研究[8-9]。
外泌体是第三种液体活检途径,其是活细胞分泌的微小囊泡,包含细胞的DNA、RNA和蛋白。目前,人们对外泌体的研究已经有很大进展,美国公司Exosome Diagnostics推出的一款基于肿瘤外泌体中RNA检测的血检ExoDx Lung(ALK),已获得美国FDA的批准。外泌体不但可以从血液中收集,而且可从其他体液(如尿液)中获取,相比从血液中提取更加容易,且更加便捷[10]。
1.3 影像组学及“数字分身”的兴起
进入21世纪以来,影像技术一直领跑生物医学,每一次进步都会推动医学的发展,如CT、MRI、超声、核医学等,尤其是方兴未艾的分子影像,更是指引医学走向精准时代[11]。得益于组学技术的发展,放射影像组学正在迅猛发展,使得影像不仅是结构的描绘,更是对应于各种组学改变,从整体上看到生命现象的本质,这种描述是量化的,同时也是动态的;从影像上我们不仅观察结构的变化,同时看到分子水平的改变。最终,通过影像组学技术,人类可以通过无创的手段实时观察分析活体内发生的一切生命过程。
“数字分身”(digital twins)是指以数字化方式拷贝一个物理对象,模拟对象在现实环境中的行为,实现整个过程的虚拟化和数字化,从而解决过去的问题或精准预测未来:利用数字化使得现实和虚拟世界无缝连接,创造一个产品/流程/设备的数字孪生模型,模拟/仿真/分析/虚拟调试现实世界中发生的问题或未知的领域;将产品创新以及制造的效率和有效性提升至全新的高度;准确的将现实世界以数字化的方式表达出来。数字分身和影像组学的联手,将助推精准放疗迈上新的发展轨道。
1.4 人工智能引领新的技术革命
人工智能(artificial intelligence,AI)是研究、开发用于模拟、延伸和扩展人的智能的理论、方法、技术及应用系统的一门新的技术科学。人工智能是计算机科学的一个分支,反映智能的实质,并生产出一种新的以人类智能相似的方式做出反应的智能机器,该领域的研究包括机器人、语言识别、图像识别、自然语言处理和专家系统等。人工智能从诞生以来,理论和技术日益成熟,应用领域也不断扩大,可以设想,未来人工智能带来的科技产品将会是人类智慧的“容器”。
人工智能将会带来以下医疗突破:1)疾病风险预测:识别风险,判别是否处于风险中,识别可能降低风险的措施[12]。2)全周期诊疗管理:为每个患者设计个性化的诊疗计划,缩小在治疗中的差距[13]。3)优化路径设计:优化医疗流程-从基本的治疗过程到医疗保险,通过缜密的数据分析,在提高护理成果和质量的同时,降低成本。4)医疗决策支持:基于最新的测试或监控数据,帮助医生和患者选择合适的药物剂量,协助放射医师识别肿瘤等疾病,分析医学文献以及建议,制定效果最好的手术方案[14]。在这几个医疗领域,应用人工智能/机器学习策略,对于创建大规模、高性价比、个性化、以患者为中心的医疗临床系统是必不可少的。
1.5 虚拟现实、增强现实及混合现实
虚拟现实(virtual reality,VR)是利用电脑技术模拟出一个立体、高度模拟的3D空间,当使用者穿戴VR显示装置时,会产生类似处于现实中的错觉。在这空间中,操作者可以通过控制器或键盘在虚拟的环境下穿梭或互动。增强现实(augmented reality,AR)即通过电脑技术,将虚拟的信息应用到真实世界,真实的环境和虚拟的物体实时地叠加到同一个画面或空间。混合现实(mixed reality,MR)为通过电脑技术,将现实世界与虚拟世界合并在一起,从而建立出一个新的环境,以及符合一般视觉上所认知的虚拟影像,现实世界中的物件能够与虚拟世界中的物件共同存在并且即时地产生互动。通过以上三种方式,人类对肿瘤和脏器解剖将产生更为直观的认识,便于对肿瘤靶区的准确识别,以及对正常组织的精准区分。
1.6 百年放疗期待突破“困局”
自从120年前伦琴发现X线,放疗走过了一段不平凡的发展历程,前50年基本上处于“跑龙套”的阶段,存在疗效差、损伤大的缺点;后50年由于技术的进步,疗效有所提高,但也只是“配角”;近20年,放疗才真正“破茧化蝶”成为“主角”,由于技术精准度提高,损伤减轻,疗效大幅提高[15-16]。但这些还远远不够,原因在于:放疗的本质是“分子水平的操作”,即打断DNA双链,引起一系列分子改变,最终致细胞凋亡;而目前对照射“靶区”依然没有完整的认识,主要是解剖水平的成像,极少的分子水平成像,导致放疗远未达到“分子水平操作”,尚处于外科医生式的“解剖水平”,这是放疗面临的最大“困局”。
2 生命/影像组学和VR/AR技术引导的精准放疗(智能组学放疗,AI-omics radiotherapy)的概念与特征
智能组学放疗是生命/影像组学及人工智能技术应用于放疗的必然产物,真正意义上解决了放疗面临的困局,使得放疗彻底在分子水平上操作,实现放疗的最高境界。
具体来说,组学放疗主要包含以下方面:1)放疗决策上,通过组学技术可以获得肿瘤和个体的全部遗传信息及生物学特征,判断有否放疗指征,需采取的放疗方式及剂量分配,以及可能的效果等[17]。2)放疗靶区的确定方面,通过影像组学技术可以获得病变部位的全部遗传学及微环境信息,在此基础上,依据各种参数通过人工智能技术自动生成全息靶区,将肿瘤和正常组织的各种生物学信息通过三维的方式呈现出来[18-20];然后,根据三维全息靶区,确定需要的射线种类、能量、剂量。3)放疗反应评价和随访方面,通过实时动态观察整个放疗过程中各种组学信息的变化,反馈到放疗质控,以及时优化放疗计划[21-24]。在放疗结束后的随访上,液态活检组学技术可以随时监控肿瘤的情况。
全息靶区(holo-targets)是智能组学放疗的核心步骤,是在影像组学的基础上,结合放疗的专业要求而产生的,不同于传统的结构性靶区,它是根据病变的组学信息及生物学特征数据,通过计算机自动生成的。具体步聚:1)需要根据影像组学的结果,获得病变和正常组织的所有基因组、蛋白质及代谢相关信息,并在影像上得以呈现。2)根据放疗靶区设计上的具体要求,定义各种相应的参数,电脑自动生成需要的各种靶区。3)通过VR/AR技术,获得三维的靶区影像,在混合现实技术的引导下,医师可以准确地区分肿瘤和正常组织[25]。
与现有的放疗相比,智能组学放疗具有如下特征和优势:1)精准决策,基于组学技术的放疗指征选择和方案制定,可以获得全面的正常和病变组织的生物学信息,避免了“盲人摸象”和以偏概全的失误。2)全息靶区使得人们可以从分子水平上看到照射对象的全貌,明确病变的确切部位,避免了人工勾画靶区带来的不确定性,以及勾画者之间的差异,这种由生物信息数据自动生成的靶区,具有极高的精准性,更利于放疗QA和QC。3)对疗效的评价不同于传统的放疗,不仅观察体积的变化,更重要的是通过组学信息的检测,可以真正判断肿瘤控制情况,更为精准和敏感。4)组学的评价是全程、动态的,甚至终生的,对于放疗引起的第二原发肿瘤可以及时发现,及早给以干预(图1)。
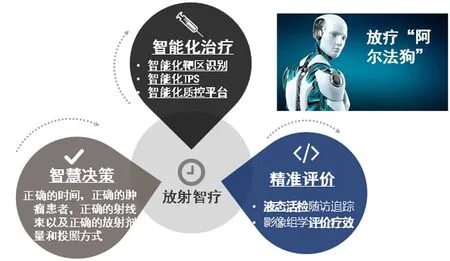
图1 放射“智疗”的理念和模式
3 现状
Torres-Roca等[26]开发了一个基于基因的放射敏感度指数(RSI),首先要对10个特殊基因(AR,c-Jun,STAT1,PKC-beta,RelA,cABL,SUMO1,PAK2,HDAC1和IRF1)的表达水平进行检测,然后通过数学公式得到一个值,代表肿瘤对放疗的敏感度。通过在直肠癌、食管癌、乳腺癌、头颈癌、胶质母细胞瘤、胰腺癌和转移性结直肠癌患者体内验证,RSI高的患者放疗效果明显较好。因此,他们用此结果再推导出可以量化“放射治疗效果”的模型。利用RSI值、线性二次数学模型以及标准放疗剂量和样本中每个患者接受放疗的时间和剂量推导出了以基因组为基础的放疗剂量调整模型(a genome-based model for ad⁃justing radiotherapy dose,GARD),其可以预测放射疗法的疗效,并指导放射剂量以匹配个体的肿瘤放射敏感性,GARD值越高,放疗的疗效则越好[27]。他们从TCC样本库(total cancer care protocol)中调用了来自20个肿瘤位点的8 271个临床样本(TCC样本库从2006年开始收录在各个机构接受治疗的每例癌症患者的肿瘤样本和临床治疗的各种数据),利用这些数据计算出每例患者的GARD值,发现其分布在1.66~172.4,此范围非常广泛。8 271个样本中,接受的放疗剂量分别为45 Gy(2 517例)、60 Gy(4 877例)和70 Gy及以上(877例)。根据这个剂量由低至高的例数和比例,研究人员将GARD值也分为了3个相应的“档次”,低档为0~30.40;中档为30.41~89.40;高档为89.41~100(GARD值>100为9例,归类为高档)。
研究人员利用5个来自不同机构的临床肿瘤队列Erasmus乳腺癌队列,263例;Karolinska乳腺癌队列,77例;莫菲特肺癌队列,60例;莫菲特胰腺癌队列,40例和癌症基因图谱(the cancer genome atlas,TGCA)(胶质母细胞瘤队列,98例)的数据对GARD模型进行了验证,通过多变量Cox模型的分析,其确定GARD值与临床结果独立相关,GARD模型可用于对放疗效果的预测。他们还对5组数据中的一组,来自Erasmus乳腺癌队列的263例乳腺癌患者进行放疗后的追踪,统计5年无转移生存期的情况。在这部分患者中,GARD值≥38.9属于高GARD值人群,<38.9属于低GARD值人群。追踪结果说明,高GARD值人群的放疗效果更好,同样的时间内,患者的生存率相对较高。即使是同一种癌症,不同患者的GARD值有较大差异,提示不同患者对放疗的敏感度存在差异,表明过去的放射疗法有较大的改进空间和个性化空间。GARD模型首次将基因检测与放疗剂量联系在一起,为研究人员和医生提供了一种安全可行的方法将放射肿瘤学“变得精准”[28]。
4 智能组学放疗的发展策略和研究方向
智能组学放疗是一种比较理想的放疗模式,但要真正投入临床应用,尚有很长的路要走,先要解决一个个“拦路虎”。
首先是影像组学的发展。因放疗是基于影像的学科,将基因组、蛋白质组及代谢组的信息整合进成像系统,实现可视化,并能通过量化信息对病变进行定性诊断和识别,最终达到全组学、全人体的生物影像,是未来一段时间内必须解决的问题。
生物大数据的采集、贮存和挖掘。虽然近年来大数据技术有所进步,但是对于生物数据这种碎片化、复杂而又厚重的数据,处理起来并不容易,真正挖掘出正确的信息非常困难。尤其是对于不同层次的组学信息,从基因至转录组、蛋白质,再到代谢组等,常表现出不一致性,影响因素多,真假难辨。
全息靶区的定义和呈现是组学放疗的关键,尤其是VR/AR/MR技术的融合,但要根据放疗的基本原则,制定合适的参数,定义符合治疗目标的靶区,尚有大量的工作要做,不同病变性质和不同个体患者往往有很大的异质性,必须突破这一难点,才能得到预期的靶区。
液态活检技术的成熟至关重要,在治疗过程及随访中,需反复获取组学信息,依据肿瘤组织不太现实,简单、可靠的办法只能是液态活检,因此该技术的发展及临床普及是实现组学放疗的前提之一。
技术流程的标准建立和质控手段,尤其是人工智能和MR技术的应用,组学放疗涉及的均为目前高端的前沿技术,其执行标准和质控手段是走向临床前必须解决的。
5 前景展望
回顾放疗百余年的发展历程,每一次进步因成功转化当时最先进的技术而取得。现代放疗正是吸收了计算机技术、成像技术及IT技术,才实现成为肿瘤治疗“主角”的华丽飞跃。当下的生命组学技术、多模特影像、VR/AR/MR技术、生物大数据技术及人工智能,正在逐渐渗透放疗技术发展,从而促进“智能组学放疗”这一新模式的诞生。相信不久的将来,这场放疗技术革命终要落地。
(2018-04-11收稿)
(2018-05-31修回)

