纳洛酮联合芬太尼对胃癌术后患者胃肠功能的影响
李砚文,孔树佳,肖 云,王永顺,殷 婕
(昆明医科大学第三附属医院/云南省肿瘤医院:1.重症医学科;2.药剂科,云南昆明 650000)
胃癌在我国各种恶性肿瘤中的发病率和病死率均居于首位[1]。胃癌发病有明显的地域性差别,在我国的西北与东部沿海地区胃癌发病率比南方地区高,同时遗传也是胃癌发病的重要因素。好发于50岁以上人群,男性发病率为女性的2倍[2]。早期胃癌多数患者无明显症状,少数患者有恶心、呕吐或是类似溃疡病的上消化道症状,随着病程的进展,患者会出现体质量减轻及疼痛加剧等临床症状。胃癌患者目前主要通过手术切除肿瘤根治,但患者术后的疼痛及并发症给患者的康复及日常生活带来巨大的负面影响。据相关文献统计,胃癌患者术后疼痛发生率高达90%,造成患者机体免疫力下降,伤口感染控制困难[3]。此外,术后阿片类镇痛药物对患者术后的镇痛效果不佳,且患者术后胃肠功能恢复时间长等因素,给患者术后恢复及日常生活带来极大痛苦。研究指出,胃肠功能的恢复是胃癌患者术后恢复的“限速环节”,也是影响术后镇痛的重要因素之一[4]。因此,如何减轻患者术后疼痛、降低并发症发生率,促进患者胃肠功能恢复对胃癌患者的早日康复具有积极意义。本研究采用纳洛酮联合芬太尼对胃癌术后患者进行镇痛,取得良好的镇痛效果及术后康复效果,现报道如下。
1 资料与方法
1.1一般资料选择2012年6月至2016年6月本院收治的胃癌行根治性肿瘤切除术患者86例作为观察对象,采用随机数表法均分为观察组和对照组,每组43例。观察组中男28例、女15例,年龄23~68岁、平均(48.75±11.62)岁;对照组中男29例、女14例,年龄22~65岁、平均(49.34±12.17)岁。两组患者均符合胃癌的相关诊断标准,并通过组织病理学检查确诊为胃癌[5-6]。入组标准:(1)无严重心、肝、肾系统疾病,既往无腹部手术史;(2)年龄>22岁;(3)麻醉分级为Ⅰ~Ⅱ级;(4)自愿参与本研究,并配合治疗。排除标准:(1)肿瘤直径≥10 cm者;(2)存在精神疾病,无法正常沟通者;(3)肿瘤淋巴结转移融合,包绕重要血管者。本研究在得到本院伦理委员会的核准后进行。两组患者的年龄、性别等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2方法两组患者均由本院重症医学科同一组医师及护理人员进行根治性肿瘤切除术治疗和护理,术后禁食,通过补充体液来减轻患者胃肠压力。观察组应用硬膜外注入小剂量纳洛酮联合芬太尼自控镇痛。实施方法如下:术毕关闭腹腔时,采用纳洛酮2.0 μg/kg经生理盐水稀释至100 mL后联合芬太尼静脉自控镇痛。镇痛泵参数设置:背景剂量2.0 mL/h,自控给液间隔时间15 min,单次追加剂量1 mL。镇痛泵为江苏人先医疗科技有限公司生产,标注容量:100 mL,持续给药量0.5~10.0 mL/h,有效输注量≥90%,自控间隔时间2~90 min。对照组术后采用芬太尼进行静脉自控镇痛,使用与观察组纳洛酮等量的生理盐水+芬太尼进行镇痛。
1.3观察指标于术后4、8、12、24 h时间点对两组患者使用视觉模拟评分(VAS)法进行疼痛评分,记录两组患者术后的肠鸣音恢复时间、排便时间、肛门排气时间、胃动力恢复时间及术后1周镇痛泵药物消耗量和芬太尼用量;观察统计两组患者恶心、呕吐、皮肤瘙痒及尿潴留并发症的发生情况。VAS评分参照文献[7]进行,疼痛程度分为5段:0分为无痛;1~3分为轻微疼痛;4~6分为经常轻微疼痛;7~8分为在可承受范围内的明显疼痛;9~10分为无法忍受的剧烈疼痛。
1.4统计学处理本研究采用SPSS19.0进行统计学数据分析,VAS评分、胃肠功能恢复时间及麻醉药物用量等计量资料的组间、组内比较采用t检验;计数资料以率或例数表示,组间比较采用χ2检验;以P<0.05表示差异有统计学意义。
2 结 果
2.1两组患者术后各时间点的VAS评分比较术后两组患者均出现轻微疼痛,术后4 h观察组患者的疼痛评分明显低于对照组(P<0.05);术后8 h与术后12 h两组患者的VAS评分均较术后4 h的评分明显上升,但观察组上升幅度小于对照组,差异均有统计学意义(P<0.05);术后24 h观察组的VAS评分与术后12 h的评分比较不再明显上升(P>0.05),术后24 h对照组的VAS评分仍高于观察组(P<0.05)。见表1。

表1 两组患者术后各时间点的VAS评分比较
注:与组内术后4 h比较,*P<0.05

表2 两组患者术后1周的麻醉药物用量及胃肠功能比较
2.2两组患者的麻醉药物用量及胃肠功能比较观察组患者术后肠鸣音恢复时间、排便时间、肛门排气时间、胃动力恢复时间及术后1周镇痛泵药物消耗量和芬太尼用量均明显低于对照组,组间比较差异有统计学意义(P<0.05)。见表2。
2.3两组患者的术后并发症比较观察组术后并发症总发生率为9.30%,明显低于对照组的30.23%,组间比较差异有统计学意义(χ2=5.938,P=0.015<0.05)。见表3。
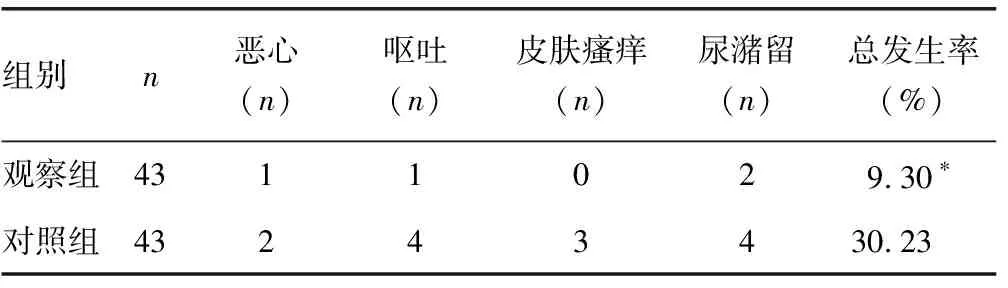
表3 两组患者术后并发症比较
注:与对照组相比,*P<0.05
3 讨 论
胃癌是一种临床上常见的消化系统恶性肿瘤,源自胃黏膜上皮的恶性肿瘤,其发病率和病死率均居于全身恶性肿瘤的首位,严重威胁人类健康[8]。胃癌的治疗方法多种,包括手术治疗、化疗、放疗、热疗、免疫治疗及中药治疗等,目前临床上采用的主要方式是手术治疗,该病手术治疗已比较成熟,成功率高,但胃癌的病死率仍在逐年上升,出现这种现象的主要原因是大部分患者顾虑术后疼痛及居高不下的术后并发症,从而不愿选择手术治疗,进行保守治疗。术后疼痛对胃癌患者的危害极大,也是引起各种并发症的主要原因。此外,胃癌术后由于麻醉、术中胃肠牵拉、电解质失衡、渗液及手术创伤等因素,会导致患者胃肠功能不同程度地受到抑制,引起胃肠动力不足甚至消失,在临床上主要表现为恶心呕吐、腹胀痛等。虽然临床上鼓励患者早期下床活动、使用药物促进胃肠动力恢复、肛门排气及灌肠等辅助治疗,但疗效甚微[9]。当前,胃癌患者术后镇痛主要采用芬太尼静脉自控镇痛,但临床研究表明,芬太尼静脉自控镇痛后患者的疼痛程度仍较为严重,镇痛效果不理想,并发症多且发生率高,严重影响患者的术后恢复和生活质量。因此,胃癌患者术后有效的镇痛方式对减轻患者痛苦、减少并发症发生及促进患者康复具有重要意义。
临床上胃癌术后常规使用芬太尼静脉镇痛泵镇痛存在镇痛效果不佳,且易引起恶心呕吐、皮肤瘙痒及尿潴留等并发症,近年来其在临床上的应用已受到一定的限制。硬膜外注入镇痛药物是经济、有效、临床常用的镇痛方法[10]。纳洛酮为吗啡受体拮抗剂,是一种有效的阿片类受体拮抗剂,通过竞争阿片受体(依次为μ,κ,δ)而起作用,注射给药起效很快。其主要用于阿片类药物过量中毒或用于阿片药成瘾的诊断,还用于吗啡类复合麻醉药术后解除呼吸抑制及催醒。近来有研究表明,硬膜外小剂量纳洛酮的应用可有效地提高阿片类药物的镇痛效果,但未详细阐述其作用机制[11]。此外,还有研究指出,阿片类药物与中枢特异性受体相互作用,受体存在镇痛和抗镇痛双向模式,而纳洛酮可以使得受体向镇痛方向转化,使阿片类药物受体密度上调,亲和力增强,从而提升阿片类药物的镇痛效果。另外,国外临床研究证实,纳洛酮在辅助阿片类药物镇痛的基础上,还可促进胃癌患者术后胃肠功能的恢复,在胃癌术后使用小剂量的纳洛酮可有效缩短胃动力恢复时间、肛门排气时间等,可在最短时间内促进胃癌患者胃肠功能恢复,改善患者术后生活质量、促进患者早日康复[12]。本研究在上述理论的基础上,结合本院临床实际工作,于2012年6月至2016年6月对本院收治的胃癌行根治性肿瘤切除术患者43例进行小剂量纳洛酮联合芬太尼术后镇痛,结果显示,术后两组患者均出现轻微疼痛,术后4 h观察组患者的疼痛评分明显低于对照组(P<0.05);术后8 h与术后12 h两组患者的VAS评分均较术后4 h明显上升,但观察组上升幅度小于对照组,差异均有统计学意义(P<0.05);术后24 h观察组的VAS评分与术后12 h比较不再明显上升(P>0.05),术后24 h对照组的VAS评分仍高于观察组(P<0.05)。这表明,小剂量纳洛酮联合芬太尼术后镇痛效果显著,纳洛酮中枢特异性受体相互作用,有效地提高阿片类药物的镇痛效果。本研究还观察到,观察组术后肠鸣音恢复时间、排便时间、肛门排气时间、胃动力恢复时间及术后1周镇痛泵药物消耗量和芬太尼用量均明显低于对照组,观察组术后并发症总发生率为9.30%,明显低于对照组的30.23%,上述差异均有统计学意义(P<0.05)。这表明,小剂量纳洛酮联合芬太尼术后镇痛可显著降低芬太尼用量,从而减少阿片类药物的不良反应,且镇痛效果良好,有利于促进患者胃肠功能的恢复。另外,此种胃癌术后镇痛方法经济、方便、易于操作,在临床工作中具有借鉴意义和推广价值。
综上所述,小剂量纳洛酮联合芬太尼在胃癌患者术后镇痛效果显著,可减少镇痛药物用量,减轻阿片类药物的不良反应,对患者术后胃肠功能的恢复具有积极意义。

