灰树花多糖的分离纯化及其体外抗肿瘤活性
陈沛,刘会平,孙娜新,刘子天,李委红,刘旭辉,刘少娟
(天津科技大学食品工程与生物技术学院,天津 300457)
灰树花(Grifola frondosa),学名为“贝叶多孔菌”,俗称“舞菇”[1],是一种珍贵的食、药兼用真菌,夏、秋间常野生于栗树周围。灰树花属于担子菌亚门、多孔菌科、树花菌属,也是世界上最主要的食用菌之一[2]。灰树花不仅口感鲜美,含有丰富的蛋白质、碳水化合物、维生素、多种微量元素,更具免疫活性和抗癌作用[3,4]。据报道,现已从灰树花的子实体和液体培养的菌丝体中分离出多种有效的抗肿瘤多糖[5]。目前对灰树花多糖的提取方法多为高温提取(80 ℃以上),以保证理想的提取率。但是提取工艺在优化多糖提取条件的同时,应综合考虑多糖提取率和多糖活性两个方面[6]。而多糖除来源外,提取温度、提取时间和提取溶剂对提取多糖的理化性质影响非常大[7,8],这表明不同提取条件下提取的多糖具有不同的生物活性。高温还可能造成大分子活性物质高级结构发生不可逆的改变,从而影响其生物活性[9]。已有研究表明较低温提取香菇多糖在增强巨噬细胞吞噬能力、刺激T淋巴细胞和B淋巴细胞增殖作用方面优于高温[6]。灰树花多糖在其主链结构、单糖组成、分子量、支化度、溶解性、聚合物电荷和构象上是多样化的,这都可能影响多糖的活性。研究表明,来自赤芝的高分子量多糖(1086 ku)和(1→3)-β-D-葡聚糖(>788 ku)显示出比其它较低分子量组分更好的抗肿瘤活性[10,11]。而已有研究表明,长期热处理降低了灰树花多糖β-D-葡聚糖的分子量,高分子量的β-D-葡聚糖(800 ku)显示出比较低分子量的β-D-葡聚糖具有更强的免疫调节和抗肿瘤活性[7,8]。刘安军[12]从黄芪中提取出新型冷水可溶性多糖,该多糖对肿瘤生长有明显的抑制作用且能有效保护免疫器官,促进巨噬细胞吞噬功能,提高荷瘤小鼠外周血淋巴细胞亚群百分比。然而至今灰树花多糖的提取主要采用传统的热水浸提法,也有研究发现以灰树花菌丝体为原料,在不同培养基上浸提培养的五组多糖,4 ℃提取的多糖比100 ℃提取的多糖抗氧化活性更优[13]。本文旨在研究低温(4 ℃)条件下,灰树花多糖的分离纯化、结构表征及其抗肿瘤活性,为探索灰树花的综合利用提供科学依据。
1 材料与方法
1.1 材料与试剂
灰树花子实体购自天津滨海新区超市;人肝癌HepG2细胞购自北京协和医院细胞库;人肝HL-7702细胞中国科学院上海细胞库;无水乙醇、MTT、戊二醛等试剂均为国产分析纯;线粒体膜电位检测(JC-1)试剂盒Solarbio。
1.2 仪器与设备
紫外可见分光光度计,日本岛津;二氧化碳培养箱、真空冷干燥机、冷冻离心机、离子色谱仪,美国Thermo;傅立叶变换红外光谱仪,德国布鲁克仪器公司;高效液相色谱仪,日本岛津;扫描电镜:日本日立;ECLIPSE TS100倒置荧光显微镜,日本Nikon。
1.3 灰树花多糖的提取和纯化
灰树花经过冷冻干燥机干燥后,粉碎,过80目筛子,称重后置烧杯中,加20倍(m/V)超纯水浸泡,密封后置于4 ℃浸提,12 h后浸提液6500 r/min离心10 min,重复离心两次收集上清;将上清经过反复冻融至原体积的 1/3,加无水乙醇置终浓度为 60%的乙醇中进行沉淀多糖。再将所得醇溶液在6500 r/min,10 min条件下离心,弃上清后得到灰树花粗多糖。然后将该粗多糖充分溶解于超纯水中,加入 1/4体积Sevage溶液(氯仿:正丁醇=4:1(V:V))用于去除蛋白,重复操作4~6次。将收集到的上清液氮吹除去正丁醇。再将该多糖溶液装入 12~14 ku的截留分子量的透析袋中透析,透析于4 ℃持续3 d,每天换三次水。之后将透析袋内溶液冷冻干燥,产物命名为GFP。
1.4 单糖组成分析
本试验是在经典的离子交换色谱法的基础上改进的[14],采用离子色谱分离柱,以离子交换树脂做固定相与流动相中的离子进行交换,利用待测离子对交换剂具有不同亲和力这一原理实现分离[15]。在 10.0 mmol/L NaOH溶液为流动相的条件下,通过脉冲安培检测器,分离检测八种单糖。
1.5 GFP的分子量测定及纯度鉴定
采用凝胶渗透高效液相色谱法鉴定灰树花多糖的纯度,并测定其分子量[16]。
1.6 GFP的全波长扫描
将GFP溶于水配成1 mg/mL的溶液,蒸馏水作参比,在200 nm~400 nm范围内进行紫外光谱扫描。
1.7 GFP的糖含量测定
本实验以分析纯葡萄糖为标准品,苯酚-硫酸法测定经纯化后的多糖样品中糖的含量。
1.8 GFP的红外光谱鉴定
将7 mg GFP和150 mg干燥的溴化钾颗粒充分混合、研磨后在室温下测定GFP的红外光谱[16]。
1.9 微观形态观察
1.9.1 扫描电镜观察
取适量的GFP粉末铺在导电胶上,用洗耳球吹去表面浮样。在离子溅射仪中喷金处理15 s左右,即可进行样品扫描。观察多糖样品电镜图像,确定扫描视野,选定放大倍数为1000和2000,分别拍照记录。
1.9.2 原子力显微镜观察
将GFP冻干后,配制成0.1 μg/mL的溶液,之后取5 μL滴加到5 mm×5 mm的云母片上。经过24 h烘箱 40 ℃晾干后,在室温条件下,用扫描探针显微镜(SPI3800-SPA-400,Seiko Instruments Inc)在原子力显微分析模式下以非接触模式对样品进行扫描和拍摄,扫描速率0.5 Hz,用的是金涂层Si3N4探针,横向分辨率为0.2 nm,垂直分辨率为0.01 nm,最大扫描范围为100 μm×100 μm。
1.10 细胞增殖活性的测定
通过MTT[17,18]测定法测定不同浓度GFP处理的HepG2细胞与HL-7702细胞的活力,根据吸光度值计算出GFP对细胞生长的抑制率。分别取对数期的细胞进行计数,在96孔板中接种细胞,其密度大约5×104个/mL,体积为100 μL。16 h后弃去培养液,分别加入不同浓度(0、50、100、200、400 μg/mL)的GFP在96孔板中继续培养24 h。之后在每孔中加入等量的20 μL MTT溶液(5 mg/mL)。将96孔板在培养箱放置4 h并离心,然后弃去培养基,每孔加入150 μL DMSO并振荡15 min以溶解形成的不溶性甲瓒。用酶标仪于570 nm处测量吸光度。
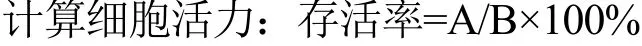
其中A是GFP处理的细胞的平均光密度;B是对照孔的平均光密度。
1.11 线粒体膜电位检测
本试验采用JC-1染色[19],细胞培养如下:按大约2×105个/mL的细胞密度将细胞接种于六孔板中进行细胞培养,16 h后弃培养基,用PBS洗3遍,加入含不同浓度的GFP(0、200、400 μg/mL)的DMEM培养基,以空白样品组为对照组,每组设置3个平行复孔,37 ℃,5% CO2培养箱中继续培养24 h。结束之后将培养基弃掉,用PBS缓冲液清洗三次。试验方法按照试剂盒说明书进行。
1.12 细胞形态学观察
将HepG2细胞(1×106个/mL)接种在6孔板内盖玻片(灭菌)上生长,16 h后用不同浓度GFP(0、200、400 μg/mL)处理,24 h后弃去培养基,加入4%戊二醛固定细胞4 h,30%、40%、50%、60%、70%、80%、90%、95%无水乙醇逐级脱水,扫描电子显微镜下观察细胞形态学变化。
1.13 数据处理
数据处理采用SPSS 20.0软件和Sigma Plot10.0软件对实验数据进行处理。结果以平均值±标准差所表示。
2 结果与分析
2.1 灰树花多糖的单糖组成
下图1为2 mmol/L的标品的离子色谱图,图2为相同条件下GFP的离子色谱图。
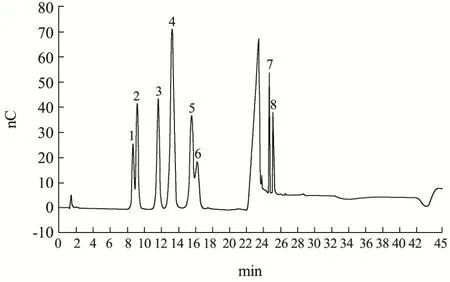
图1 八种单糖的离子色谱图Fig.1 Ion chromatogram of eight monosaccharides
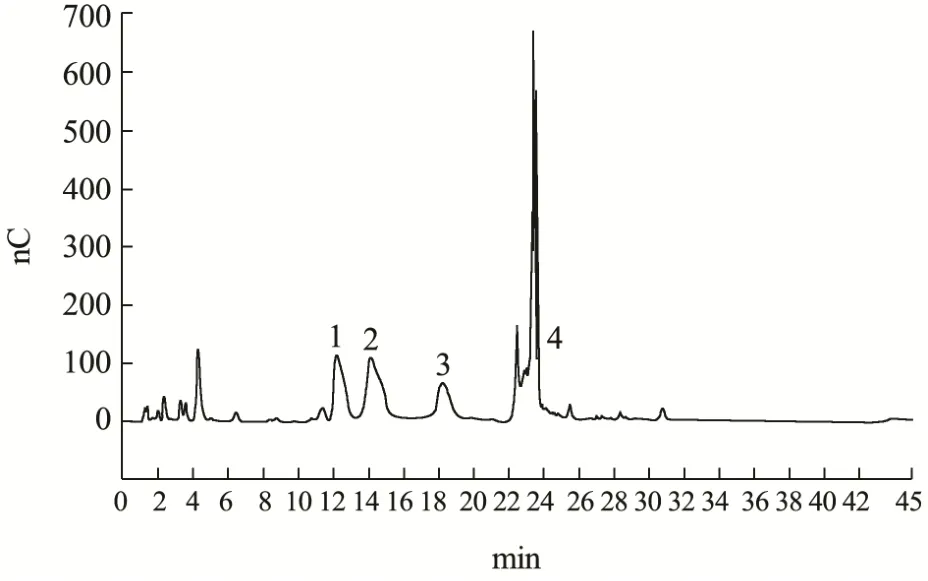
图2 GFP的单糖组分Fig.2 The monosaccharide component of GFP
由离子色谱结果可知,GFP主要单糖为葡萄糖、半乳糖甘露糖。葡萄糖(40.51%~42.11%)和半乳糖(29.35%~30.35%)是主要的单糖,相对少量的是甘露糖(19.88%~20.72%),葡萄糖醛酸(1.43%~1.85%)也被发现在样品中。这些结果表明,GFP主要由三种不同类型的单糖组成的杂多糖。之前也有研究发现不同提取温度得到的三组灰树花多糖样品中葡萄糖是主要单糖(77.60%~80.90%),还有相对少量的半乳糖(7.10%~8.20%)、甘露糖(4.30%~5.80%)、岩藻糖(4.50%~5.40%)和核糖(1.70%~1.90%)[20],这与本试验研究基本一致,均为不同单糖组成的杂多糖。
2.2 GFP的分子量测定及纯度鉴定
本试验采用分子排阻(凝胶渗透)高效液相色谱,以标准葡聚糖分子量对保留时间作多糖分子量标准曲线,根据多糖样品色谱图的保留时间计算多糖样品平均相对分子量。
根据试验结果,本试验低温所提灰树花多糖为混合物,因为它含有两个主要的大分子群体。绝大部分为分子量为1700.00 ku大分子量,峰面积为66.57%。另外一部分的分子量为34.12 ku,其相应的峰面积为28.23%。多糖分子的结构和生物活性与多糖分子量大小直接相关。据报道,在提取过程中,高提取温度可能导致高分子量群体的降解[20]。通常,小分子量多糖可能无法形成活性聚合体,表现出较低的生物活性[21]。
图3 GFP高效液相色谱图Fig.3 High performance liquid chromatography of GFP
2.3 GFP的紫外光谱扫描(UV)
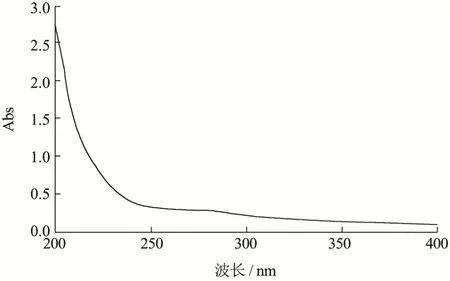
图4 GFP全波长扫描Fig.4 The UV spectra of GFP
图4为GFP的紫外光谱图,显示其在200 nm有最大吸收峰,在260 nm和280 nm均无明显的光吸收,说明GFP不含或含少量游离结合的蛋白质、核酸类物质。
2.4 GFP的糖含量测定
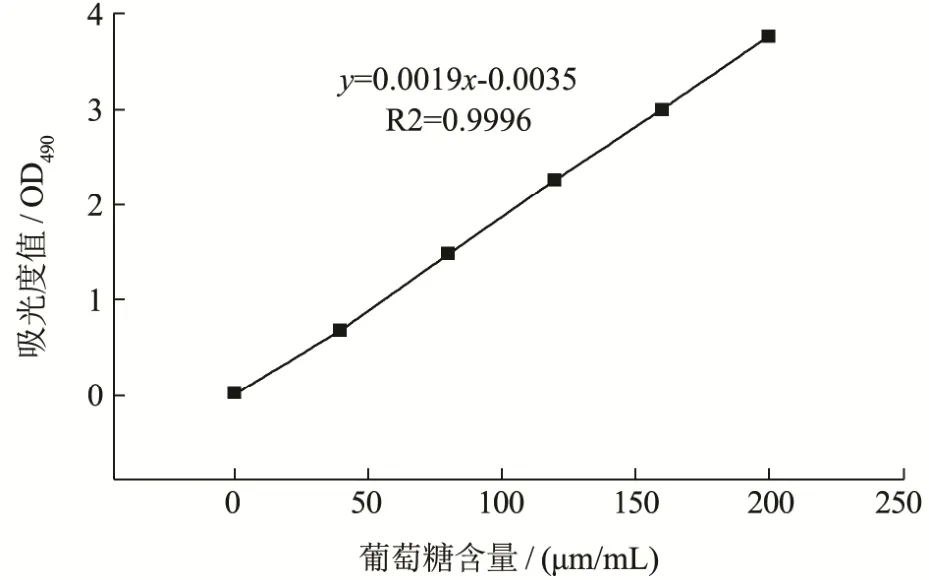
图5 葡萄糖标准曲线Fig.5 Standard curve of glucose
不同浓度分析纯葡萄糖溶液为参照,用苯酚-硫酸比色法在 490 nm处测定各吸光度,以葡萄糖含量(μg/mL)为横坐标,以吸光度值为纵坐标,绘制标准曲线,回归方程为y=0.0019x-0.0035,R2=0.9996,测得GFP中糖含量为86.12%。
2.5 GFP的红外光谱鉴定
采用傅立叶红外光谱(FT-IR)分析GFP的官能团,从图6中可推测GFP的结构特征、糖残基及其构型。
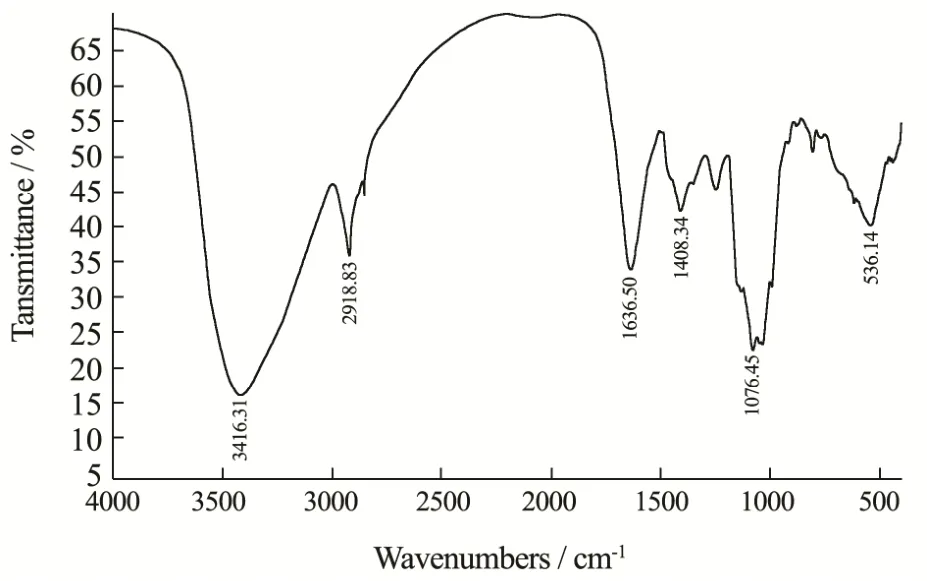
图6 GFP红外分析图谱Fig.6 Infrared spectrum of GFP
图谱中宽峰3415 cm-1波段代表了O-H拉伸振动。2918 cm-1左右的带是由C-H伸缩振动导出的,在2919 cm-1和2000 cm-1处的弱吸收峰为C-H拉伸振动的特征峰,这一区域的吸收峰是糖类的特征吸收峰;1420 cm-1和1250 cm-1左右的宽带可归属于C-H键的弯曲。在1175~1000 cm-1的范围内,是由C-O、C-C、C-O-C和C-O-H的拉伸和弯曲振动造成的,其强信号大约为1076 cm-1处[22]。
这些结果都是蘑菇多糖的典型红外信号。1050 cm-1左右的特征带也表明GFP中存在一个吡喃环,这说明GFP糖环构型为吡喃型;β型糖苷键的吸收峰在890 cm-1左右处,图谱中804 cm-1的吸收峰表明糖苷键可能为α型,这些结果表明灰树花多糖GFP可能为α-吡喃多糖。这进一步证实了低温浸提的灰树花粗多糖水与高温相比理化性质相似,而其差别在于其分子量大小[20]。
2.6 微观形态分析
GFP的扫描电镜图片(×1000倍和×2000倍)如图 7(a、b)所示。GFP的原子力显微镜图片如图7(c、d)所示。
扫描电镜能够直观的分析研究多糖微观形态及空间构象[23],能快速有效地获得待测物的三维立体图像,还能细微的观察测定被测样品的每一个角度,不受待测样品状态影响[24]。
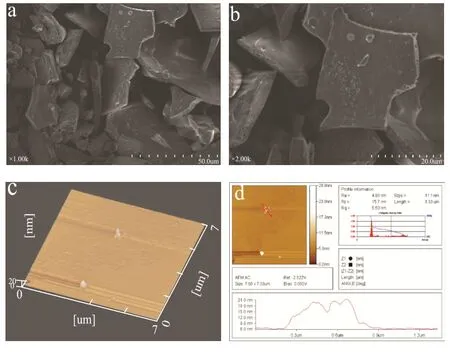
图7 GFP微观形态Fig.7 GFP Microscopic morphology
通过图7a、b中可以看出,多糖呈片层状或碎屑状,表面质地光滑,多糖分子间具有较强的相互作用力,聚集程度大。因为原子力显微镜成像的高度不可能“扩大效应”的影响,而将不同长度和宽度却会受到测量位置不同的影响,高度可以作为一个分子直径的参考。通常来说,多糖分子链一般为0.1~1.0 nm。图7c、d所显示的最大累积高度约为20 nm,这说明每股并非为单个糖链,这可能是由于此多糖分子含有少量糖醛酸照成的,糖链上糖醛酸羧基或羧基负离子上的强电负性氧原子与另一糖链上的羟基氢易于形成分子间氢键这是由多糖分子末端羟基之间氢键。由于浓度低,没有形成复杂的链状或网状与多个糖链缠绕成股的结构。
2.7 GFP对HepG2细胞增殖活性的影响
多糖及其衍生物不仅作为能量的储存和结构成分,还参与信号识别和细胞间通讯,并在免疫系统、受精、发病机制、血液凝固和系统发育等方面发挥关键作用[25]。多糖还可以识别并结合一系列的细胞黏附分子进而发挥活性[26]。
从图8(b)可看出,GFP对人肝HL-7702细胞的增殖几乎没有抑制作用,当其浓度为50 µg/mL~400µg/mL时,对HL-7702细胞的增殖抑制作用与不添加多糖样品的没有明显的差异,说明GFP对正常细胞没有增殖抑制作用。如图8(a)所示,不同浓度的GFP作用24 h后,可明显抑制HepG2细胞的增殖,且随着浓度的增加,抑制率不断增加,并呈现出浓度依赖关系。当GFP浓度为200 µg/mL时,其抑制率达到49.12%,当GFP浓度增加为400 µg/mL时,抑制率达到 76.45%。所以,低温提取的灰树花多糖 GFP对HepG2细胞增殖有显著的抑制作用,其抑制效果优于灰树花深层发酵菌丝体多糖抗肿瘤活性[27]。
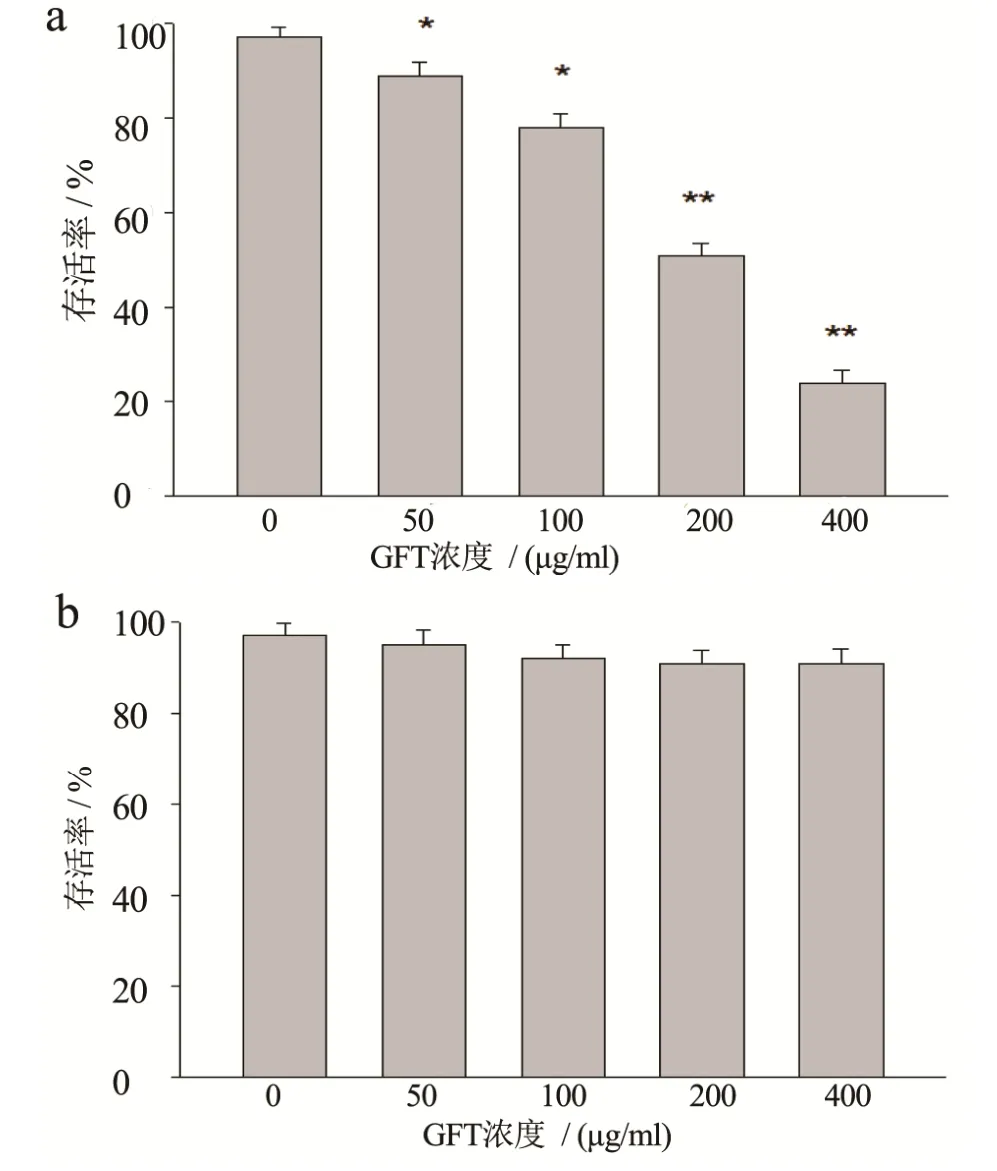
图8 GFP不同浓度对hepG2细胞(a)和HL-7702(b)细胞增殖的影响Fig.8 Effects of different concentrations of GFP on the proliferation of hepG2 cells
2.8 线粒体膜电位检测
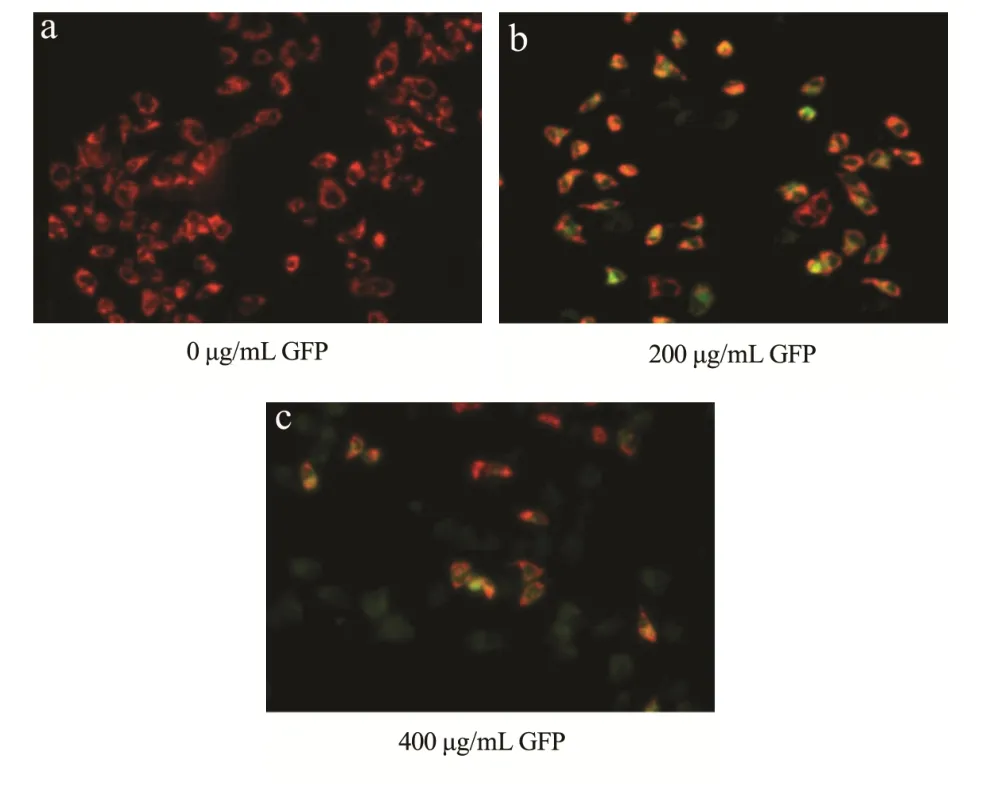
图9 GFP作用于HepG2细胞的JC-1染色图Fig.9 JC-1 staining of HepG2 cells treated with GFP
细胞凋亡早期的标志性变化之一就是线粒体膜电位的下降。本试验中线粒体膜电位检测是以JC-1为荧光探针来检测线粒体膜电位的变化,在线粒体膜电位较高时,JC-1以聚合物形式聚集在线粒体的基质中,产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,可以产生绿色荧光。通过荧光颜色的转变来检测线粒体膜电位的变化。由图9可知,对照组A中JC-1表现为红色荧光,与之相比,在有GFP处理的情况下,HepG2细胞绿色荧光明显增多,并且伴随着GFP浓度的增加细胞中的绿色荧光所占的比例越来越多,说明线粒体膜电位降低。线粒体膜电位的降低作为线粒体膜去极化的结果,是线粒体损伤的一个指标[28],是凋亡的初始和不可逆步骤[29]。由此可以说明GFP对HepG2细胞有促凋亡的作用,并且GFP诱导的细胞凋亡伴随着膜电位的改变。
2.9 GFP诱导HepG2细胞凋亡的形态学观察
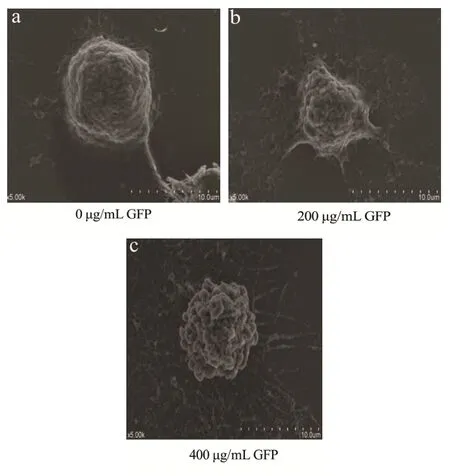
图10 扫描电镜观察GFP诱导HepG2细胞凋亡图Fig.10 Observation of HepG2 cell apoptosis induced by GFP under scanning electron microscope
上图10为GFP处理HepG2细胞24 h的扫描电镜观察的细胞形态结构。由图10可以看出,经过不同浓度GFP处理24 h的细胞形态发生显著变化。不经GFP处理的对照组HepG2细胞,细胞膜完整,表面微绒毛丰富且完整、规则排列、长丝突起分布均匀,细胞间镶嵌连接[30]。经GFP作用24 h后,试验组细胞呈现细胞调亡形态,胞体体积缩小,表面微绒毛卷曲、崎变、小球结构逐渐增多,细胞质形成空泡,细胞间紧密连接结构消失,微核形成。这些结果与其他类型的细胞中观察到的细胞凋亡趋势一致[31],可以看出GFP诱导人肝癌HepG2细胞凋亡。
3 结论
本研究利用低温(4 ℃)提取灰树花多糖,得到了有较好的抗肿瘤作用的功能性多糖GFP。结构鉴定其主要单糖为葡萄糖、半乳糖和甘露糖,含有两个主要的大分子群体,可能为α-吡喃多糖。细胞体外增殖抑制实验(MTT)表明GFP在一定浓度范围内能够抑制肝癌细胞株HepG2的生长。通过JC-1试验检测到线粒体膜电位降低,说明GFP诱导的细胞凋亡伴随着膜电位的改变。对HepG2细胞形态学观察发现,经过GFP处理的HepG2细胞出现了凋亡形态。这说明低温提取的灰树花多糖有一定的抗肿瘤作用。Wang[32]等研究结果表明,含有甘露糖并伴随有葡萄糖和半乳糖存在的多糖组分具有较高的抑瘤活性,单糖组成不同,其结构和功能也有所不同。另外分子质量也是影响多糖活性的一个重要因素,这可能与多糖分子能否形成高级结构有关,GFP分子质量相对较大可能有三股螺旋结构存在,可以产生能形成活性的聚合结构。而多糖分子的立体构型发生改变,活性也会随之消失。这在理论研究和产品开发上都具有非常重要的意义。

