小鼠胃癌模型 Nesfatin-1 水平及其在胃癌共病抑郁发病中的作用
张楠,李江波,王惠玲,肖玲,魏艳艳,何静,王高华,*
1. 引言
胃癌是临床最常见的恶性肿瘤之一,胃癌合并抑郁症的发病率高达27%~44%,远远高于其他癌症,且其中往往女性癌症患者抑郁症的发生率要高于男性[1,2]。研究表明,抑郁的负性情绪可通过神经内分泌功能的紊乱和机体免疫功能的降低从而增加癌症的发病率,促进肿瘤的进展,然而其具体机制尚未明确[3]。近年来,Nesfatin-1作为一种新发现的食欲抑制因子,在胃癌及抑郁症的研究中得到了广泛的关注,研究发现其在中枢及外周均有广泛表达, 且不仅仅在抑制摄食中起重要作用,在癌症及抑郁的发病中也发挥一定的作用[4-6]。
Nesfatin-1是日本学者OH-I在2006年新发现的食欲抑制因子,在摄食、糖代谢及能量平衡中具有重要作用,大鼠脑室注射Nesfatin-1后6 h内NUCB2 mRNA的表达呈剂量依赖性降低,6 h内大鼠采食量呈剂量依赖性减少,而再注射Nesfatin-1抗体Ab24后大鼠摄食恢复正常[7,8]。研究已发现Nesfatin-1在情绪调节及癌症中具有重要作用。抑郁症的临床研究表明抑郁症患者的血浆Nesfatin-1水平较正常对照组显著升高,并且与HAM-D分数呈正相关[9]。我们研究组前期研究也表明,抑郁症模型大鼠的血浆Nesfatin-1比正常大鼠显著增高[4]。其他动物研究表明侧脑室内注射Nesfatin-1可明显诱发大鼠的抑郁情绪,剂量依赖性的增加焦虑、恐惧样行为,减少探索行为[10,11]。此外,有研究发现,伴有体重下降的中晚期肺癌患者血清Nesfatin-1浓度低于正常人及不伴有体重下降的肺癌患者[12]。Nesfatin-1可以通过mTOR和Rho/ROCK信号通路诱导细胞凋亡来抑制人卵巢癌细胞的增殖[13]。而我们研究组前期临床研究发现胃癌合并抑郁症患者的血浆Nesfatin-1浓度显著降低,并与胃癌合并抑郁症的发病、以及抑郁严重程度相关[5]。然而,该研究尚未在动物实验中得到验证,且具体机制尚未明确。本研究拟通过动物实验来探索小鼠胃癌模型血浆及脑组织中Nesfatin-1水平及其在胃癌共病抑郁发病中的作用机制。
2. 材料与方法
2.1 实验动物
近交系615小鼠18只,雌性,SPF级,平均体重18(2)g,6-7周龄,购自中国医学科学院血液病研究所。实验动生产许可证:SCXK(津)2015-0001。实验期间喂养于武汉大学人民医院实验动物房,自由供给标准饲料和清洁自来水,维持12 h光照: 12 h黑暗昼夜节律,室温23-25℃,湿度为(55±10)%。所有操作均被武汉大学人民医院伦理委员会批准。
2.2 主要试剂与材料
小鼠前胃癌细胞(MFC)购自中国科学院细胞库。RPMI-1640培养基购自美国Gibco公司,胎牛血清购自杭州四季青公司,胰蛋白酶、青霉素、链霉素均购自上海吉诺生物科技有限公司,小鼠 Nesfatin-1 Elisa试剂盒 (CEA242Mu)购自武汉优尔生优尔生科技发展有限公司,兔抗Nesfatin-1多克隆抗体购自Sigma公司,辣根过氧化物酶(HPR)标记羊抗兔二抗购自Biosharp公司。
2.3 主要仪器
动物运动轨迹记录分析仪(ethovision 3.0 Netherlands)、CO2培养箱(CB150 德国Binder)、超净工作台(AIRTECH)、倒置显微镜(IX51 日本奥林巴斯)、ChemiDoc Touch成像系统(Bio-Rad)。
2.4 动物分组
18只小鼠随机分成3组,分别为正常对照组(NCG)、胃癌不合并应激抑郁模型组(GCNS)、胃癌合并应激抑郁模型组(GCS),每组6只。NCG普通饲养,GCNS组小鼠普通饲养5周后于皮下接种小鼠前胃癌细胞(MFC)建立皮下移植瘤模型1周,GCS组给以5周慢性不可预见应激(CUMS)后,皮下接种MFC建立皮下移植瘤模型1周。
2.5 试验方法
2.5.1 慢性不可预见性应激(CUMS)
在Willner应激的基础上改进,GCS组接受包括禁食24小时,禁水24小时,隔离24小时,冰水(4℃)5分钟,热水(43℃)5分钟,束缚10分钟,震荡10分钟,夹尾1分钟(夹子位置放置于距离小鼠尾尖末端1cm处)、潮湿24小时[4]。每天随机抽取1-2种刺激,相同刺激不连续给以,7天为一个周期[14]。当GCS与其他两组行为差异有统计学意义时,表明抑郁模型小鼠成功建立。之后接种肿瘤,观察1周。
2.5.2 肿瘤细胞体外培养与接种
小鼠胃癌细胞MFC以适量浓度接种于培养瓶中,加入RMPI-1640培养液(含10%胎牛血清,1%青、链霉素),置于5% CO2培养箱中培养。隔天换液一次,每3-4天传代一次。传代时加入0.2 ml胰蛋白酶及1.8 mlPBS消化30s,用含胎牛血清培养液吹打制成细胞悬液,离心后加PBS稀释到(1x107/ml)的浓度接种。取MFC细胞悬液0.2 ml(含胃癌细胞2 x 106个),种植于GCNS组及GCS组小鼠背部皮下。
2.5.3 行为学检测
(1)糖水偏好试验:在造模前后均给以糖水消耗试验。所有小鼠在实验前给予 1%的蔗糖溶液(W/V)饮用24小时(每笼内2个瓶子),随后其中一瓶1%的蔗糖溶液被替换为正常饮用水饮用12小时,然后两瓶水互换位置12小时,最后24小时内禁食水。实验开始时一个瓶子内放置1%的蔗糖溶液、另一个放置正常饮用水,1小时之后两个瓶子互换(消除小鼠对位置的单侧偏好)。计算2 h蔗糖偏好值(%)=蔗糖溶液消耗量/总液体消耗 100%。(2)旷场试验:旷场长50 cm,宽50 cm,高35 cm,底部被涂成灰白色,四壁白色透明,将小鼠缓慢放入旷场中心。Ethovision 3.0记录和分析小鼠5分钟内的运动轨迹。(3)强迫游泳试验:将小鼠放入圆柱形水桶(高50 cm,直径20 cm,水深25 cm)中,温度(25±2℃)[15],进行6分钟强迫游泳,在最后4分钟记录不动时间。
2.5.4 标本采集与ELISA
行为学检测结束后,将小鼠用1%戊巴比妥(35 mg/kg)腹腔麻醉。心脏取血后置于EDTA抗凝管,然后离心以获得血浆样本,置于-80℃超低温冰箱保存。按照ELISA试剂说明书来测定血浆Nesfatin-1浓度。
2.5.5 Western Blot
心脏取血后立即断头取脑,在冰上快速剥离海马及中脑。取适量脑组织加入RIPA蛋白裂解液,在冰上进行匀浆,提取组织总蛋白。BCA法检测蛋白浓度后,加入上样缓冲液,沸水浴10min使蛋白变性,取20ug总蛋白进行SDS-PAGE凝胶电泳(浓缩胶5%,分离胶10%),电泳结束后进行转膜,转膜后将PVDF膜转移至含5%脱脂奶粉的TBST封闭液中,在室温摇床上封闭1h,TBST洗涤后将膜浸泡于一抗中(兔抗Nesfatin-1 1:1000稀释),4℃摇床上孵育过夜后,TBST洗膜3次,每次10min,再孵育至HPR标记的二抗中(1:10000稀释),室温孵育1h,洗膜后用ECL化学发光法进行曝光显影,蛋白条带经Image lab软件进行灰度值分析,Nesfatin-1/GAPDH灰度值比即表示Nesfatin-1的相对表达量。
2.5.6 剥取瘤组织
取脑后剥取瘤组织,称重 。
2.6 统计学处理
数据用SPSS 19.0处理。用Kolmogorov Smirnov检验测量测量数据的正态性。符合正态分布的数据的形式用X(S)来表示。两组间比较采用独立样本T检验,三组间及以上比较采用单因素方差分析(多组间两两比较采用LSD-t检验)。以p<0.05为差异有统计学意义。
3. 结果
3.1 行为学检测结果
造模前,三组体重、糖水偏好试验之间未见显著性差异(F=0.11,p=0.896;F=0.78,p=0.476)(表1)。在GCNS及GCS造模结束后,GCS组体重增量、水平距离、直立次数显著低于GCNS组(t=-3.39,p<0.001;t=-2.50,p=0.025;t=-2.61,p=0.02),且GCS、GCNS两组均低于NCG组(GCS&NCG:t=-6.33,p<0.001;t=-5.87,p<0.001;t=-5.59,p<0.001;GCNS&NCG:t=-2.94,p=0.01t=-3.38,p=0.004;t=-2.98,p=0.009);GCS组不动时间长于GCNS组与NCG组(t=2.56,p=0.022;t=3.84,p=0.002),而GCNS组与NCG组相比仅有增高的趋势,并无显著性差异(t=1.27,p=0.222)(表2)。
3.2 血浆、海马及中脑Nesfatin-1表达及瘤重在各组间的比较
血浆、海马及中脑Nesfatin-1浓度NCG组与GCS组显著高于GCNS组(NCG&GCNS:t=3.46,p=0.003;t=4.58,p<0.001;t=4.18,p=0.001; GCS&GCNS:t=6.04,p<0.001;t=8.84,p<0.001;t=8.16,p<0.001),而 GCS 组血浆、海马及中脑Nesfatin-1浓度显著高于正常对照组(t=2.58,p=0.021;t=4.26,p=0.001;t=3.97,p=0.001)(见图2,表3)。而GCS组与GCNS组相比,瘤重没有显著性差异(t=-0.301,p=0.770)。
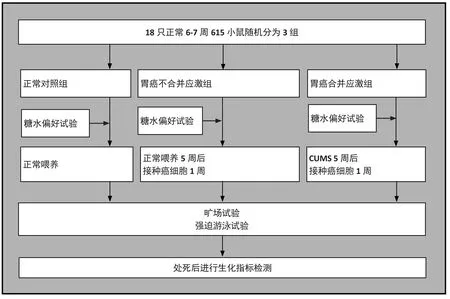
图1. 流程图
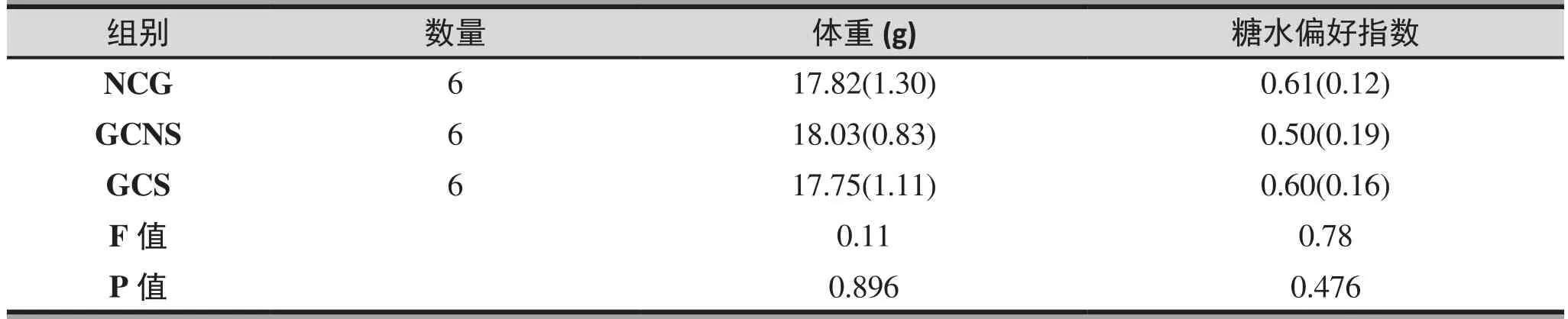
表1. 造模前小鼠行为学评价 (X±S)

表2. 造模后小鼠行为评价(X±S)

图1. 3组小鼠在海马、中脑蛋白表达条带图
4 讨论
4.1 主要发现
本研究发现,GCS组的小鼠表现出抑郁状态(探究活动减少、运动迟缓、行为绝望状态)与人抑郁症中的精神运动改变、兴趣或快感丧失一致。Nesfatin-1无论在中脑、海马还是血浆中,GCS组显著高于NCG组和GCNS组,且GCNS组显著低于NCG组,提示Nesfatin-1在癌症及癌症共病应激抑郁的发病中具有一定作用。
GCNS组小鼠旷场实验也与NCG组小鼠有显著差异,可能是由于胃癌引起的神经内分泌紊乱导致癌性疲乏出现。Nesfatin-1无论在中脑、海马还是血浆中,GCS组显著高于NCG组和GCNS组,且GCNS组显著低于NCG组,这表明Nesfatin-1在癌症及癌症共病抑郁症的发病中具有一定意义。
与本研究组前期研究既往CUMS慢性应激所致的抑郁大鼠血浆中Nesfatin-1水平升高一致,说明慢性应激所致的抑郁状态与血浆Nesfatin-1水平相关[4]。本研究GCNS组小鼠旷场实验也与NCG组小鼠有显著差异,可能是由于胃癌引起的神经内分泌紊乱导致癌性疲乏有关,也不排除癌症共病抑郁的可能。然而,我们研究组前期临床研究结果发现胃癌合并抑郁症患者的血浆Nesfatin-1浓度显著降低,推测其原因为该临床研究胃癌患者多为进展期胃癌,其病理状态有可能打破了抑郁与Nesfatin-1之间的关系[5],而这一结果与本研究GCNS组的结果相一致,这是巧合还是胃癌因素本身也可以导致共病抑郁且不仅仅患胃癌这一应激因素可以导致共病抑郁呢?原因也可能是由于本研究的Nesfatin-1如果在胃癌合并抑郁小鼠和胃癌患病同时受到状态是由应激所致抑郁,这与胃癌所致的情绪障碍的作用机制不同,是非常值得深入研究的。GCNS组血浆Nesfatin-1显著低于NCG组,与之前研究结果一致,可能是由于癌症往往导致摄食量下降,体重降低,体内脂肪组织减少,而脂肪组织中表达Nesfatin-1,是循环Nesfatin-1的来源之一[5,16],这可能导致胃癌组中Nesfatin-1降低。本研究GCNS组体重增量低于NCG,提示有这种可能性,但是GCNS体重增量高于GCS。应激不仅阻止了胃癌小鼠Nesfatin-1水平的降低,反而使其升高,所以单用脂肪量的多少来解释它对Nesfatin-1的影响还不确切,还有待进一步研究。有研究证明NUCB2/Nesfatin-1可以通过LKB1、AMPK/TORC1/ZEB通路促进结肠癌细胞迁移、侵袭和上皮间质转化[17]。Yoo等研究发现Nesfatin-1能通过自分泌的方式诱导前列腺癌细胞的转移[18]。本研究GCNS组中枢和周围Nesfatin-1下调可能也对防止转移具有保护意义,然而,有研究证实Nesfatin-1可以通过mTOR和Rho/ROCK信号通路诱导细胞凋亡来抑制人卵巢癌细胞株HO-8910细胞的增殖[13]。这样说来胃癌导致的Nesfatin-1下调不利于抑制癌细胞增殖,说明它在胃癌发生发展中也可能起一定作用。在我们的研究中,GCS组中枢和外周Nesfatin-1的显著升高,有可能会导致癌细胞侵袭和迁移。然而,我们造模的时间相对较短,却并没有发现有癌症转移,而且两组瘤重也没有显著性差异,是否应激导致的Nesfatin-1升高也对抑制癌瘤增殖有益值得进一步研究。
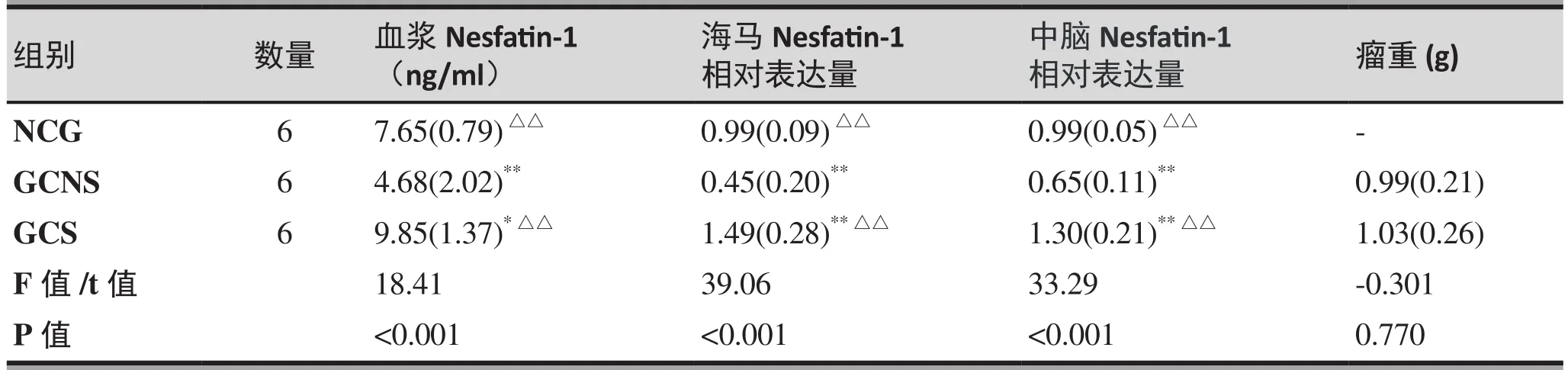
表3. 血浆、脑组织Nesfatin-1及瘤重在各组间的水平(X±S)
研究表明Nesfatin-1在中脑中缝核5-羟色胺(5-HT)及去甲肾上腺素(NE)存在共表达[6]。Yoshida等认为Nesfatin-1可激活对应激敏感的中缝核内的5-HT神经元和蓝斑中NE能神经元,从而刺激室旁核的促皮质激素释放激素(CRF)神经元,激活HPA轴,有研究表明HPA轴紊乱可能与癌症患者抑郁、焦虑情绪的发生有关[19,20]。前期临床研究表明,胃癌共病抑郁患者体内血浆皮质醇明显高于胃癌不伴抑郁组患者,胃癌不伴抑郁组明显低于健康组,与本研究中脑及血浆中Nesfatin-1的变化趋势一致,这进一步表明了Nesfatin-1可能通过5-HT、NE及HPA轴参与胃癌及胃癌共病抑郁的发病[5]。有研究表明,3周内连续腹腔内注射Nesfatin-1导致大鼠海马和PFC中的BDNF蛋白的表达减少,而本研究结果也表明在CUMS所致的胃癌合并应激抑郁小鼠海马中Nesfatin-1的表达增高,这些结果表明,Nesfatin-1能够减少动物模型的探索行为和诱发焦虑样行为,其机制可能与海马中BDNF蛋白有关[11]。
4.2 研究局限
本研究有以下局限性:(a)样本量较小,均为雌性,无法得出Nesfatin-1在胃癌共病抑郁的作用中是否具有性别差异性,实验结果还需进一步验证研究。(b)由于实验条件限制,我们在造模前后分别使用了不同的行为学指标测量,因此无法比较造模前后行为学的变化。(c)本研究仅设立了正常对照组、胃癌不伴应激组、胃癌伴应激组,而没有设立单纯抑郁组,因此难以证明胃癌伴应激组及单纯抑郁组中Nesfatin-1的变化,需进一步深入研究。
4.3 研究意义
综上所述,本研究表明中脑、海马及血浆Nesfatin-1在胃癌合并应激抑郁症或不合并应激抑郁的小鼠模型中均有改变,这表明其在胃癌共病应激及抑郁和胃癌的发病中均具有一定作用,这对癌症及其共病应激抑郁的发病研究提供了一个新的线索,临床上癌症共病抑郁的患病率较高[21],胃癌是一种危及生命的疾病,癌症本身就是重大的应激因素,那么癌症共病抑郁是癌症的病理所致还是应激因素的结果,临床难以鉴别,本研究那么Nesfatin-1在GCNS和GCS的不同变化是否可以作为鉴别癌症共病应激性抑郁还是非应激抑郁的标志物,给今后研究提供了参考,然而Nesfatin-1与癌症共病抑郁的因果关系及其作用机制尚未明确,还需进一步的深入研究。
资金来源
国家自然科学基金(81571325)。
利益冲突
所有作者声明与该论文无相关利益冲突。
伦理审批
所有操作均被武汉大学人民医院伦理委员会批准。
作者贡献
张楠负责本研究的设计和执行,包括后期数据的统计和文章撰写;王惠玲、肖玲为文章提供修改意见;魏艳艳、何静参与本研究动物的饲养及取材;王高华、李江波为研究的设计及文章撰写提供意见和修改。
1. Bergquist H, Ruth M, Hammerlid E. Psychiatric morbidity among patients with cancer of the esophagus or the gastroesophageal junction: a prospective, longitudinal evaluation.Dis Esophagus. 2007; 20(6): 523-529. doi: http://dx.doi.org/10.1111/j.1442-2050.2007.00741.x
2. Zhao ZQ. [Risk Factors for Anxiety and Depression in Gastrointestinal Cancer]. Hebei: Hebei Yi Ke Da Xue; 2016.Chinese
3. Miller AH, Ancoli-Israel S, Bower JE, Irwin MR.Neuroendocrine-immune mechanisms of behavioral comorbidities in patients with cancer. J Clin Oncol.2008; 26(6): 971-982. doi: http://dx.doi.org/10.1200/JCO.2007.10.7805
4. Wang GH, Wu SJ, Wang HL, Wei YY, Gao GQ, Li JB.Plasma Nesfatin-1 concentration and its correlation with HPA axis in depression model rats. J International Psychiatry.2016; 3: 385-388.
5. Wang GH, Gui H, Wang HL, Wei YY, Li JB. [Control study of Plasma Nesfatin-1 and cortisol level in gastric cancer Patients With or Without dePres- sion]. Lin Chuang Jing Shen Yi Xue Za Zhi. 2014; 6: 372-375. Chinese
6. Goebel-Stengel M, Wang L, Stengel A, Tache Y. Localization of Nesfatin-1 neurons in the mouse brain and functional implication. Brain Res. 2011; 1396(1): 20-34. doi: http://dx.doi.org/10.1016/j.brainres.2011.04.031
7. Oh-I SK, Hiroyuki S, Tetsurou S, Okada S, Adachi S, Inoue K,et al. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature. 2006; 443(7112): 709-712. doi: http://dx.doi.org/10.1038/nature05162
8. Shimizu H, Oh-I SK, Nakata M, Nakata M, Yamamoto S,Yoshida N, et al. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 2009; 150(2): 662-671. doi:http://dx.doi.org/10.1210/en.2008-0598
9. Ari M, Ozturk O H, Bez Y, Oktar S, Erduran D. High plasma nesfatin-1 level in patients with major depressive disorder.Prog Neuropsychopharmacol Biol Psychiatry. 2011; 35(2):497-500. doi: http://dx.doi.org/10.1016/j.pnpbp.2010.12.004
10. Merali Z, Cayer C P, Anisman H. Nesfatin-1 increases anxiety- and fear-related behaviors in the rat.Psychopharmacology. 2008; 201(1): 115-123. doi: http://dx.doi.org/10.1007/s00213-008-1252-2
11. Ge JF, Xu YY, Qin G, Pan XY, Cheng JQ, Chen FH.Nesfatin-1, a potent anorexic agent, decreases exploration and induces anxiety-like behavior in rats without altering learning or memory. Brain Res. 2015; 1629: 171-181. doi:http://dx.doi.org/10.1016/j.brainres.2015.10.027
12. Çetinkaya H, Karagöz B, Bilgi O, Özgün A, Tunçel T,Emirzeoğlu T, et al. Nesfatin-1 in advanced lung cancer patients with weight loss. Regul Pept. 2013; 181(3): 1-3. doi:http://dx.doi.org/10.1016/j.regpep.2012.11.005
13. Xu Y, Pang X, Dong M, Wen F, Zhang Y. Nesfatin-1 inhibits ovarian epithelial carcinoma cell proliferation in vitro.Biochem Biophys Res Commun. 2013; 440(4): 467-472. doi:http://dx.doi.org/10.1016/j.bbrc.2013.06.001
14. Willner P. Validity, reliability and utility of the chronic mild stress model of depression: a 10-year review and evaluation.Psychopharmacology. 1997; 134(4): 319-329
15. Porsolt RD, Bertin A, Jalfre M. Behavioral despair in mice: a primary screening test for antidepressants. Arch Int Pharmacodyn Ther. 1977; 229(2): 327-336
16. Senin LL, Al-Massadi O, Barja-Fernandez S, Folgueira C, Castelao C, Tovar SA, et al. Regulation of NUCB2/Nesfatin-1 production in rat’s stomach and adipose tissue is dependent on age, testosterone levels and lactating status.Mol Cell Endocrinol. 2015; 411(C): 105-112. doi: http://dx.doi.org/10.1016/j.mce.2015.04.016
17. Kan JY, Yen MC, Wang JY, Wu DC, Chiu YJ, Ho YW, et al.Nesfatin-1/Nucleobindin-2 enhances cell migration,invasion, and epithelial-mesenchymal transition via LKB1/AMPK/TORC1/ZEB1 pathways in colon cancer.Oncotarget. 2016; 7(21): 31336-31349. doi: http://dx.doi.org/10.18632/oncotarget.9140
18. Yoo T K, Cho H J, Im E, Yang H. Nesfatin-1 induces cell migration via an autocrine pathway in cancer cells.International J Urology. 2014; 21: A228-A228
19. Jehn CF, Kühnhardt DM, Possinger K, Flath B. Plasma IL-6 and HPA-axis function in depression and anxiety in patients with cancer. J Clin Oncol. 2005; 23(16Suppl): 8033
20. Yoshida N, Maejima Y, Sedbazar U, Ando A, Kurita H,Damdindorj B, et al. Stressor-responsive central Nesfatin-1 activates corticotropin-releasing hormone, noradrenaline and serotonin neurons and evokes hypothalamic-pituitaryadrenal axis. Aging. 2010; 2(11):775-784. doi: http://dx.doi.org/10.18632/aging.100207
21. Hong JS, Tian J. Prevalence of anxiety and depression and their risk factors in Chinese cancer patients. Support Care Cancer. 2014; 22(2): 453-459. doi: http://dx.doi.org/10.1007/s00520-013-1997-y

