玉米磷酸烯醇式丙酮酸羧化酶基因的克隆及其表达载体构建
曹路遥,周 岩*,魏琦超,陈燕绘,陈亚东,2,蔺一帆,田瑞婷
(1.河南科技学院 生命科技学院/现代生物育种河南省协同创新中心,河南 新乡 453003;2.河南省华隆生物技术有限公司,河南 新乡 453003)
光合作用是地球碳-氧平衡的重要媒介,是植物赖以生存的基础,也是决定作物产量高低的重要因素之一。作物中 90%以上的干质量来源于光合作用,但是农作物的光能利用效率比较低,目前高产的稻麦类作物的光能利用率仅为 1%~1.5%[1],因此,改善作物的光合性能从而提高作物的生物产量成为作物遗传改良的研究重点。
有研究发现,在C3植物中导入C4光合途径中的关键酶,有提高C3植物叶片光合效率的作用,进而可以使产量增加[2-4]。C4光合途径中有许多酶的参与,磷酸烯醇式丙酮酸羧化酶(PEPC)是其中的一个关键酶,该酶不仅可以通过固定大气中的CO2为植物光合作用提供碳源,还可以回补三羧酸循环的草酰乙酸和苹果酸,促进N素同化,协调细胞的代谢活动,调节细胞质的离子平衡和pH值[5]。
目前,该基因不仅从不同C4植物中克隆出来,并且已经利用重组DNA技术成功导入到水稻、油菜、小麦、马铃薯等C3植物中,取得了一定的研究进展[6-10]。Ku等[11]利用农杆菌介导法成功将玉米的pepc基因导入到水稻中去,获得了转pepc基因水稻,其光合生理性状和种子的产量都得到提高。张艳等[12]将高粱C4型全长pepc基因通过农杆菌介导法导入大豆中,获得了转基因植株,经检测发现T0代植株和T1代植株的净光合速率较对照相比分别提高了37.4%和20.7%,且净光合速率增幅越大则单株产量增加也越多。马宏敏[13]以转甘蔗pepc基因的籼稻植株和非转基因的植株为研究材料,发现在光合效率和产量相关性状方面,转甘蔗pepc基因植株都有较大提高,可以实现增产目的。张桂芳等[14]首次将含有稗草根型的pepc基因对水稻进行遗传转化,研究结果表明,转基因水稻的PEPC活性最高,为对照的 5.85 倍,植株叶片的净光合速率(Pn)较对照相比提高了20.00%。尹吴等[15]发现,与对照相比,转玉米pepc基因的杨树表现出较强的光利用能力,其羧化能力和酶活性与对照相比最高可分别增加62.3%和38.6%。吴琼等[16]发现,与对照周麦19相比,转玉米pepc基因的小麦在单穗质量、千粒质量、收获指数等方面得到显著提高。
表达载体构建的方法有很多,例如传统酶切连接法、一步克隆法等。传统载体构建的方法是利用多克隆位点,经过限制性内切酶和连接酶构建载体,中间需要一系列的酶切、连接、转化、回收工作,此种方法虽然简便,但是比较繁琐,且费时费力,不适合构建长片段、多片段拼接的复杂载体。另外,磷酸烯醇式丙酮酸羧化酶(PEPC)基因序列较长,即使克隆成功,也不容易连入表达载体[17]。Gateway克隆技术是Invitrogen公司开发的一套分子克隆新技术,主要通过运用BP和LR 2个重组反应来构建载体,首先需要把目的基因导入到入门载体(Entry Vector)上,然后就可以不用限制性内切酶,单靠重组酶和载体上的特定重组位点就可以快速高效地将目的基因克隆到Gateway目标载体(Destination Vector)上。由于Gateway克隆技术的适应性、高效性和兼容性等特点,使得该技术成为最广泛应用和效率最高的重组克隆技术[18]。本研究利用同源克隆和RT-PCR技术从玉米自交系品种 ZD410 中成功克隆出C4途径关键酶pepc基因的cDNA全长,并对其氨基酸序列进行同源性检索分析,证实其属于PEPC大家族;利用Gateway克隆技术成功构建了含pepc目的基因的表达载体 pEXPR-PEPC;通过农杆菌介导的花絮浸染法对模式植物拟南芥进行转化,经PCR及RT-PCR检测,初步证实获得27株转pepc基因阳性植株。并对pepc基因克隆和载体构建中存在的问题进行讨论,以期为C4途径关键酶pepc基因的高表达克隆载体的构建及农作物的高光效基因工程育种和抗逆性育种研究提供参考。
1 材料和方法
1.1 供试材料
1.1.1植物材料供试植物材料为玉米自交系品种 ZD410(河南科技学院生命科学院陈士林教授提供)、野生型拟南芥(ArabidopsisthalianaL,河南科技学院作物基因组学与遗传改良实验室保存),本研究试验材料均种植于光照培养箱(16 h 12 000 lx 光照和 8 h 黑暗)。
1.1.2菌株及质粒pEASY-Blunt Zero 克隆载体和 Trans1-T1 Phage Resistant Chemically 感受态细胞均购自北京全式金生物技术有限公司,Gateway 入门载体 pENTR-VIR、表达载体pDEST-COT及农杆菌菌株GV3101pMP90均由本中心实验室保存。
1.1.3主要试剂植物总 RNA 提取试剂盒、反转录试剂盒以及胶回收试剂盒均购自宝生物工程(大连)有限公司;KAPA HiFi HotStart DNA Polymerase 购自 Kapa Biosystems 公司;Taq DNA Polymerase 购自天根生化科技(北京)有限公司;NotⅠ-HF、XmaⅠ、T4 DNA聚合酶均购自 NEB 公司;Gateway LR Clonase Ⅱ enzyme mix 购自 Invitrogen 公司;引物合成和测序由上海立菲生物技术有限公司(北京)完成;其他试剂均为进口或国产分析纯。
1.2 试验方法
1.2.1玉米叶片总RNA的提取和cDNA的合成取0.1 g新鲜的幼嫩玉米叶片迅速置于液氮中研磨,按照TaKaRa MiniBEST Plant RNA Extraction Kit说明书提取玉米叶片总RNA;以总RNA为模板,按TaKaRa PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit说明书进行反转录反应,产物于-20 ℃保存备用。
1.2.2玉米磷酸烯醇式丙酮酸羧化酶基因的全长克隆根据NCBI网站上已发表的玉米磷酸烯醇式丙酮酸羧化酶(PEPC)基因的cDNA 全长序列(登录号:AY103747),运用软件 Primer 5.0 设计 PEPC 全长特异性引物、β-actin内参引物。
pepc:5-CGCTTCCGTGCTTAGCTTCCCG-3,
5-GAGAAGCCGCCTAGCCAGTGTT-3;
β-actin:5-ATGTTTCCTGGGATTGCCGAT-3,
5-CCAGTTTCGTCATACTCTCCCTTG-3。
以 cDNA 为模版进行 PCR 扩增反应, 25 μL 反应体系如下:PCR grade water 15.25 μL、5×KAPA HiFi Fidelity 5.00 μL、10 mmol/L dNTP Mix 0.75 μL、上下游引物(10 μmol/L)各0.75 μL、cDNA模板2.00 μL、KAPA HiFi HotStart DNA Polymerase 0.50 μL。
PCR扩增反应条件:95 ℃预变性5 min;98 ℃变性20 s;61 ℃复性15 s;72 ℃延伸3 min;总共32个循环;72 ℃再延伸5 min。PCR扩增产物用0.8%的琼脂糖凝胶电泳进行检测,目的条带用 TaKaRa MiniBEST Agarose Gel DNA Extraction Kit 切胶回收,连接 pEASY-Blunt Zero 克隆载体,转化 Trans1-T1 Phage Resistant Chemically 感受态细胞,待抗性平板上长出菌落后挑单菌落进行扩大培养,提质粒后进行 PCR 检测,阳性菌液送去测序。
1.2.3植物表达载体的构建及鉴定
1.2.3.1构建含pepc目的基因的入门载体在全长pepc基因两侧分别引入NotⅠ和XmaⅠ酶切位点,重新构建含NotⅠ和XmaⅠ酶切位点的目的基因质粒(命名为pEASY-PEPC),pEASY-PEPC和pENTR-VIR分别用NotⅠ和XmaⅠ双酶切,1%琼脂糖凝胶电泳检测,切胶回收pEASY-PEPC的3 000 bp目的条带和原入门载体pENTR-VIR4 000 bp条带,用T4 DNA聚合酶连接即成为新的入门载体,重新命名为pENTR-PEPC(图1)。
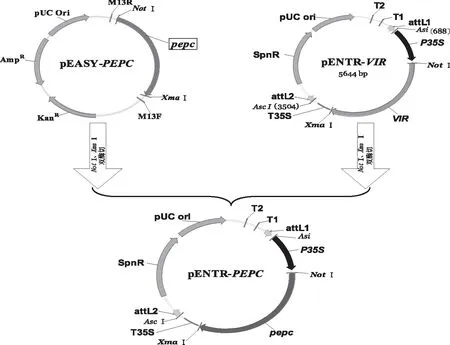
图1 玉米pepc基因入门载体构建示意
1.2.3.2利用Gateway克隆技术构建含目的基因的表达载体将测序正确的重组质粒pENTR-pepc和保存菌种pDEST-cot进行LR反应,得到表达载体pEXPR-pepc。5 μL反应体系如下:灭菌ddH2O 1.30 μL、pENTR-pepc质粒DNA 1.25 μL、pDEST-cot质粒DNA 0.45 μL、TE buffer(pH值8.0)1.00 μL、Gateway LR Clonase Ⅱ enzyme mix 1.00 μL。在微型离心管中加入上述液体,轻微混合后,置于恒温金属浴上25 ℃反应1 h,然后向混合液中加入1 μL Proteinase K solution,置于恒温金属浴上37 ℃反应10 min,得到重组表达载体pEXPR-pepc(图2)。
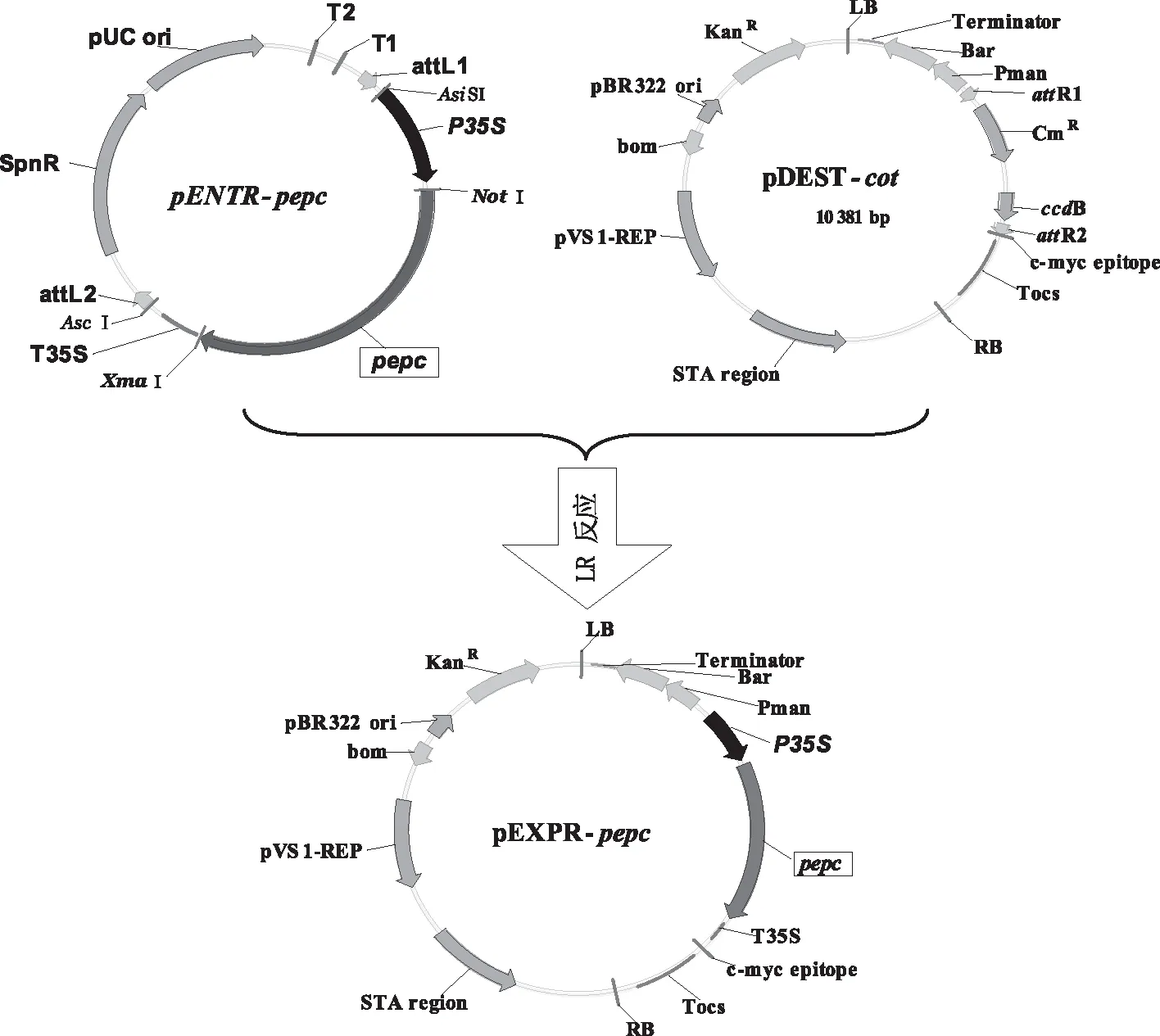
图2 pepc全长基因表达载体构建示意
1.2.3.3重组表达载体pEXPR-pepc的分子生物学检测以重组质粒pEXPR-pepc为模板,用含酶切位点的pepc全长目的基因检测引物鉴定重组子,阳性重组子送去测序。
1.2.4重组质粒转化农杆菌GV3101pMP90感受态细胞及鉴定取1 μL测序鉴定正确的pEXPR-pepc重组质粒加入100 μL GV3101pMP90感受态,冰浴30 min;然后置于-70 ℃冰箱冷冻10 min;42 ℃水浴热激90 s;冰浴2 min;在超净工作台中加500 μL不添加任何抗生素的YEB 液体培养基,180 r/min 28 ℃复苏3 h;将复苏后的菌液均匀涂布于含有 Kan、Rif和Gent(终质量浓度都为50 mg/L)的 LB 固体培养基上,37 ℃过夜倒置培养;菌落出现后,挑单菌落扩大培养并进行 PCR 检测。
1.2.5农杆菌介导的拟南芥转化
1.2.5.1农杆菌浸染液的制备挑取单菌落接种于10 mL含相应抗生素的YEB 培养基中,28 ℃、180 r/min振荡培养24 h,再次加入100 mL YEB,在相同条件下培养到OD600值大于或等于1;将培养好的农杆菌菌液4 000 r/min离心15 min,沉淀用制备好的悬浮液悬浮,调整OD600到0.8~1.0。悬浮液配方如下(500 mL):MSB5 1.1 g、蔗糖25 g、6-BA 2.5 μL(2 mg/mL)、Silwet L-77 100 μL,调整pH值到5.7。
1.2.5.2花序浸染法转化拟南芥在进行转化的前一天将拟南芥用营养液浇透,选取同一时期花蕾较多的拟南芥进行转化,转化时将野生型拟南芥的所有花序放入制备好的农杆菌浸染液中浸泡30 s;然后将花盆侧放到铺有湿润报纸的塑料托盘上;用黑色塑料袋对其进行遮光保湿16 h;后转移至光照培养箱中恢复至正常培养;1周后观察植株长势,可对生长强壮的植株重复进行一次转化,以提高转化率;转化5~6周后,为了加速拟南芥种子的成熟可适量少浇营养液,待植株枯黄以后,即可收取种子。
1.2.5.3转pepc基因的拟南芥阳性植株的筛选将收获的T1代拟南芥种子放入50 mL离心管中,加入适量灭菌的0.1%的琼脂糖,均匀混合后放入4 ℃冰箱春化 2~3 d;将春化后的种子混合液用移液枪吸取,均匀滴至营养基质上(丹麦营养土、蛭石1∶),放入光照培养箱进行正常培养;对长出4片真叶的幼苗先用10 000倍Basta溶液(质量分数为20%)均匀喷洒植株叶片,间隔1周左右再用5 000倍Basta溶液喷洒2遍;待拟南芥植株抽薹以后,对具有Basta抗性的植株叶片进行PCR检测。
1.2.5.4转pepc基因的拟南芥阳性植株的PCR检测跨启动子和目的基因序列设计检测引物,对经过 3 遍Basta溶液筛选后仍能正常生长的拟南芥植株叶片组织直接进行PCR鉴定。详细引物信息及扩增体系如下:
NJS:5-CCTACACGCTGAAGCGGATAAGG-3,
NJA:5-TTATTAGTTCGCCGCTCGGTGTGTCG-3。
20 μL反应体系如下:灭菌ddH2O 7.60 μL、2×Phire Plant PCR Buffer 10.00 μL、上下游引物(10 μmol/L)各1.00 μL、Phire Hot Start Ⅱ DNA Polymerase 0.40 μL。PCR扩增反应条件:98 ℃预变性5 min;98 ℃变性5 s;58 ℃复性10 s;72 ℃延伸25 s;总共40个循环;72 ℃再延伸1 min。PCR扩增产物用1.5%的琼脂糖凝胶电泳进行检测。
1.2.5.5转pepc基因的拟南芥阳性植株的RT-PCR检测根据全长基因序列设计检测引物,对PCR检测的拟南芥阳性植株提取植物总RNA,反转录为cDNA,然后进行RT-PCR鉴定。详细引物信息及扩增体系如下:
NJS1:5-TCGTCTTCACCGCGCATCCCAC-3,
NJA1:5-CACGCCCTTCCATACAGTCTCA-3。
25 μL反应体系如下:灭菌ddH2O 19.50 μL、10×TaqBuffer 2.50 μL、dNTP Mixture 0.50 μL、上下游引物(10 μmol/L)各0.50 μL、DNA Polymerase 0.50 μL、样品 1 μL。PCR扩增反应条件:98 ℃预变性3 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,总共32个循环;72 ℃再延伸5 min。PCR扩增产物用2%的琼脂糖凝胶电泳进行检测。
2 结果与分析
2.1 叶片总RNA及目的基因RT-PCR产物检测
玉米叶片总RNA采用1%的琼脂糖凝胶电泳进行检测,结果表明(图3),提取的叶片总RNA明显可见28S和18S 2条带,带型清晰,完整性良好,紫外分光光度计检测OD260/280在1.8~2.1。以 cDNA为模板进行 PCR 扩增,0.8%琼脂糖凝胶电泳检测结果显示,在3 kb左右处有1条亮带,与预期片段长度一致(图4)。
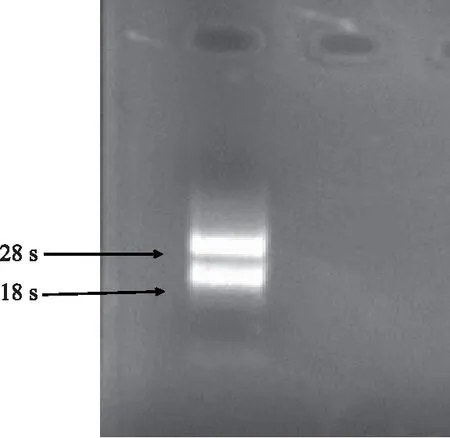
图3 玉米叶片总RNA的凝胶电泳结果
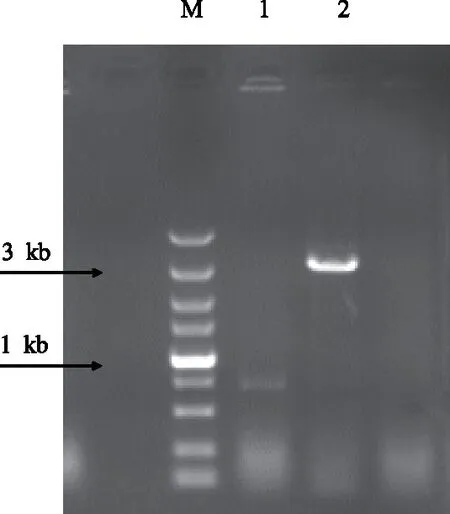
M:Marker DL5000(下同); 1:β-actin 750 bp; 2:PCR products图4 玉米pepc cDNA的PCR产物电泳分析
2.2 回收全长目的基因转化感受态细胞及阳性菌落的PCR检测
切胶回收全长目的基因RT-PCR产物,转化Trans1-T1 Phage Resistant Chemically感受态细胞,将转化后的菌液均匀涂布在含有Amp的平板上,37 ℃过夜倒置培养,有白色菌落出现(图5)。从LB平板上挑取白色单菌落转移到含有Amp的LB液体培养基中,200 r/min、37 ℃过夜扩大培养,提质粒后(图6),以质粒为模板进行PCR鉴定。如图7所示质粒PCR产物大小与目的片段大小一致,初步断定为目的基因重组子,将重组质粒PCR鉴定结果正确的菌液送去测序,以确定全长目的基因序列。
图5 LB固体培养基上的玉米pepc重组子

图6 重组质粒的电泳分析

图7 重组质粒的PCR电泳
2.3 玉米pepc全长基因克隆序列分析
测序结果显示,玉米pepc基因全长cDNA序列为2 952 bp,包括完整的开放阅读框2 913 bp,共编码970个氨基酸,此外还包括5′非编码区序列 29 bp和3′非编码区序列13 bp;用 ProtParam(physico-chemical parameters of a protein sequences,http://web.expasy.org/protparam/)在线程序对该序列进行分析,结果表明,该基因分子质量约为 108.179 ku,分子式为 C4675H7304N1344O1547S34,PI为5.73,不稳定系数为37.19,脂肪系数为46.66;其含量较高的氨基酸有Thr(15.9%)、Glu(8.2%)、Ala(7.3%)、Arg(6.9%)、Gly(6.8%);对该蛋白质进行疏水性分析,显示出该PEPC蛋白质具有较强的亲水性;跨膜结构预测显示该蛋白质不存在跨膜区。
运用 NCBI 上的 BLast软件对其氨基酸序列进行同源性检索分析,在多个数据库中显示检索的序列大多为pepc基因,且具有极高的同源性。筛选出几种典型C4植物的pepc基因氨基酸序列,用DNAMan软件对其进行多序列比对分析。其中氨基酸序列同源性由高到低依次是甘蔗(Saccharumofficinarum)、高粱(Sorghumvalgare)、谷子(Setariaitalica)、稗草(Echinochloacrugalli),其对应同源率分别达到达到 79.71 %、79.09 %、73.71 %、71.09 %。
2.4 玉米pepc全长基因表达载体的构建
首先在全长目的基因两端分别引入NotI和XmaI酶切位点,通过NotI和XmaI双酶切、连接改造原有入门载体(图8、图9),构建含pepc基因全长的入门载体,命名为 pENTR-pepc(图10);菌液PCR及测序鉴定结果正确。入门载体pENTR-pepc和原有目的载体pDEST-cot进行LR反应,得到新的含pepc基因全长的表达载体pEXPR-pepc,菌液PCR及测序鉴定结果正确(图11)。

1:pEASY-pepc质粒DNA; 2:pEASY-pepc双酶切产物;3:pENTR-vir质粒DNA; 4:pENTR-vir双酶切产物图8 NotⅠ和XmaⅠ双酶切

5:pENTR-vir双酶切胶回收产物; 6—7:pEASY-pepc双酶切胶回收产物图9 双酶切胶回收电泳结果

8—9:入门载体PCR图10 入门载体PCR检测结果

10—11:表达载体PCR图11 表达载体PCR检测结果
2.5 农杆菌GV3101pMP90感受态细胞的转化及鉴定
pEXPR-pepc重组质粒转化GV3101pMP90感受态细胞(图12),挑取转化后的单菌落接种于含有Kan、Rif和Gent的LB液体培养基中,28 ℃、180 r/min振荡下过夜培养,pepc全长基因引物对菌液进行PCR检测,结果显示,能扩增出来3 000 bp左右目的基因条带(图13),说明重组质粒pEXPR-pepc已成功转入农杆菌GV3101pMP90。
图12 农杆菌感受态细胞的转化
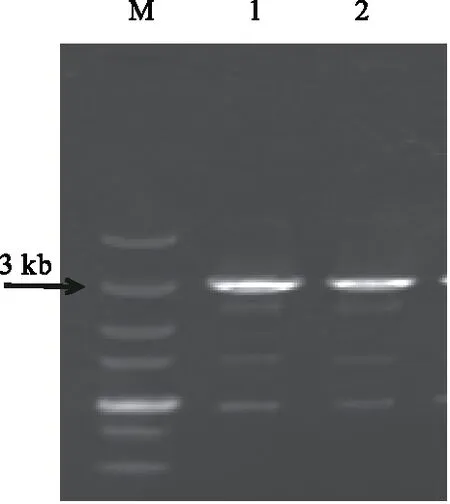
1—2:根癌农杆菌PCR图13 重组质粒导入根癌农杆菌的PCR捡测
2.6 转pepc基因的拟南芥阳性植株的筛选与鉴定
对经过3遍Basta溶液筛选后仍能正常生长的拟南芥植株叶片组织直接进行PCR鉴定,如图14所示,转pepc基因拟南芥阳性植株和pepc大肠杆菌质粒DNA同样都能扩增出1 000 bp左右片段;对经过PCR鉴定的阳性植株提RNA,进行RT-PCR检测,如图15所示,转基因植株和质粒DNA同样都能扩增出200 bp左右目的条带;初步证明玉米pepc基因经过农杆菌介导的花絮浸染法已成功转入拟南芥。

M1:Marker DL 5000; 1、2:转基因拟南芥PCR结果; 3:质粒 DNAPCR结果; 4:非转基因拟南芥PCR结果图14 转pepc基因拟南芥的PCR检测
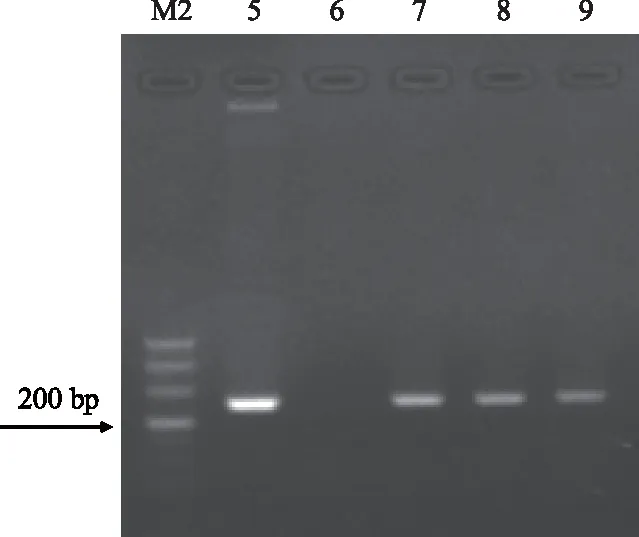
M2:Marker DL 500; 5.质粒DNA PCR结果; 6:非转基因拟南芥RT-PCR结果; 7—9.转基因拟南芥RT-PCR结果图15 转pepc基因拟南芥的RT-PCR检测
3 结论与讨论
植物表达载体的构建在植物基因工程中占据重要地位,而选择合适的表达载体对外源基因的转化和表达非常重要,本研究采用Gateway入门载体载体pENTR-vir、pDEST-cot成功构建了含有C4植物pepc基因表达载体pENTR-pepc,使用草铵膦作筛选标记,在T35S启动子下表达pepc基因,为pepc基因表达提供了一个高效的载体,回避了在传统的表达载体构建中酶切位点选择的局限性。同时由于具有致死基因ccdB,使未成功重组载体的大肠杆菌无法生长,有效减少了假阳性菌株,为后期筛选工作节省了时间。表达载体中有抗草铵膦筛选基因(PPT),在对转pepc基因拟南芥阳性植株筛选时,对长出4片真叶的幼苗间隔1周左右用适当草铵膦溶液喷洒,未成功转基因的拟南芥黄化死亡,转基因拟南芥则不受影响,从而很大程度地减少了工作量[19]。
拟南芥是典型的模式植物,因此,玉米C4型pepc基因在拟南芥基因组中的表达与光合效应分析更具有代表性。目前,对拟南芥的遗传转化最普遍的是利用农杆菌介导的花序浸染法,而侵染过程的很多方面直接影响着转化的成功率。首先是转化缓冲液的成分。在转化缓冲液中,添加蔗糖不仅可以为农杆菌提供转化能量,而且可以使花粉内外压强保持一致。陈军等[20]在油菜花药的培养过程中发现,蔗糖浓度高低对花粉小孢子活力也有很大的影响。另外蔗糖还能在一定程度上诱导vir基因的表达,这将可以提高农杆菌的转化效率[21]。为了使农杆菌可以更好地吸附在植物表面,并且可以顺利进入植物组织细胞中去,一般还应在转化缓冲液中添加一定浓度的表面活性剂如Silwet L-77[22]。有研究发现,转化拟南芥时添加Silwet L-77 的适宜浓度为0.05%[23],浓度过高对结实率有显著的抑制作用,且转化不稳定。其次是农杆菌的侵染浓度。Clough等[24]研究发现,当农杆菌侵染液的OD600为0.8时转化效果最好,浓度过高会影响拟南芥花絮的生长,过低则会降低转化效率。但有些研究者发现,侵染液浓度OD600在0.15~1.74时对转化效率影响不大[25]。最后是侵染的时间和次数。一般来说侵染时间过长可能会降低花絮的成活率,从而使结籽率相应降低,影响后续试验;侵染时间过短则会降低转化的成功率。还有研究发现,间隔一段时间对拟南芥进行重复侵染可以获得较高的转化率[25]。本次试验过程中,采用的浸染缓冲液配方为2.2 g/L MSB5、50 g/L蔗糖、0.044 μmol/L 6-BA和 200 μL/L silwetL-77,pH 值为 5.7,OD600为1.0左右,选取生长健壮,且同一时期花蕾较多的拟南芥进行第一次转化,1周后观察植株长势,对生长强壮的植株重复进行一次转化,该方法不仅转化率比较高,而且转化效果最好。本研究为进一步分析玉米C4型pepc基因在C3植物中的表达分析奠定了研究基础。
——一道江苏高考题的奥秘解读和拓展

