EM菌制剂处理对马铃薯种薯细胞保护及抗性生理特性的影响
, , , , , , ,
(1.东北农业大学, 哈尔滨 150030; 2.辽宁省本溪市农业技术服务中心, 辽宁 本溪 117000)
EM菌制剂是由日本琉球大学的比嘉照夫教授于1982年研究成功的复合活菌剂,为黄褐色、半透明液体,pH值在3.5~4.5之间,含有多种有益微生物[1]。EM菌制剂釆用日本菌种的发酵技术,利用特殊的发酵工艺,通过筛选,使菌液中嫌气性微生物和好气性微生物共存[2-3]。EM菌用途广泛、效果显著,主要应用于农业、畜牧养殖业和环境保护等领域。农业方面,EM菌主要有提高作物质量产量、减少化肥使用和改良土壤、抑制病虫害和杂草的作用。田志宏等研究表明,根灌、喷施EM菌制剂与对照相比,马铃薯单株薯数、薯重和小区产量均显著增加,增产幅度达8.8%~13.6%,有良好的经济效益和生态效益[4]。陈胜利等采用田间小区试验法研究EM菌剂对作物生长及生理效应的影响得出,用EM菌剂拌种,土壤中有机质、碱解氮、速效、磷速效钾等各养分物质含量均有所增加、酸碱度稳定[5]。这是由于菌体在土壤中的一系列活动促使作物生长发育,对根际土壤的影响也十分明显,有效促进作物的生长发育和土壤的培肥[5]。使用EM菌制剂还可以避免大量使用化肥、农药等对人体有害的物质,对减少环境污染,对实施无公害、绿色农业具有促进作用[6]。
马铃薯为茄科茄属一年生草本植物,粮菜兼用,营养全面,适应性广,是全球重要的粮食作物[7]。马铃薯是世界上最大的非谷物类食品。全球马铃薯种植面积大约为1 900万hm2,年产鲜薯重约3.3亿t[8]。近50年来,中国马铃薯的种植面积和总产量均迅速增长,至2013年,种植面积达277.5万hm2,是1961年的4.4倍;总产量达8 898.7万t,是1961年的6.9倍。1961—2013年,中国马铃薯的种植面积和总产量占世界的比重均显著增加5倍多,至 2013年,分别达到29.7%和24.2%[9]。目前中国已是世界第一大马铃薯生产国[8]。在2010年的两会上,提出了“确立马铃薯主粮地位、促进粮食增产、确保粮食安全”提案,马铃薯主粮化概念被正式提出,2015年农业部把马铃薯主粮化工作列入重要议程[10-11]。马铃薯主粮化不仅有助于推进种植业结构调整,实现农业可持续发展,保障我国粮食安全,而且有助于改善和丰富我国居民膳食营养结构。马铃薯是无性繁殖作物,其收获产物——块茎是其营养器官。马铃薯在种植过程中分为整薯种植和切块种植。我国大部分马铃薯种薯产区生产的种薯偏大,为节约用种量、降低成本,传统的马铃薯种植以种薯切块为主,具有单位面积植株密度较高、杂草较少的优点[12]。此外,切块种植还有较高密度、风险小、能够更好利用土地中营养物质和肥料,灌溉和其它投入小的特点,能够得到较高比例的中等薯块和较少的大薯块、降低生产成本[13-14]。但是带菌种薯是马铃薯病毒病、晚疫病、青枯病、环腐病等病害发生的初侵染源,而切块是传播的主要途径,薯切块质量直接影响马铃薯出苗率和壮苗[12,15]。在切块过程中,如果切块种薯没有经过消毒处理,伤口不能很快愈合、切面易感染细菌而腐烂,极易引起大量烂种,造成马铃薯品质和产量的下降。此外,切块种植后多数侧芽薯块不易出苗,造成田块缺苗较多,使产量受到一定影响[16]。据初步田间测定,一般切1刀病薯可传播20个以上的健薯,最多可达60个[17]。本试验以EM菌制剂对马铃薯种薯进行处理,采用解剖学及生理检测方法确定该制剂对马铃薯薯块的影响,从而研究EM菌制剂对马铃薯种薯的保护作用及生长发育的影响,以期获得一种能够有效提高马铃薯种薯保护作用的生物制剂,为进一步发展马铃薯种植产业,促进农民收入提供技术保障。
1 材料与方法
1.1 试验材料及试验设计
EM菌制剂:采用日本进口的EM菌制剂为试验用生物菌。马铃薯品种为:克新13号原种,由黑龙江省农业科学院提供。
表1EM菌制剂处理
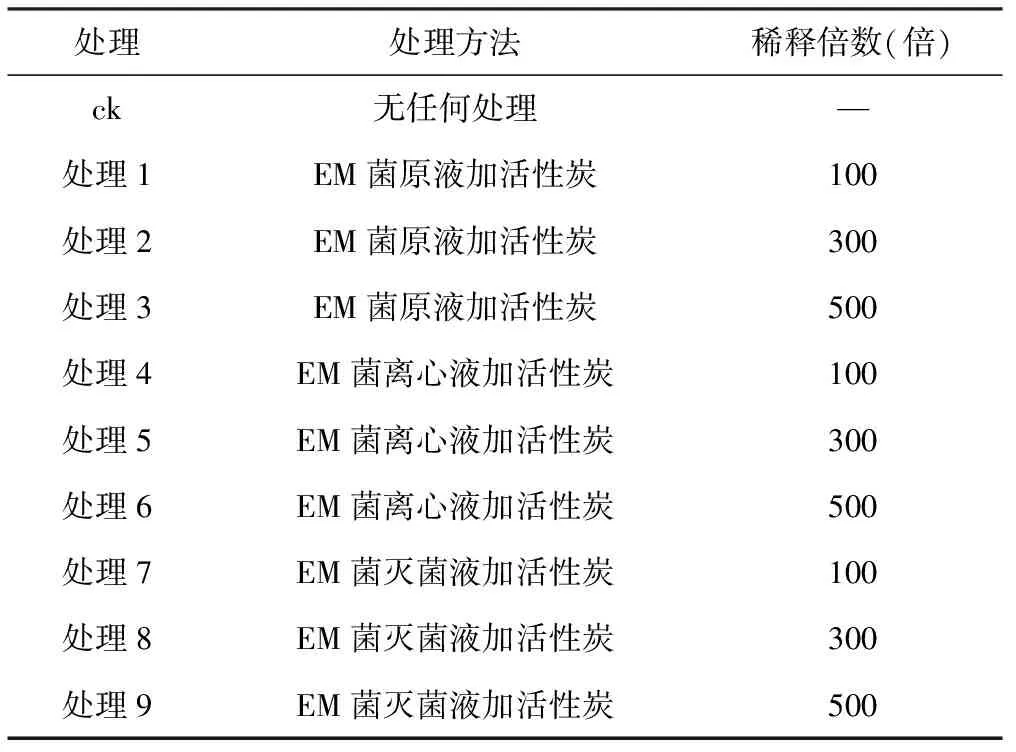
处理处理方法稀释倍数(倍)ck无任何处理—处理1EM菌原液加活性炭100处理2EM菌原液加活性炭300处理3EM菌原液加活性炭500处理4EM菌离心液加活性炭100处理5EM菌离心液加活性炭300处理6EM菌离心液加活性炭500处理7EM菌灭菌液加活性炭100处理8EM菌灭菌液加活性炭300处理9EM菌灭菌液加活性炭500
表2不同处理方法薯块细胞的破坏程度比较

处理方法侵染时间(d)0124ck细胞壁较薄且较完整细胞壁较薄且多数破裂细胞壁较薄且多数破裂细胞壁较厚且破裂处理2细胞壁较薄且较完整细胞壁较薄且少数破裂细胞壁较薄且多数破裂细胞壁较厚且破裂处理5细胞壁较薄且完整细胞壁较薄且完整细胞壁较薄且较完整细胞壁较薄且少数破裂处理8细胞壁较薄且较完整细胞壁较薄且少数破裂细胞壁较薄且多数破裂细胞壁较厚且破裂
将每个种薯分成2块,然后在切面上涂抹不同处理(见表1)的EM菌制剂及活性炭,采用9个处理,1个对照,每个处理15个种薯,设2个重复,晾晒后进行室内盆栽试验。
1.2 试验方法
1.2.1马铃薯薯块生根及发芽情况调查
室内进行马铃薯薯块生根及发芽情况的调查,选择普通大田土壤,无任何处理,在种植5,10 d时,每个处理随机挖出3个马铃薯薯块,调查马铃薯薯块的发芽数、不定根的数量。
1.2.2马铃薯薯块块茎组织学观察
根据马铃薯薯块发芽生根试验结果,对其中的处理1、处理5、处理8的种薯进行解剖学观察。种薯处理方法与1.2.1的方法相同,每组处理取3个大小均匀的马铃薯,分别在0 d(播种前)和播种后1,2,4 d时取样,先用自来水轻轻冲掉马铃薯块茎上基质,再用去离子水漂洗3次,用滤纸吸干块茎上的水分,去掉腐烂部分,切取切面内部组织,用FAA固定,进行石蜡切片处理后采用番红-固绿双染法对材料进行染色。用光学显微镜进行观察,并在视野中选择较为典型的结构,进行照相和记录保存。
1.2.3马铃薯种薯抗逆生理指标的测定
根据发芽生根试验结果,对其中的处理1、处理2、处理4、处理5、处理7、处理8的种薯进行生理指标的测定。种薯处理方法与1.2.1的方法相同,分别在种植前12 h、1 d、2 d、4 d、7 d时取样,先用自来水轻轻冲掉马铃薯薯块上基质,再用去离子水漂洗3次,用滤纸吸干块茎上的水分,去掉腐烂的部分,切取靠近外表面(切面)的内部组织,称重后立即放入液氮中冷却速冻后,置于-80 ℃冰箱保存。
本试验采用酶-蛋白联合测定法[18-20]测定SOD和POD活性,采用还原胶体几丁质法测定几丁质酶活性、DNS法测定β-1,3-葡聚糖酶活性。
1.3 数据分析方法
所有试验数据均采用办公软件Excel 2007进行处理,采用SPSS软件(LED法)和Excel 2007(TTEST检验)进行差异显著性检验。
2 结果与分析
2.1 EM菌制剂处理马铃薯薯块试验生根发芽情况调查
用不同EM菌制剂处理马铃薯薯块,对发芽、不定根的情况进行调查。采用9种处理,调查结果如图1所示,处理1、处理2、处理9发芽数随着种植时间的增加幅度小,趋势平缓与对照组相比没有差别,其他处理发芽数明显高于对照组,处理4、处理7发芽数增幅度高,EM菌稀释300倍与稀释500倍效果差别不大。由图2可看出,处理7、处理8、处理9不定根效果最好,不定根的数量极高,经过EM菌制剂灭菌处理种薯与EM菌离心液处理种薯,马铃薯发芽情况差别不大,但高于EM菌原液处理。说明EM菌处理对马铃薯种薯的生长有促进作用。综合几组处理的效果,筛选出较适宜的浓度,各种处理稀释100倍和稀释300倍。
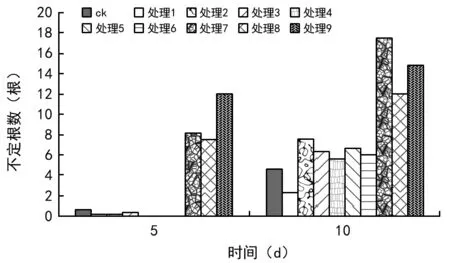
图2 不同处理马铃薯薯块试验不定根情况

注:1为正常薯块;2~3为ck,其中2为种植1 d,3为种植2 d;4~5表示处理2的薯块,其中4为种植1 d,5为种植2 d;6~7为处理5的的薯块,6为种植1 d,7为种植2 d;8~9为处理8的薯块,8为种植1 d,9为种植2 d。S表示淀粉粒; W表示细胞壁。图3 马铃薯种薯的细胞结构变化观察
2.2 马铃薯种薯的组织学观察
通过对发芽及不定根的试验筛选出适宜的稀释浓度,在这个浓度下,对不同EM菌制剂处理马铃薯种薯的解剖结构进行观察,结果如表2所示。结果表明,在相同的稀释倍数,采用3种不同的处理方法,种薯在种植过程中,其细胞结构的变化存在明显的差异,对照组在种植1 d时,细胞壁多数破裂(图3-1,3-2),除处理组5细胞壁依旧很完整(图3-4)外,其他处理组细胞壁较厚且少数破裂(图3-6,8)。随着种植时间的延长,在种植2 d时,除处理组2的细胞壁有少数破裂、处理5中细胞壁完整外,其他处理组细胞壁多数破裂(图3-3,5,7,9)。3种处理在种植初期都表现出对细胞结构完整性的保护,保护程度由高到低的顺序为EM菌制剂离心液、EM菌制剂原液及EM菌制剂灭菌,表明由不同EM菌制剂对马铃薯块茎的切口形成了保护,抵抗外界不良环境对马铃薯块茎的侵害,降低了土壤中微生物的侵入,从而保护了薯块的完整性。
2.3 马铃薯种薯中抗逆生理指标变化
2.3.1马铃薯块种薯中超氧化物歧化酶(SOD)活性的变化
根据发芽及不定根的试验结果,采用其中6种处理,2个对照,测定块茎中SOD活性,其块茎中酶的变化如图4所示。结果表明,在6组处理中,SOD活性区别不大,在种植0 d(种植前)时测定SOD活性,经过处理的马铃薯种薯活性均高于对照组,至12 h后SOD活性呈下降趋势,1 d后处理组高于对照组,呈上升趋势,在第4天时马铃薯块茎中SOD活性达到最大值,4 d后SOD活性呈下降趋势。处理5的SOD活性在第4天活性最强。稀释300倍的处理比稀释100倍的处理SOD的活性大。在4 d以后各组马铃薯块茎中的SOD活性开始下降到最低。结果表明,马铃薯种经EM菌制剂处理后,EM菌制剂中有益菌抵抗土壤中不良环境的作用,马铃薯块种薯的SOD活性快速上升而高于对照。
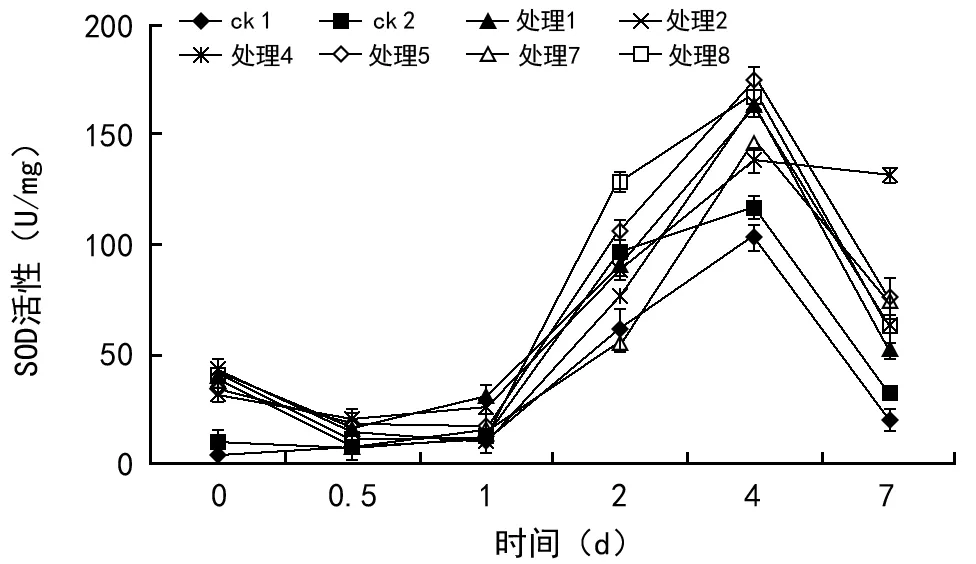
图4 不同处理马铃薯种薯中SOD活性的变化
2.3.2马铃薯种薯中过氧化氢酶(POD)活性的变化
POD是清除植物体内自由基的一种主要保护酶[14]。用EM菌制剂处理马铃薯种薯,马铃薯种薯中POD活性的变化如图5所示。由图5可以看出,6组处理中,马铃薯块茎中的POD活性在种植开始0 d至12 h时呈下降趋势,1 d后块茎中POD活性开始增加,到第4天达最高活性,4 d以后活性开始下降。经EM菌制剂处理的马铃薯种薯中POD的活性高于对照组,处理5的POD活性值在第4天最高,其次是处理7的活性,但处理1、处理2与对照组区别不大。由此可见,经EM菌制剂处理后马铃薯块茎抗病性增强。
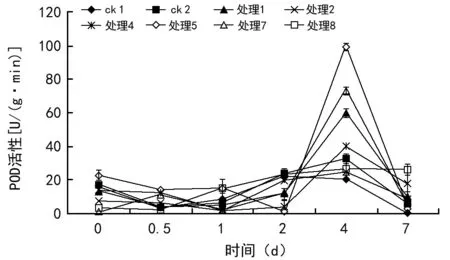
图5 不同处理马铃薯块种薯POD活性的变化
2.3.3马铃薯块种薯细胞壁水解酶活性的变化
对不同EM菌制剂处理马铃薯种薯块茎中几丁质酶活性和β-1,3-葡聚糖酶活性进行测定,结果如图6所示。从开始种植0 h,对照组几丁质酶的活性低于经EM菌制剂处理组,其活性没有明显的变化,几丁质酶是细胞壁水解酶的一种,可以分解真菌的细胞壁,阻止其生长繁殖,保护植株,是防御酶的一种,但种薯中,几丁质酶的含量低,其活性很弱,没有明显的差别,波动平缓。经EM菌制剂处理几丁质酶的活性有一定幅度的增加,在4 d时,几丁质酶活性最强,4 d后活性开始降低。

图6 不同处理马铃薯种薯中几丁质酶的变化
经不同EM菌制剂处理的马铃薯种薯中β-1,3葡聚糖酶的活性如图7所示,从种植前0 d至12 h,由于环境的影响,酶的活性呈下降趋势,而对照组中酶活性变化小,活性下降后波动较小,没有明显的增幅度,且低于处理组,处理5在第4天时酶活性达到最大,4 d后,酶活性开始下降。经EM菌制剂处理后,马铃薯种薯中细胞壁水解酶的活性增强,加强了马铃薯种薯抵抗真菌病害的能力。
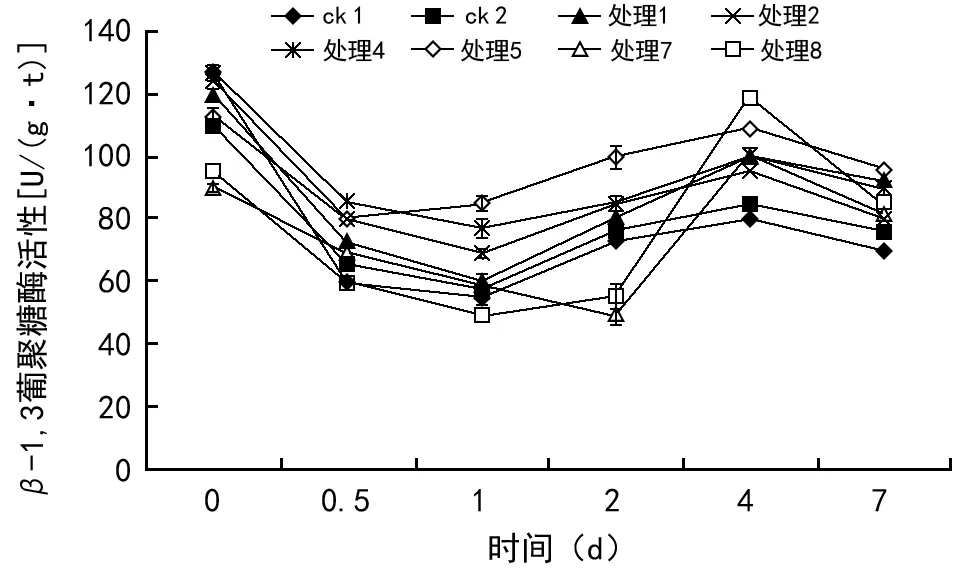
图7 不同处理马铃薯种薯中β-1,3葡聚糖酶的变化
3 讨 论
段玉云等研究表明,对切块种薯喷施EM菌制剂后,在切块表面、芽眼、根毛着生处等周围会形成一层高浓度的EM保护层,EM菌制剂中的有益微生物类群在这些部位进行繁殖形成优势菌群,在马铃薯前期生长过程中这些优势菌群能够抑制种薯内、土壤中有害菌的生长繁殖。其中乳酸菌与放线菌生长过程中分别可产生乳酸和抗菌物质,具有极强的杀菌能力,更能有效防止有害微生物从薯块切面和幼芽、幼根处侵入,从早期就降低种薯感染花叶病、环腐病等的概率[21]。杜巍等采用大区对比法在马铃薯苗期叶面用艾米乐(一种新型复合微生物制剂,即EM菌肥)喷施和灌根,发现无论是喷施还是灌根增产和淀粉含量提高效果都极显著,且灌根比喷施效果好[22]。绿色无残留物的微生物种衣剂是目前研究的重点,本试验采用9种不同的EM菌制剂处理马铃薯种薯,然后进行种植,调查马铃薯种薯生根发芽情况,筛选适宜的浓度,试验结果表明,有6种不同的EM菌制剂对马铃薯种薯处理效果较好,稀释浓度为100倍、300倍。选择其中1种浓度的不同EM菌制剂(稀释300倍)对马铃薯种薯进行处理,调查对马铃薯薯块的保护作用。结果表明,EM菌制剂保护了马铃薯块茎内部细胞结构的完整性,抵抗了真菌的侵染,防止马铃薯种薯内营养物质的流失。EM菌制剂离心液上清液稀释300倍的保护程度最高,EM菌原液稀释液其次,最后为EM菌制剂灭菌液。
经过处理的马铃薯薯块中抗逆生理指标SOD、POD的测定结果显示,马铃薯种薯经EM菌制剂处理后2种酶的活性明显升高且高于对照组,说明EM菌制剂对马铃薯有一定的保护作用。SOD、POD属于抗氧化酶,能够分解马铃薯种薯中氧化因子,抵抗外界不良环境对马铃薯的影响,防止马铃薯快速氧化,减缓植株衰老,延长生命发育期。几丁质酶和β-1,3-葡聚糖酶都属于细胞壁水解酶,而几丁质和β-1,3-葡聚糖是有害病原菌细胞壁的主要成分,如真菌。因此几丁质酶和β-1,3-葡聚糖酶能够分解病原菌的细胞壁,破坏其活性,阻止其繁殖,提高种薯的抗病性。β-1,3-葡聚糖酶和几丁质酶还具有协同作用,比单种酶抑菌能力更强[23]。当马铃薯种薯处在逆境环境中,种薯中的抗逆酶开始作用,对种薯形成保护。种薯中的抗氧化酶、细胞壁水解酶都会随着时间、环境的不同,表现出不同的活性。不同品种的抗逆酶活性不同,本试验中,供试的马铃薯种薯酶活性较低,但经EM菌制剂处理后,马铃薯块茎中各种的酶的活性均有提高,高于对照组。EM菌制剂增强了马铃薯的抗逆性,有效地预防了病菌的侵染,起到了保护种薯的作用。

