三峡水库消落区周期性水淹对狗牙根非结构性碳水化合物积累与分配的影响
张立冬,李 新,秦洪文,郝艳龙,刘正学,*
(1.重庆三峡学院 环境与化学工程学院/三峡库区水环境演变与污染防治重庆高校市级重点实验室,重庆 404100;2.重庆市万州区生态环境监测站,重庆 404100;3.重庆三峡学院 生命科学与工程学院,重庆 404100)
水淹是人工或自然湿地植物常常面临的环境胁迫之一。水淹导致植物碳水化合物消耗增加、合成减少[1-2],储备的碳水化合物主要被用于能量供给、形态结构及生理生化水平调整等,进而抵御水淹胁迫维系植物生存[3-4]。研究发现非结构性碳水化合物积累(存量)水平与植株水淹胁迫耐受性呈正相关,且湿地水文节律(水淹周期、时长等)能改变植株非结构性碳水化合物分配模式[5-7]。
三峡水库不同于一般大型水库,根据“蓄清排洪”水位调度原则,水库水位实行与原自然消落区水位消涨节律相反的“冬蓄夏泄”调度方案,在风浪线177 m(正常蓄水位175 m+2 m)至防洪限制水位145 m之间形成新的退化生态系统——水库消落区,具有水位落差大(0~30 m)、持续时间长(一般5~6个月,甚至可达9个月)、反季节性淹没(11月至翌年5月)及洪汛不定期淹没等特征。在这种极端“人工-自然”二元干扰作用下,狗牙根[Cynodon dactylon(Linn.)Pers.]、牛鞭草(Hemarthria altissima)等消落区适宜植物非结构性碳水化合物积累与分配行为如何变化已逐渐引起人们的重视,但目前仅局限在模拟水淹研究水平[8-10],而在实际消落区周期性水淹研究鲜有报道。
因此,本文以三峡水库消落区具有典型代表性的适宜多年生草本植物——狗牙根[Cynodon dactylon(Linn.)Pers.]为研究对象,在海拔高程151~152 m上,对不同年限适应株根、地上茎、匍匐茎和叶非结构性碳水化合物(NSC)净增长量以及其他相关指标进行测定,分析周期性水淹胁迫对狗牙根NSC积累与分配的影响,进而探索狗牙根对周期性水淹胁迫的适应策略。
1 材料与方法
1.1 试验样地概况及材料
试验样地位于重庆市万州区陈家坝晒网村晒网坝 (108°26′52″E,30°49′48″N),为典型消落区滩涂地,海拔151~152 m。自三峡水库建成来,一般情况下该区域每年9月至翌年5月处于淹没状态,部分年份由于夏季洪汛导致成陆期间遭受二次淹没或提前淹没。其自然植被主要物种分别为狗牙根、丁香蓼、水蓼、牛筋草、鳢肠、鬼针草、牛毛毡、露珠珍珠菜、萱草、香附子、泽泻、稗和李氏禾,整体区域狗牙根数量较低[11]。2013-2015年成陆期,每年6月分别将狗牙根种子(水利部中国科学院水工程生态研究所馈赠)按不同区域进行撒播,进而得到经历一次水淹、两次水淹及三次水淹适应株。
1.2 样品采集及生长相关指标测定
2016年5月,待样地露出水面,按出水5 d(植株处于泥水淤积状态)、10 d,20 d,30 d,40 d和50 d后分别对两年适应株(经历两次水淹)、三年适应株(经历三次水淹)、多年适应株(本地自然生长狗牙根)及对照株(180 m左右自然生长狗牙根)地上茎高及最长叶长进行测量。按Arndt[12]等的方法采集植株样品,置于冰盒保存,带回试验室。一年适应株由于泥沙淤积未取得样品。
1.3 总光合色素与非结构性碳水化合物含量测定
参照秦洪文等[13]的方法,将叶片尽数取下,混合并精确称取1 g新鲜叶片,采用80%丙酮浸提法测定总光合色素含量;不同年限适应株根、地上茎、匍匐茎及叶样品,先后用自来水和去离子水清洗干净,100℃烘箱内杀青5 min,80℃烘干至恒质量,采用蒽酮比色法测定可溶性糖含量及淀粉含量[13]。NSC含量为可溶性糖含量与淀粉含量之和,NSC净增长量为不同测量点NSC含量与出水5 d时含量之差。
1.4 数据分析与处理
统计分析软件SPSS 20.0用于实验数据的处理与分析。采用单因素方差分析法(one-way ANOVA)对不同年限适应株恢复生长期间地上茎高、叶长、NSC净增长量变化进行分析,并用Duncan多重比较判断不同年限适应株之间差异性。P<0.05为差异显著,P<0.01为差异极显著;绘图采用Origin 8.0软件完成。所有数据以平均值±标准误形式表示。
2 结果与分析
2.1 周期性水淹对狗牙根地上茎高及叶长的影响
当水位降至海拔约150 m后,分别对出水5 d,10 d,20 d,30 d,40 d和50 d不同年限狗牙根适应株地上茎高进行测量,结果见图1(a)。从不同年限适应株地上茎高变化趋势看,不同测量点地上茎高均无显著性变化;与对照相比,在出水20 d和30 d时,消落区不同年限适应株地上茎高显著低于对照株,而在其他测量时间无显著性差异,但平均地上茎高均小于对照(表1)。恢复生长期间不同年限适应株叶片显著性增长,见图1(b)。与对照相比,在不同测量点不同年限适应株最长叶长均显著低于对照株。
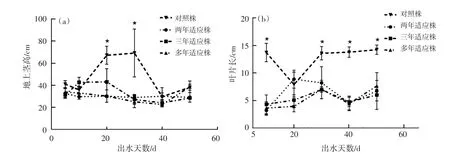
图1 恢复生长期不同适应年限狗牙根适应株地上茎高及叶长变化Fig.1 The changes of aerial stem and leaf length of Cynodon dactylon(Linn.)Pers.with different years in period of recovery

表1 恢复生长期不同适应年限狗牙根适应株地上茎高变化Table 1 The aerial stem length changes Cynodon dactylon(Linn.)Pers.with different years in period of recovery
2.2 周期性水淹对狗牙根叶片数及总叶绿素含量的影响
经过50 d恢复生长,不同年限适应株叶片数呈先增加后降低变化趋势,见图2(a)。出水10 d时,不同年限适应株叶片数均显著大于对照株;出水20 d时,三年适应株及多年适应株叶片数总体大于两年适应株及对照株;出水30 d,40 d,50 d时,不同年限适应株叶片数与对照株相比无显著性差异。

图2 恢复生长期不同年限狗牙根适应株叶片数及总叶绿素含量变化Fig.2 The changes of leaf numbers and total chlorophyll content Cynodon dactylon(Linn.)Pers.with different years in period of recovery
不同年限适应株总叶绿素含量呈先增加后降低趋势,见图2(b)。出水30 d时,多年适应株达到4.71 mg/g,显著高于两年及三年适应株;出水50 d时,两年、三年、多年适应株总叶绿素含量分别为1.75 mg/g,2.4 mg/g和2.1 mg/g,不同年限适应株之间无显著性差异。对照区狗牙根总叶绿素含量呈先增加后降低再增加趋势。10 d,20 d时,显著低于不同年限适应株;30 d时显著高于两年适应株,低于多年适应株,与三年适应株无显著性差异;40 d时,与两年及三年适应株差异不显著,显著性低于多年适应株;50 d时显著高于不同年限适应株。
2.3 周期性水淹对狗牙根非结构性碳水化合物积累的影响
经过50 d恢复生长,不同年限适应株各组织NSC净增长量变化如图3所示。两年适应株及三年适应株根NSC净增长量呈先增加后降低趋势,出水50 d时与出水5 d时无显著性差异。多年适应株根NSC净增长量呈先增加后降低再增加趋势。对照株根NSC净增长量呈先降低后增加趋势,且在20~50 d测量期间无显著性变化[图3(a)]。结果表明,两年及三年适应株根测量期间无显著性NSC积累,多年适应株根则积累了大量NSC。
两年适应株地上茎NSC净增长量呈先增加后降低再增加趋势,出水50 d时显著大于出水5 d时。三年适应株地上茎NSC净增长量呈先增加后降低趋势,出水40 d和50 d呈负增长。多年生地上茎NSC净增长量呈先增加后降低再增加趋势,且测量期间总体显著性大于对照[图3(b)]。结果表明,两年及多年适应株地上茎测量期间积累了一定量NSC,且多年适应株积累量显著大于两年适应株,而三年适应地上茎NSC无显著积累。
两年适应株及三年适应株匍匐茎NSC净增长量呈先增加后降低趋势,且不同测量点均呈正增长;多年适应株匍匐茎NSC净增长量呈先增加后降低趋势,不同测量点均呈正增长。对照株匍匐茎NSC净增长量呈逐渐增长趋势[图3(c)]。结果表明,不同年限适应株匍匐茎测量期间均积累了一定量NSC。
不同年限适应株叶NSC净增长量均呈先增加后降低趋势,三年及多年适应株测量期间各测量点均呈正增长,而两年适应株出水50 d时呈负增长。对照株叶NSC净增长量在测量期间呈正增长,且在10~50 d测量期间总体无显著性变化[图3(d)]。结果表明,三年及多年适应株叶测量期间积累了一定量NSC,而两年适应株则无显著性积累。

图3 恢复生长期NSC净增长量变化Fig.3 The changes of net growth of non-structure carbohydrate content in period of recovery
2.4 周期性水淹对狗牙根非结构性碳水化合物分配的影响
50 d恢复生长期间,两年及三年适应株各组织NSC净增长量总体呈先增加后降低趋势,且匍匐茎净增长量总体大于根、地上茎和叶[图4(a,b)]。多年生适应株根、地上茎和匍匐茎呈先增加后降低再增加趋势,叶NSC净增长量总体呈先增加后降低的趋势,匍匐茎净增长量总体显著大于根、地上茎和叶[图4(c)]。对照根NSC净增长量总体上大于地上茎、匍匐茎和叶[图4(d)]。结果表明,周期性水淹能改变狗牙根NSC分配模式,由分配至根中储存改变为分配至匍匐茎进行储存。

图4 恢复生长期不同年限适应株不同组织NSC分配变化Fig.4 The change allocation of non-structure carbohydrate in different tissue adapted to different growth years
3 讨论
经过50 d恢复性生长,不同年限狗牙根适应株均表现出一定程度NSC积累(图3)。大量NSC积累必然导致植株生长及储存投入减少[14],恢复生长期间不同年限狗牙根适应株地上茎及叶长无显著性伸长生长,且平均地上茎高均小于正常生长植株(图1A,表1),与Liao等[15]的研究结果一致,狗牙根经长时间水淹后,恢复生长期间地上茎无显著伸长生长。中华蚊母(Distylium chinense)同样表现出类似现象,水淹后经60 d恢复生长主干长度无显著性变化[15-16]。
恢复生长初期植株将有限的储能物质用于新生叶的快速生长以获得额外碳输入[9]。不同年限适应株出水后,叶片数及总叶绿素含量均快速增加,而出水20 d后与出水30 d后,不同年限适应株叶片数及总叶绿素含量均呈下降趋势(图2)。叶绿素含量速降意味着叶片趋于衰老[17];与恢复生长20 d时相比,40 d时两年、三年、多年适应株叶片数分别下降了20,60,45,而对照50 d恢复生长期间叶片数无显著性变化,说明恢复生长期间不同年限适应株新生叶寿命较短。有研究表明短叶寿命使得植株可快速获得大量额外碳输入并降低叶片暗呼吸消耗[18-20],进而增强库组织NSC积累:5~20 d恢复生长期间,不同年限适应株各组织NSC净增长量快速增加[图3(a)-(c)]。随着叶片数及总叶绿素含量的降低,两年及三年适应株各组织NSC净增长量总体呈下降趋势,而多年适应株根、地上茎和匍匐茎呈先下降再上升变化,且净增长量分别显著高于两年适应株、三年适应株和对照株(图2,3),其可能原因是:(1)多年适应株出水30 d仍维持极高数量叶片数及总叶绿素含量,为植株提供了高于两年及三年适应株的碳输入;(2)较短叶长进一步降低暗呼吸损耗;(3)多年适应株经多年适应性生长可提前储备NSC以适应消落区不定期提前水淹,深层次原因有待进一步研究。
植株水平碳分配受多种生物或非生物因子的影响[21-22]。草食动物取食则降低植物根部光合同化产物含量,进而抑制植株通过根茎再生[21];干旱、短期水淹,光合同化产物倾向于分配至根部进行存储[23-24];紫外辐射亦增强光合同化产物从源向库流动[25];盐胁迫则引起甘露醇合成量上升,而蔗糖、淀粉含量则降低,进而提高植株对盐胁迫忍受能力[26]。Liao等[15]研究发现,水淹胁迫同样影响植株恢复生长期碳分配,牛鞭草茎部生物量积累显著增强。本研究中,狗牙根种子经过撒播形成植株并经历不同次数周期性水淹后,其恢复生长50 d内不同年限适应株NSC净增长量分配模式与正常生长植株(对照株)存在显著差异,尤其是多年适应株分配差异更为显著(图4),表明周期性水淹显著影响狗牙根植株NSC水平分配,增强匍匐茎NSC积累,为植株应对再次水淹提供必要的物质储备。
综上所述,植物应对水淹胁迫时,可主要采取以下3种策略:(1)通过形态解剖结构及生理生化水平调整——“逃避”[27];(2)通过抑制不定根、通气组织、茎延伸等以降低储能物质消耗——“静默”[2,9];(3)通过积累大量NSC增强水淹耐受性[28-29]。狗牙根作为三峡水库消落区适宜多年生草本植物不仅可通过“静默”策略降低储能物质消耗[10],而且经周期性水淹胁迫后,一方面恢复生长期呈一定程度的NSC积累,尤其是经过多年适应性生长植株积累量显著高于正常生长植株;另一方面,恢复生长期NSC分配模式亦发生改变。表明周期性水淹不仅诱导狗牙根积累大量NSC,同时改变了植株NSC水平分配模式。
[1]PANDA D,SHARMA S G,SARKAR R K.Chlorophyll fluorescence parameters,CO2,photosynthetic rate and regeneration capacity as a result of complete submergence and subsequent re-emergence in rice(Oryza sativaL.)[J].Aquatic Botany,2008,88(2):127-133.
[2]BAILEY-SERRES J,VOESENEK L A.Flooding stress:Acclimations and genetic diversity[J].Annual Review of Plant Biology,2008,59:313-339.
[3]BLOM C W,VOESENEK L C.Flooding:The survival strategies of plants[J].Trends in Ecology&Evolution,1996,11(7):290-295.
[4]STRIKER G G,IZAGUIRRE R F,MANZUR M E,et al.Different strategies ofLotus japonicus,L.corniculatusandL.tenuisto deal with complete submergence at seedling stage[J].Plant Biology,2012,14:50-55.
[5]谭胤静,于一尊,丁建南,等.鄱阳湖水文过程对湿地生物的节制作用[J].湖泊科学,2015,27(6):997-1003.
[6]苏晓磊,曾波,乔普,等.冬季水淹对秋华柳的开花物候及繁殖分配的影响[J].生态学报,2010,30(10):2585-2592.
[7]MEGONIGALJ P,DAY F P.Effects of flooding on root and shoot production of bald cypress in large experimental enclosures[J].Ecology,1992,73(4):1182-1193.
[8]曾成城,王振夏,陈锦平,等.不同水分处理对狗牙根种内相互作用的影响[J].生态学报,2016,36(3):696-704.
[9]LUO F L,NAGEL K A,SCHARR H,et al.Recovery dynamics of growth,photosynthesis and carbohydrate accumulation after de-submergence:a comparison between two wetland plants showing escape and quiescence strategies[J].Annals of Botany,2011,107(1):49-63.
[10]TAN S D,ZHU M Y,ZHANG Q F.Physiological responses of bermudagrass(Cynodon dactylon)to submergence[J].Acta Physiologiae Plantarum,2010,32(1):133-140.
[11]高芳,秦洪文,刘正学,等.适应三峡水库晒网坝消落区环境的优势物种初探[J].三峡生态环境监测,2017,2(1):52-57.
[12]ARNDT S K,WANEL W,CLIFFORD S C,et al.Contrasting adaptationstodroughtstressin field-grownZiziphus mauritianaandPrunus persicatree:water relations,osmotic adjustment and carbon isotope composition[J].Functional Plant Biology,2000,27(11):985-996.
[13]秦洪文,刘正学,周大祥,等.中华蚊母对反季节完全水淹的生理响应[J].河南农业科学,2012,41(11):126-128.
[14]PALACIO S,HOCH G,SALA A,et al.Does carbon storage limit tree growth?[J].New Phytologist,2014,201(4):1096-1100.
[15]LIAO J X,JIANG M X,LI L F.Effects of simulated submergence on survival and recovery growth of three species in water fluctuation zone of the Three Gorges Reservoir[J].Acta Ecologica Sinica,2010,30(4):216-220.
[16]LI X L,LUAN C Y,YANG J,et al.Survival and recovery growth of riparian plantDistylium chinenseseedlings to complete submergence in the Three Gorges Reservoir region[J].Procedia Engineering,2012,28:85-94.
[17]沈文飚,叶茂炳,张荣铣.小麦旗叶自然衰老过程中清除活性氧能力的变化[J].植物生态学报,1997,39(7):634-640.
[18]KIM H J,RYU H,HONG S H,et al.Cytokinin-mediated control of leaf longevity by AHK3 through phosphorylation of ARR2 inArabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(3):814-819.
[19]NAVAS M L,DUCOUT B,ROUMET C,et al.Leaf life span,dynamics and construction cost of species from Mediterranean old-fields differing in successional status[J].New Phytologist,2003,159:213-228.
[20]REICH P B,WALTERS M B,ELLSWORTH D S,et al.Relationships of leaf dark respiration to leaf nitrogen,specific leaf area and leaf life-span:A Test across biomes and functional groups[J].Oecologia,1998,114(4):471-482.
[21]MACHADO R A,FERRIEERI A P,ROBERT C A,et al.Leaf-herbivore attack reduces carbon reserves and regrowth from the roots via jasmonate and auxin signaling[J].New Phytologist,2013,200(4):1234-1246.
[22]XU Z Z,ZHOU G S.Effects of water stress and nocturnal temperature on carbon allocation in the perennial grass,Leymus chinensis[J].Physiologia Plantarum,2005,123:272-280.
[23]HASIBEDER R,FUCHSLUEGER L,RICHTER A,et al.Summer drought alters carbon allocation to roots and root respiration in mountain grassland[J].New Phytologist,2015,205(3):1117-1127.
[24]SLEWINSKI T L.Non-structural carbohydrate partitioning in grass stems:A target to increase yield stability,stress tolerance,and biofuel production[J].Journal of Experimental Botany,2012,63(13):4647-4670.
[25]VIDOCIĆM,MORINA F,MILIĆS,et al.Carbon allocation from source to sink leaf tissue in relation to flavonoid biosynthesis in variegatedPelargonium zonaleunder UV-B radiation and high PAR intensity[J].Plant Physiology and Biochemistry,2015,93:44-55.
[26]EVERARD J D,GUCCI R,KANN S C,et al.Gas exchange and carbon partitioning in the leaves of celery(ApiumgraveolensL.)at various levels of root zone salinity[J].Plant Physiology,1994,106(1):281-292.
[27]谭淑端,朱明勇,张克荣,等.植物对水淹胁迫的响应与适应[J].生态学杂志,2009,28(9):1871-1877.
[28]PANDA D,SARKAR R K.Mechanism associated with nonstructural carbohydrate accumulation in submergence tolerant rice(Oryza sativa,L.)cultivars[J].Journal of Plant Interactions,2014,9(1):62-68.
[29]谭淑端,朱明勇,张克荣,等.水淹对双穗雀稗抗氧化酶活性及碳水化合物含量的影响[J].草业学报,2013,22(1):217-224.

