定志小丸调控氧化还原系统干预5-羟色胺水平的研究
张天艺,董宪喆,冯 霞,朱维煜,胡 园,刘 屏(.解放军总医院临床药理药学研究室,北京 0085;2.北京中医药
大学中药学院,北京 100029;3.总参第六十一研究所门诊部,北京 100041)
抑郁症是以显著而持久的心境低落为主要特征的心境障碍类型,据世界卫生组织最新数据显示,全世界抑郁症患病率约为11%[1]。从情绪消沉到出现幻觉,甚至可能会影响患者行为,导致自杀倾向。抑郁症具有发病率高、易被患者忽视、易复发、逐渐低龄化等特点,其对患者的危害性逐渐增大,不容忽视。
定志小丸始载于唐代孙思邈所著的《备急千金要方》,由人参、茯苓、远志、菖蒲按照3 : 3 : 2 : 2的配比组成,主治“心气不定,五脏不足,甚者忧愁悲伤不乐,忽忽喜忘,朝愈暮剧,或暮愈朝发狂眩”。定志小丸主治之情志类疾病的描述符合西医中抑郁症持续性心境低落,思维缓慢,兴趣感缺乏等心境障碍的表现。已有研究发现,定志小丸可显著增加抑郁动物海马中脑源性神经营养因子(brain derived neurotrophic factor,BDNF)的含量,改善慢性不可预知性应激大鼠模型(chronic unpredictable mild stress,CUMS)的抑郁样行为,升高大鼠脑内5-羟色胺(5-hydroxytryptamine,5-HT)水平,具有明显的抗抑郁作用[2-4]。
本研究于前期研究基础上[5-6],建立过氧化氢损伤的SH-SY5Y细胞、C6细胞和大鼠原代海马神经细胞三种细胞损伤模型,观察实验组、模型组和不同浓度定志小丸组的MDA、ROS、SOD、CAT相关氧化应激反应指标的变化,研究定志小丸的抗氧化作用。同时根据Willner的方法[7]建立CUMS模型,观察定志小丸灌胃前后大鼠海马内5-HT水平,结合大鼠海马和血清中氧化应激反应指标SOD和MDA的活性,研究定志小丸对动物脑内氧化应激水平及与5-HT系统的作用,探讨定志小丸对5-HT系统和氧化应激系统的调控机制,为进一步研究定志小丸抗氧化作用机制提供一定的基础。
1 材料
1.1 细胞株
SH-SY5Y细胞株(中国医学科学院药用植物研究所毕明刚教授惠赠);C6细胞株(购置于南京凯基生物技术有限公司)。
1.2 实验动物
新生48 h内SD大鼠30只及40只180 ~ 220 g健康雄性SPF级SD大鼠(由解放军总医院实验动物中心提供)。实验动物质量合格证号:SCXX(京)2011-0004,饲养于无特定病原体(specific pathogen free,SPF)环境中。
1.3 实验仪器
MCO-15AC型CO2培养箱(Sanyo公司);XD-101型倒置显微镜(Olympus公司);超净工作台(江苏吴县市净化技术研究所);HY-2A数显调速多用振荡器(江苏省金坛市荣华仪器制造有限公司);SE1501F电子天平(奥豪斯仪器有限公司);Anymaze动物行为学视频分析系统(上海软隆科技发展有限公司)。
1.4 主要试剂
人参、远志、茯苓、石菖蒲(北京同仁堂药材有限责任公司);定志小丸提取物0.21 g干粉/g生药(中国中医科学院中药研究所制剂中心提供,批号20160930);盐酸氟西汀胶囊(规格:20 mg,批号:7322B,法国PATHEON公司);DMEM(GIBCO公司);胎牛血清(GIBCO公司);胰蛋白酶(Hyclone公司);NaHCO3分析纯、多聚赖氨酸(Sigma公司);5-HT检测试剂盒(上海蓝基生物科技有限公司);CAT测试盒、MDA测试盒、SOD测试盒、ROS测试盒(南京建成生物工程研究所)。
2 方法
2.1 过氧化氢损伤细胞模型的建立
用DMEM培养液分别调整SY5Y细胞和C6细胞密度为1×105个·mL-1,以80 μL/孔接种于96孔板,培养24 h后,模型组和对照组加入10 μL蒸馏水,4个定志小丸组分别加入10 μL的不同浓度(10 μg·mL-1,100 μg·mL-1,200 μg·mL-1,500 μg·mL-1)定志小丸液,再加入含10 μL浓度为100 μmol·L-1过氧化氢损伤剂,36 h后终止培养,每组设5个复孔;将96孔板中的大鼠原代海马神经元细胞做相似处理。
2.2 慢性不可预知性应激大鼠模型的建立
SD大鼠适应环境3 d后采用体重、旷场和糖水偏嗜度综合评分。选取评分相近的大鼠随机分组,每组8只。将40只SD大鼠分为5组,即正常组、模型组、氟西汀组(4 mg·mL-1)、定志小丸低剂量组(150 mg·mL-1)、定志小丸中剂量组(300 mg·mL-1)和定志小丸高剂量组(600 mg·mL-1)。除正常组每笼4只饲养, 不给予任何刺激外,其余各组均每笼1只孤养,每天给予不同刺激,包括45度角倾斜12 h,冷水(10 ℃)游泳5 min,禁食24 h,震荡5 min,照明24 h,束缚2 h,禁水24 h,顺序随机。刺激28 d后评价各组大鼠旷场得分和糖水偏嗜度,除正常组外其余各组继续刺激,同时各给药组连续灌胃给药28 d,按5 mL·kg-1大鼠的体积给药,正常组和模型组给予同等体积的蒸馏水。末次给药后检测糖水偏嗜度和旷场得分。
2.3 糖水偏嗜度测试
造模前后和给药后第1天测试各组大鼠1%蔗糖水消耗量。测试前给予每只大鼠两瓶糖水适应24 h,然后把两瓶糖水换成两瓶自来水适应24 h,禁水12 h后,给予每只大鼠一瓶糖水和一瓶自来水,测定每只大鼠1 h的1%蔗糖水摄入百分比,即1%蔗糖水摄入百分比=糖水消耗量/(糖水消耗量+自来水消耗量)×100%。
2.4 Open-f i led法测试
实验装置为立方形敞箱,高40 cm,长宽均为80 cm,周壁、底面为黑色,底面由面积相等的25个方块组成,用白线划分。实验时将大鼠置于敞箱右上方方格内,观察大鼠在5 min内穿越底面块数(四爪均进入的方格方可记数)的水平活动(crossing)得分,以及后肢直立次数(两前爪腾空或攀附墙壁)的垂直活动(rearing)得分,二者之和为总得分。
2.5 MDA、ROS、SOD、CAT、5-HT测定
将给药后的大鼠用10%的水合氯醛麻醉后,腹主动脉取血分离出血清,并断头取脑剥离出海马,精密称重,按重量(g):体积(mL)=1 : 9的比例加入9倍体积生理盐水,剪碎组织,冰水浴制备匀浆,3000 r·min-1离心10 min,取上清待用。
将培养好的细胞收集到EP管中,1000 r·min-1离心10 min弃上清,留沉淀细胞,再加入1 mL PBS轻轻吹打,再次以相同条件离心弃上清,留沉淀细胞加入一定量(106的细胞一般加0.3 ~ 0.5 mL)的生理盐水,用超声破碎仪,功率300 W,冰水浴,每3 ~ 5 s超声一次,间隔4次(每次间隔时间为30 s左右)。
上述样品准备好后,按照试剂盒说明书的步骤,用比色法检测SOD活性、MDA含量、ROS含量、CAT活性,用ELISA法检测5-HT含量。
2.6 统计学方法
3 结果
3.1 定志小丸对CUMS大鼠行为学的影响
连续灌胃给药4周后,与正常组相比,模型组大鼠的体重、旷场总得分及糖水偏嗜度明显下降(P<0.01)。与模型组相比,氟西汀组、定志小丸中剂量及高剂量组大鼠的体重、旷场总得分及糖水偏嗜度显著增加(P< 0.01);定志小丸低剂量组大鼠的体重也明显增加(P< 0.01),但旷场总得分和糖水偏嗜度无明显变化。详见表1、2、3。

表1 各组大鼠体重变化. g, n = 8Tab 1 Results of body weight in each group. g, n = 8
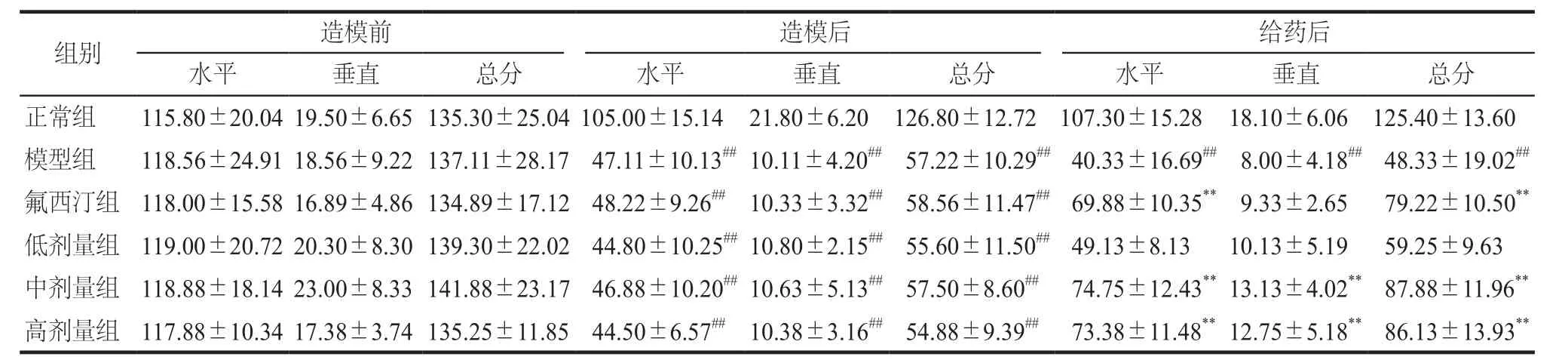
表2 各组大鼠旷场得分变化. n = 8Tab 2 Results of open-f i eld test in each group. n = 8
3.2 定志小丸对大鼠海马区5-HT水平的影响
连续灌胃给药4周后,与正常组相比,模型组大鼠海马内5-HT水平显著下降(P< 0.01);与模型组相比,氟西汀组、定志小丸中剂量组和高剂量组大鼠海马内5-HT水平显著升高(P< 0.01),定志小丸低剂量组没有明显变化。详见表4。
3.3 定志小丸对大鼠海马区及血清中MDA和SOD活性的影响
连续灌胃4周后,与正常组相比,模型组大鼠血清和海马中SOD显著下降(P< 0.01),MDA显著升高(P< 0.01)。与模型组相比,氟西汀组可显著增加大鼠血清和海马中SOD的活力(P< 0.05);定志小丸中剂量组和高剂量组均能显著增加大鼠血清和海马中SOD的活力(P< 0.01),显著降低MDA的含量(P<0.01);定志小丸低剂量组没有明显变化。详见表5。
3.4 定志小丸对过氧化氢损伤细胞模型内氧化还原系统的影响
实验结果如表1所示,定志小丸组除10 μg·mL-1组(DZ-10组)外,定志小丸100 μg·mL-1组(DZ-100组)、定志小丸200 μg·mL-1组(DZ-200组)及定志小丸500 μg·mL-1组(DZ-500组)与模型组相比,SY5Y细胞和原代大鼠海马神经元细胞中SOD和CAT的活性均显著升高(P< 0.01或P< 0.05),同时ROS和MDA的含量均降低或显著降低(P< 0.01或P< 0.05);在C6细胞中,定志小丸(除10 μg·mL-1组)也可显著升高SOD和CAT的活力(P< 0.01或P< 0.05),降低ROS和MDA的表达水平(P< 0.01或P< 0.05)。详见表6。

表3 各组大鼠糖水偏嗜度变化. n = 8Tab 3 Results of sucrose preference in each group. n = 8

表4 大鼠海马区5-HT的水平. ng·mL-1,n = 8Tab 4 The contents of 5-HT in the hippocampus of rats.ng·mL-1, n = 8
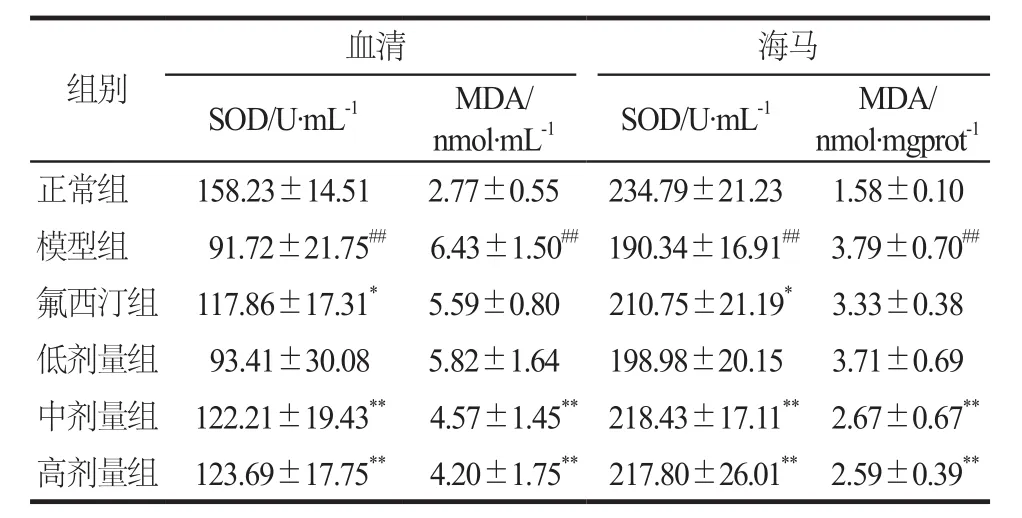
表5 大鼠海马及血清中SOD和MDA的含量. n = 8Tab 5 The contents of SOD and MDA in the hippocampus and serum of rats. n = 8
4 讨论
CUMS模型能较好地模拟临床中抑郁人群的症状,是较为成熟的抑郁模型[8]。糖水偏嗜度体现了动物对奖赏的反应程度,旷场水平活动反映动物的活动度,旷场垂直活动反映动物对新鲜环境的好奇程度,本实验结果显示,定志小丸中剂量组和高剂量组能明显升高旷场得分和糖水偏嗜度,从而提高抑郁大鼠的自主运动行为和对奖赏的反应程度。
5-羟色胺学说是Coppen等[9]于1965年首先提出,认为抑郁症的发生是由于中枢神经系统中5-HT功能下降,释放5-HT减少,突触间隙含量下降。选择性5-HT再摄取抑制剂(如氟西汀)能抑制突触间隙对5-HT的重吸收,使5-HT含量增高。本实验结果表明,模型组大鼠海马区5-HT含量明显下降;给予定志小丸后,5-HT的含量显著升高,表明定志小丸可以显著促进CUMS模型大鼠海马中5-HT的表达。提示定志小丸可能是通过调节5-HT的含量起到一定的抗抑郁作用。
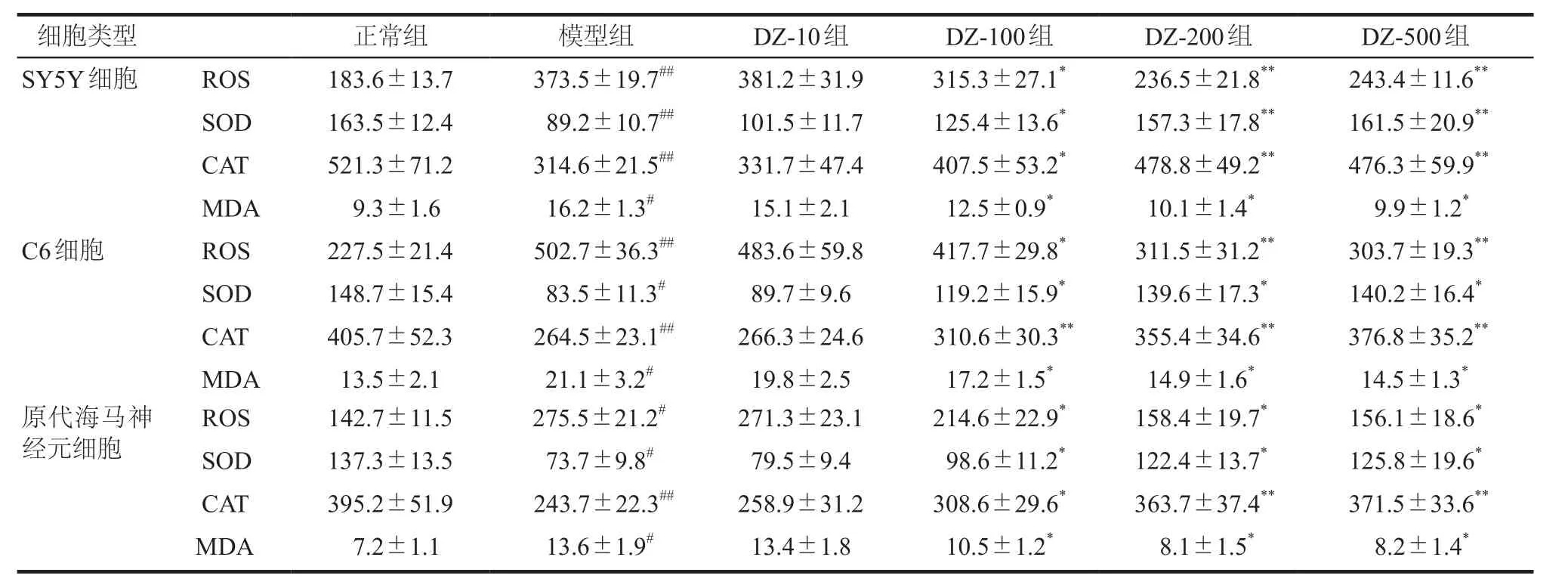
表6 定志小丸对过氧化氢损伤细胞模型内氧化还原系统的影响Tab 6 Effects of Dingzhi Xiaowan on oxidation-reduction system in the cell model damaged by hydrogen peroxide
氧化应激是指细胞暴露于高浓度氧分子或氧的化学衍生物而引起的细胞损伤。自由基作用于生物大分子,破坏细胞结构,导致一系列疾病的发生发展[10]。
有研究[11-12]显示,氧化应激产生的自由基可能在抑郁症的发病过程中起着重要作用。氧化应激是指包括活性氧和活性氮对机体造成的氧化损伤。当自由基产生过多或氧化-抗氧化系统出现故障时,未被清除的自由基在体内积聚,对机体导致损害作用,诱导细胞凋亡,破坏海马区及大脑皮层细胞,引发海马长时程突触可塑性异常[13-16],激活HPA轴,刺激糖皮质激素释放,提高机体对应激的适应性。长时间处于应激状态下,高水平的糖皮质激素或将损害海马区神经元细胞,造成HPA轴功能障碍[17],进而引发抑郁症状。Zafir等[18]报道,抑郁动物模型体内的酶类抗氧化物包括SOD、CAT、GST等活性及非酶类抗氧化物包括谷胱甘肽、葡萄糖和尿素含量都明显下降,脂质过氧化产物MDA的含量明显升高,而抗抑郁药物如氟西汀可明显逆转这种改变。
本实验结果表明,模型组大鼠海马和血清的SOD活性明显下降,MDA含量显著升高,给予定志小丸后能明显升高SOD水平,降低MDA含量。同时在过氧化氢诱导的多种细胞损伤模型中,定志小丸在100 ~500 μg·mL-1浓度范围内也可升高SOD和CAT的水平,降低ROS和MDA的含量。5-HT的水平和氧化应激反应与抑郁症关系密切,通过降低5-HT含量、抗氧化水平降低、氧自由基水平上调等途径参与了抑郁症的发病过程。有研究表明,ROS可以氧化损伤DNA,并且DNA损伤会升高细胞内ROS水平,进而引起氧化还原系统的失衡。5-HT系统产物褪黑素(melatonin,MT)可提高抗氧化酶活性,同时降低MDA水平,提高机体的抗氧化能力[19]。本实验结果表明定志小丸不仅能改善由过氧化氢诱导的多种细胞损伤模型以及CUMS模型大鼠的氧化还原系统,还可调节CUMS大鼠海马区5-HT的水平,说明定志小丸的抗抑郁机制可能与其抗氧化作用和调节5-HT水平有关。
[1] 景泉凯.电针对慢性应激抑郁大鼠脑海马磷酸二酯酶-4亚型表达的影响[D].北京:北京中医药大学,2017.
[2] Zhu Y, Duan X, Huang F,et al. Kai-Xin-San, a traditional Chinese medicine formula, induces neuronal differentiation of cultured PC12 cells: modulating neurotransmitter regulation enzymes and potentiating NGF inducing neurite outgrowth[J].J Ethnopharmacol, 2016, 193: 272-282.
[3] Hu Y, Zhou XJ, Liu P,et al. Antidepressant and neuroprotective effect of the Chinese herb kaixinsan against lentiviral shRNA knockdown brain-derived neurotrophic factor-induced injuryin vitroandin vivo[J]. Neuropsychobiology, 2014, 69(3): 129-139.
[4] Dong XZ, Li ZL, Zheng XL,et al. A representative for emotional disease, Ding-Zhi Xiao-Wan restores 5-HT system def i cit through interfering the synthesisand transshipment in chronic mild stressinduced depressive rats[J]. J Ethnopharmacol, 2013, 150(3):1053-1061.
[5] Hu Y, Liu M, Liu P,et al. Effect of kai xin san on learning and memory in a rat model of paradoxical sleep deprivation[J]. J Med Food, 2013, 16(4): 280-287.
[6] 刘婉婉,许璐,董宪喆,等.开心散类方对慢性应激大鼠行为学及中枢单胺类神经递质的影响[J].中国中药杂志,2015,40(11):2180-2185.
[7] Willner P. Animal models as simulations of depression[J]. Trends Pharmacol Sci, 1991, 12(4): 131-136.
[8] 龚琳,邱彦,刘静,等.知母总皂苷对血管性抑郁小鼠行为和脑组织病理学的影响[J].中国药物应用与监测,2017,14(2):88-92.
[9] Coppen A, Shaw DM, Malleson A. Changes in 5-hydroxytryptophan metabolism in depression[J]. Br J Psychiaty, 1965, 111(470): 105-107.
[10] 胡楚璇,林壮民,全佳,等.阿魏酸钠对慢性不可预知温和刺激抑郁症大鼠抑郁行为的影响及其机制[J].中国医院药学杂志,2017,37(17):1697-1701.
[11] Herken H, Gurel A, Selek S,et al. Adenosine deaminase, nitric oxide, superoxide dismutase, and xanthine oxidase in patients with major depression: impact of antidepressant treatment[J].Arch Med Res, 2007, 38(2): 247-252.
[12] Maes M, Kubera M, Obuchowiczwa E,et al. Depression's multiple comorbidities explained by (neuro) inflammatoty and oxidative and nitrosative stress pathways[J]. Neuro Endocrinol Lett, 2011, 32(1): 7-24.
[13] 田桂琴,唐佳琦,徐鹏飞,等.丁苯酞对慢性应激大鼠海马组合氧化应激及炎症因子的影响[J].中国药学,2017,15(4):420-423.
[14] Drevets WC, Price JL, Furey ML. Brain structural and functional abnormalities in mood disorders: implications for neurocircuitry models of depression[J]. Brain Struct Funct, 2008, 213(1-2): 93-118.
[15] 吴磊,吴文,曾庆,等.脑卒中后抑郁患者前扣带回、海马灰质体积磁共振成像研究[J].第三军医大学学报,2013,35(23):2577-2581.
[16] Slavich GM, Irwin MR. From stress to inf l ammation and major depressive disorder: a social signal transduction theory of depression[J]. Psychol Bull, 2014, 140(3): 774-815.
[17] Aschbacher K, O'Donovan A, Wolkowitz OM,et al. Good stress,bad stress and oxidative stress: insights from anticipatory cortisol reactivity[J]. Psychoneuroendocrinology, 2013, 38(9): 1698-1708.
[18] Zaf i r A, Banu N. Antioxidant potential of fl uoxetine in comparison to Curcuma longa in restraint-stressed rats[J]. Eur J Pharmacol,2007, 572(1): 23-31.
[19] 王珑,王实涛.抑郁症氧化应激发病机制及针刺治疗研究进展[J].针灸临床杂志,2017,33(11):76-80.

