干扰素-α致大鼠抑郁症模型制备前后血清Th1/Th2细胞因子和甲状腺激素水平的检测
王福 苗光新 徐柏郁 高杨 刘金霞 杨艳杰 郭亚春
(承德医学院,河北 承德 067000)
干扰素(IFN)诱导的抑郁症临床发生比例较高。有学者提出炎症因子可能成为研究抑郁症的发生机制的方向之一〔1〕。本文探讨IFN诱导抑郁症的机制。
1 材料和方法
1.1动物分组 成年SD雄性大鼠30只,体重(200±20)g,由河北医科大学动物中心提供。实验前对每只动物进行体重测量、糖水偏好实验、旷场实验、新环境抑制进食实验。对糖水偏好率低于50%、旷场实验得分值低于30分或高于120分、新环境抑制进食时间得分低于1 min或高于5 min的大鼠予以剔除。随机数字法分为3组,每组10只,慢性不可预知温和应激(CUMS)组大鼠单笼孤独饲养,IFN组和正常组每笼2只饲养。实验过程中,死亡大鼠剔除。
1.2模型制备 CUMS组大鼠采用孤养联合CUMS造模。以7 d为1个周期,每天接受1种刺激,7种不同刺激(禁水24 h;晃尾,1次/s,晃尾15 min;禁食24 h;夹尾1 min,间隔10 min,连续10次;4℃冰水游泳5 min;昼夜颠倒12 h;1 mΑ电击足底10 s,间隔1 min,30次)。循环往复,共进行个12周期,总时长12 w;IFN组给予长效IFN-α,1次/w,18 μg/kg,总时长12 w〔2〕。正常组给予等体积生理盐水皮下注射,总时长同IFN组。
1.3行为学实验
1.3.1体重检测 在造模前、造模后第4、8、12周检测大鼠体重。
1.3.2旷场实验 在造模前、造模后第4、8、12周进行旷场实验。记录动物穿越底面方块数值和直立次数,以水平活动得分和垂直得分总和作为旷场实验总评分,每次测定时间为5 min〔3〕。
1.3.3糖水偏好实验 在造模前、造模后第4、8、12周进行测试,每只大鼠禁水24 h,然后给予1瓶1%蔗糖水和1瓶纯净水各200 ml,24 h后测量糖水和纯净水的消耗量,并计算动物的糖水偏好率,计算公式为糖水偏好率=糖水消耗量/(纯净水消耗量+糖水消耗量)×100%〔4〕。
1.3.4新环境抑制进食实验 在造模前、造模后第4、8、12周分别将禁食24 h后的各组大鼠从任意的角度置于旷场中,中心放置少量食物,统计大鼠进食时间,特别是每只大鼠接近并进食第一口食物的时间〔5〕。
1.4血清Th1/Th2细胞因子检测 在造模后第12周时采集大鼠腹主动脉血,分离血清,-20℃保存备用。采用酶联免疫吸附试验(ELISA)检测血清细胞因子IFN-γ、肿瘤坏死因子(TNF)-α 、白细胞介素(IL)-4 、IL-10 的表达水平。ELISA试剂盒购自北京万域美澜试剂公司。操作严格按试剂盒说明书进行。
1.5血清甲状腺激素水平检测 应用电化学发光法检测造模后第12周时取血液标本,分离血清,检测促甲状腺激素(TSH)、游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、三碘甲状腺原氨酸(T3)、四碘甲状腺氨酸(T4)等指标。
1.6统计学处理 应用SAS8.0统计软件进行t检验。
2 结 果
2.1各组大鼠行为学情况比较 与正常组及同组造模前比较,CUMS组造模后4、8、12 w体重、糖水偏爱性、旷场实验积分均显著降低(P<0.05),进食时间显著延长(P<0.05);与同组造模后4 w比较,CUMS组8、12 w进食时间显著延长,12 w糖水偏爱性显著降低(P<0.05)。IFN组8、12 w体重及糖水偏爱性,4、8、12 w旷场实验积分均显著低于正常组(P<0.05);IFN组8、12 w进食时间显著长于正常组(P<0.05);IFN组12 w体重,8、12 w糖水偏爱性及旷场实验积分均显著低于同组造模前(P<0.05);IFN组8、12 w进食时间显著长于同组造模前(P<0.05);与CUMS组比较,IFN组4 w旷场实验积分显著升高,12 w旷场实验积分显著降低(P<0.05);4、8 w进食时间显著缩短(P<0.05)。与同组4 w比较,IFN组12 w体重,8、12 w糖水偏爱性及旷场实验积分均显著降低(P<0.05);8、12 w进食时间显著延长(P<0.05)。与同组8 w比较,IFN组12 w旷场实验积分显著降低(P<0.05),12 w进食时间显著延长(P<0.05)。正常组8、12 w体重较造模前显著增加,12 w体重较4 w显著增加(P<0.05)。见表1。
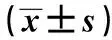
表1 各组大鼠行为学情况比较
与正常组比较:1)P<0.05;与CUMS组比较:2)P<0.05;与同组造模前比较:3)P<0.05;与同组造模后4 w时比较:4)P<0.05;与同组造模后8 w比较:5)P<0.05
2.2各组血清甲状腺激素水平比较 与正常组比较,IFN组血清TSH水平显著升高,FT3和FT4表达水平显著降低(均P<0.05),T3和T4水平变化差异无统计学意义(均P>0.05);CUMS组血清TSH、FT3、FT4和T4差异无统计学意义(均P>0.05)。IFN组与CUMS组比较,只有FT4水平显著降低(P<0.05),其余各指标差异均无统计学意义(均P>0.05),见表2。
2.3各组血清Th1/Th2细胞因子表达水平比较 与正常组比较,IFN组和CUMS组血清Th1类细胞因子IFN-γ和TNF-α的表达水平显著增高,Th2类细胞因子IL-4和IL-10的表达水平显著降低(均P<0.05),IFN组和CUMS组比较差异无统计学意义(P>0.05),见表3。
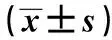
表2 各组血清甲状腺激素水平比较
与正常组比较:1)P<0.05;与CUMS组比较:2)P<0.05
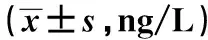
表3 各组血清Th1/Th2细胞因子表达水平比较
与正常组比较:1)P<0.05
3 讨 论
抑郁症发病机制假说包括单胺类递质摄入减少假说、神经内分泌异常假说、遗传易感性假说和炎性因子失衡假说。4种假说之间存在密切联系。神经内分泌与免疫系统是一个双向调节的网络。细胞因子、神经递质、激素等是系统间相互交流的化学信息分子。细胞因子可能通过调节单胺类神经递质代谢、影响神经内分泌功能等参与抑郁症发病过程〔6〕。Th1和Th2细胞因子诱导的免疫反应处于动态平衡状态,相互抑制、相互调节,维持机体正常的细胞免疫和体液免疫功能。IFN-γ和TNF-α主要由Th1 细胞产生,主要介导细胞免疫,上调甲状腺滤泡细胞主要组织相容抗原大分子的表达,促进甲状腺内淋巴细胞浸润,并使浸润的淋巴细胞和巨噬细胞激活并释放TNF-α、IL-1、IL-6等细胞因子及产生氧自由基,从而造成甲状腺组织的破坏,导致甲状腺功能减低,而甲状腺激素在生长发育、物质代谢、情绪调整等方面也发挥积极调控作用;IL-4主要产生于Th2细胞,可促进免疫球蛋白(Ig)G2、IgA 和IgE等抗体的产生,介导体液免疫〔7〕。此外,Th1和Th2平衡被打破后,促炎因子IFN-γ、IL-1、IL-6、TNF-α等表达水平升高,作用于KP通路的第一个限速酶,即炎症诱导酶吲哚胺 2,3双加氧酶(IDO),将底物色氨酸催化生成犬尿酸,减少单胺类神经递质5-羟色胺(HT)的形成,而且犬尿酸易透过脑屏障,其本身也对机体的情绪、情感等发挥负相调节作用〔8,9〕。因此,炎性因子、神经内分泌和单胺类递质等在抑郁症形成过程中彼此互相促进、互为因果。在抑郁症发生机制的研究和抗抑郁药物研发过程中,有可能成为理论依据和指导方向。

