基于金纳米簇检测碘单质的荧光分析方法研究
曹雪玲,张东杰,李 鑫,任重远,连丽丽
(1.吉林化工学院 化学与制药工程学院,吉林 吉林 132002;2.中国石油吉林石化公司,吉林 吉林 132000)
碘可以直接或间接参与生命活动,对人体的新陈代谢和成长起着重要作用[1]。任何必需的元素,过量或不足均将对人体产生影响,特别是微量元素对生命活动的影响更为显著。人们主要从饮水、粮食、蔬菜和环境(如海水、人工降雨等)中获取碘,而饮用水中的碘含量反映了一个地区碘营养的基本指标。若碘的摄入量不足会导致碘缺乏病,引起智力发育不良,并导致潜在的地方性甲状腺肿或地方性克汀病等疾病[2-3],但若碘摄入量超过生理需求,也会影响人体健康。
目前,检测碘含量的方法包括比色法[4]、电泳法[6]、电化学法[5]、离子色谱法[7]、色谱法[8]等。然而这些方法在检测过程中存在检测范围窄、检出限高、操作条件苛刻或检测成本过高等缺点。为克服上述不足,许多荧光探针被用于碘的检测[9-10],其中蛋白质保护的金纳米簇具有生物兼容性、水溶性及光学性能优异等特点,作为荧光探针得到了广泛应用[11-13]。例如:基于碘可以诱导金纳米簇的荧光增强,谷胱甘肽保护的金纳米簇被用作荧光探针检测碘[14],检出限为400 nmol/L。文献[15]利用组氨酸保护金纳米簇检测碘,方法的检测范围宽,灵敏度良好。本课题组利用蛋白质保护的金纳米簇作为荧光探针建立了碘单质的检测方法,但未对金纳米簇与碘的作用机理做明确解释[16]。
本文利用牛血清白蛋白保护的金纳米簇(AuNCs@BSA)为荧光探针,高灵敏地检测了碘单质,并利用Stern-Volmer方程进行了热力学计算,对碘与金纳米簇的作用机理进行了详细研究。
1 实验部分
1.1 仪器与试剂
荧光光谱仪RF-5301pc型(日本岛津公司);FLS980稳态/瞬态荧光光谱仪(英国爱丁堡仪器公司);Bruker Vertex 80 V傅立叶变换红外光谱仪(FT-IR,布鲁克公司);62A DS圆二色谱仪(美国Aviv公司);UV-3100光谱仪(日本Shimadzu公司)。
牛血清白蛋白(Bovine serum albumin,BSA)购于Sigma-Aldrich公司。氯金酸(HAuCl4·3H2O)购于北京化学试剂公司。G-75凝胶购于 Sigma-Aldrich 公司,其他化学试剂均为分析纯。
1.2 仪器条件
荧光发射光谱:氙灯为激发光源,激发波长为350 nm,扫描范围为550~750 nm,狭缝为5 nm×5 nm。圆二色谱采用0.1 cm光程的石英池,扫描波长为190~260 nm,所有数据扫描3次。傅立叶变换红外光谱仪:配MCT-B 液氮冷却检测器。溴化钾压片,光谱采集范围:400~4 000 cm-1。
1.3 金纳米簇制备
基于文献方法制备金纳米簇[17-18]:在37 ℃下,取5 mL 50 mg/mL的 BSA恒温10 min,加入5 mL 10 mmol/L HAuCl4,磁力搅拌2 min后,再加入0.5 mL 1 mol/L的NaOH溶液,然后将此反应液在微波反应器中于37 ℃下反应12 h。制备的金纳米簇粗产品用分子量为 8 000~14 000 Da的透析袋透析24 h;未反应的BSA用 G-75凝胶分子筛柱去除;将金纳米簇冷冻干燥为粉末,备用。

图1 金纳米簇的荧光光谱图Fig.1 Fluorescence emission spectra of the prepared AuNCs@BSAinsert:the lifetime of the prepared AuNCs@BSA
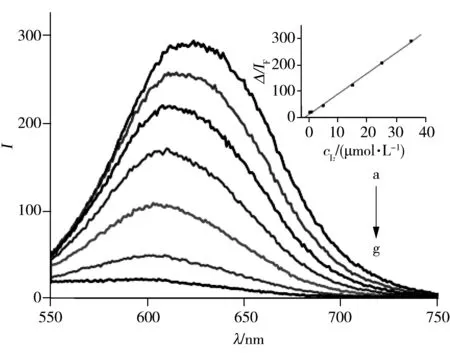
图2 金纳米簇中加入不同浓度碘的荧光猝灭图Fig.2 Emission spectra of AuNCs@BSA(0.5 g·L-1) in the presence of different concentrations of iodineinsert:relationship between ΔIF and concentration of iodine;concentration(a-g):0,0.5,1,5,15,25,35 μmol/L
2 结果与讨论
2.1 金纳米簇检测碘单质的方法建立
2.1.1金纳米簇的表征在激发波长350 nm,发射波长610 nm下,AuNCs@BSA的荧光光谱图见图1,与文献制备的含有16个金的AuNCs@BSA基本一致。图1插图为AuNCs@BSA的荧光寿命图,拟合计算得到其荧光寿命约为11 μs,与Hu等[19]制备的AuNCs@BSA的荧光寿命(11 μs)一致。综上所述,本文制备的产物为金纳米簇。
2.1.2分析方法的建立由碘单质对金纳米簇的荧光猝灭图(图2)可知,AuNCs@BSA在610 nm有较强的荧光发射峰,因碘单质可在较宽的pH值范围内引起金纳米簇的荧光发射峰猝灭。本实验选择在pH 8.3(制备金纳米簇后的pH值)条件下加入碘溶液。实验结果显示,AuNCs@BSA的荧光猝灭现象随着碘溶液加入量的增加而增强,当碘加入量达到35 μmol/L时,AuNCs@BSA的荧光基本完全猝灭,且最大发射峰的峰位蓝移至590 nm,此时AuNCs@BSA的荧光峰位置及强度均发生很大改变,推测AuNCs@BSA内金核的微环境发生了较大变化,碘与AuNCs@BSA之间存在强的相互作用[20]。
以AuNCs@BSA加入碘前后的荧光强度(ΔIF=IF0-IF)与碘浓度进行线性回归,结果表明ΔIF与碘浓度(c)在2.0 nmol/L~35 μmol/L范围内线性关系良好,线性方程为ΔIF=7.840c+10.937,相关系数r=0.997 7(见图2插图)。逐级稀释AuNCs@BSA使其信噪比为3,加入不同浓度的碘,绘制荧光强度与浓度之间的关系曲线,计算得到检出限为1.8 nmol/L。

表1 实际样品中碘含量的测定结果Table 1 Determined results of iodine in real samples
2.2 实际样品中碘含量的测定
我国规定居民饮用水中碘含量应在10 μg/L,若饮用水中的碘含量小于5 μg/L,则会出现地方性甲状腺肿病,而含量超过150 μg/L时也会威胁人体健康[21]。实验选择饮用水为实际样品,水样经浓缩处理后,采用升华的方法使碘离子转化为碘单质,进行检测。分别利用此方法和ICP-MS[21]检测了样品中的总碘含量,结果见表1。由表1可见,利用本方法检测的碘含量与ICP-MS检测结果差别不大,说明本方法可应用于实际样品的检测。

图3 干扰离子对金纳米簇的干扰试验Fig.3 Influence of the fluorescence emission intensity with different interference ions in AuNCs@BSA
2.3 干扰试验
2.4 作用机理研究
2.4.1热力学参数计算荧光猝灭是荧光物质与溶剂或溶质分子之间发生荧光强度降低的过程,实质是发光过程相互竞争从而缩短发光分子激发态寿命的过程。荧光猝灭作用可分为静态猝灭和动态猝灭。动态猝灭是猝灭剂与荧光剂的激发态能量转移或电荷转移而导致;而静态猝灭则是猝灭剂与荧光剂基态之间相互作用所致[22]。为阐明碘单质与AuNCs@BSA的荧光猝灭机理,用Stern-Volmer方程对碘单质与AuNCs@BSA浓度依赖的变温数据进行分析:
IF0/IF=1+Kqτ0[Q]=1+KSV[Q]
(1)

图4 金纳米簇与碘的Stern-Volmer曲线Fig.4 Stern-Volmer curves under different temperatures of AuNCs@BSA with I2
式(1)中IF0和IF分别为加入猝灭剂前后AuNCs@BSA的荧光强度,KSV为动态猝灭常数,Kq为猝灭过程速率常数,[Q]为猝灭剂的浓度,τ0为荧光剂分子平均寿命,由图1B可知AuNCs@BSA荧光寿命约为11 μs。以IF0/IF对[Q]作图,并计算出不同温度下的Kq和KSV。由图4可知,在298、308、318 K的温度下IF0/IF与[Q]呈良好的线性关系。表2结果表明,KSV随温度的升高而减小,KSV均小于2.0×1010L/mol·s。由于2.0×1010L/mol·s为生物大分子的最大扩散碰撞猝灭常数,大于此值定义为静态猝灭,而小于此值定义为动态猝灭[22],因此,可确定本文碘单质诱导AuNCs@BSA荧光猝灭为动态猝灭过程。
基于修正的Stern-Volmer方程(2),利用IF0/(IF0-IF)与[Q]作图,其中Ka为有效猝灭常数,fa为接近猝灭体的分数。实验结果表明,IF0/(IF0-IF)与[Q]呈良好的线性关系,且Ka值随着温度升高而逐渐减小,这与KSV的变化趋势一致,进一步证明碘单质引起的AuNCs@BSA荧光猝灭是动态猝灭过程。由式(2)计算出不同温度下的有效猝灭常数Ka,带入式(3)和(4),R为气体常数,分别计算热力学参数ΔH、ΔS和ΔG(表3),发现ΔH>0且ΔS>0,表明碘与AuNCs@BSA之间的相互作用属于疏水作用[23-24]。

表2 不同温度下金纳米簇与碘的KSV和KqTable 2 Stern-Volmer quenching constants(KSV )and the quenching rate constants(Kq )of I2 binding to AuNCs@BSA at various temperatures
表3 金纳米簇与碘在不同温度下的热力参数Table 3 Thermodynamic parameters for I2 binding to AuNCs@BSA at different temperatures
IF0/(IF0-IF)=1/(fa·Ka·[Q])+1/fa
(2)
lgKa=-ΔH/(2.303RT)+ΔS/(2.303R)
(3)
ΔG=ΔH-TΔS
(4)
2.4.2荧光响应机理研究据文献[25]报道,AuNCs@BSA中的金核与BSA通过Au—S相结合,金纳米簇中的配体蛋白质结构对AuNCs@BSA荧光变化起到关键作用,如果配体蛋白质的二级结构发生变化,会导致AuNCs@BSA的荧光光谱变化。所以本文推测碘单质引起AuNCs@BSA荧光发射峰的猝灭,主要原因在于碘的加入使配位的BSA构象发生变化,测定了BSA及加入碘前后AuNCs@BSA的红外光谱图,发现合成的AuNCs@BSA及加入碘的红外光谱中只有微小的变化(图5A),不利于分析蛋白质二级结构的变化。图5B分别为配体BSA、AuNCs@BSA及加入碘后的AuNCs@BSA的圆二色谱图,由图可知配体BSA的圆二色谱图中有 222、210 nm两个负峰,两峰均为α-螺旋结构的特征峰。BSA与金核通过Au—S结合后,其在222 nm处的峰强度较BSA的峰强度弱,使得210 nm处的峰移至208 nm,表明α-螺旋的含量减少,而无规卷曲的结构增多,说明已形成金纳米簇,这与之前的报道相符[26]。而碘加入到AuNCs@BSA中后,222 nm的峰强度较AuNCs@BSA进一步变弱,说明α-螺旋的结构继续减少,而无规卷曲的含量增多。综上所述,碘的加入影响了配体BSA的蛋白质二级结构,这可能是引起AuNCs@BSA荧光猝灭的重要原因,详细的机理有待于继续研究。

3 结 论
本文以AuNCs@BSA为荧光探针,建立了碘单质的检测方法,并应用于实际样品中碘单质的检测。详细探讨了其荧光猝灭机制,并利用Stern-Volmer方程计算和分析荧光数据。荧光猝灭速率常数值说明碘单质引起AuNCs@BSA的荧光发射峰猝灭属于动态猝灭过程,热力学参数计算结果表明碘与AuNCs@BSA之间主要是疏水作用。结合圆二色谱及红外光谱图的结果,认为碘与配体BSA产生相互作用,引起了BSA的二级结构变化,从而诱导AuNCs@BSA的荧光光谱猝灭。
参考文献:
[1] Pan Y,Zhang X G,Li Y.WaterRes.,2016,88(1):60-68.
[2] Hye J K,Na K K,Hyeong K P.Eur.J.Nutr.,2017,56(3):965-971.
[3] Huang H,Zhu J.Biosens.Bioelectron.,2009,25(4):927-930.
[4] Jung E,Kim S,Kim Y,Seo S H,Lee S S,Han M S,Lee S.Angew.Chem.Int.Ed.,2011,50(19):4486-4487.
[5] Ito K,Ichihara T,Zhuo H,Kumamoto K,Timerbaev A R,Hirokawa T.Anal.Chim.Acta,2003,497(1/2):67-74.
[6] Fujiwara T,Mohammadzai H,Inoue H,Kumamaru T.Analyst,2000,125:759-763.
[7] Bichsel Y,Von Gumten U.Anal.Chem.,1999,71(1):34-38.
[8] Hu W,Yang P J,Hasebe K,Haddad P R,Tanaka K.J.Chromatogr.A,2002,956(1/2):103-107.
[9] Chen Y M,Cheng T L,Tseng W L.Analyst,2009,134(10):2106-2112.
[10] Wei S C,Hsu P H,Lee Y F,Lin Y W,Huang C C.ACSAppl.Mater.Int.,2012,4(5):2652-2658.
[11] Yan X,Li H,Hu T,Su X.Biosens.Bioelectron.,2017,91(15):232-237.
[12] Wang L L,Qiao J,Qi L,Xu X,Li D.Sci.Chin.Chem.,2015,58(9):1508-1514.
[13] Liu J M,Chen J T,Yan X P.Anal.Chem.,2013,85(6):3238-3245.
[14] Wang M,Wu Z K,Yang J,Wang G Z,Wang H Z,Cai W P.Nanoscale,2012,4(14):4087-4090.
[15] Wang Y F,Zhu H Y,Yang X M,Dou Y,Liu Z D.Analyst,2013,138(7):2085-2089.
[16] Cao X L,Luo Y N,Lian L L,Wu Y Q,Lou D W.Chem.Lett.,2015,44:1392-1394.
[17] Xie J P,Zheng Y G,Ying J Y.J.Am.Chem.Soc.,2009,131(3):888-889.
[18] Yue Y,Liu T Y,Li H W,Liu Z Y,Wu Y Q.Nanoscale,2012,4(7):2251-2254.
[19] Hu D H,Sheng Z H,Gong P,Zhang P F,Cai L T.Analyst,2010,135(6):1411-1416.
[20] Lee K Y,Kim D W,Heo J,Kim J S,Yang J K,Cheong G W,Han S W.Bull.KoreanChem.Soc.,2006,27(12):2081-2083.
[21] Mo X M,Liang X X,Chen Y M,Peng Z Y,Du E Q.Chin.J.HealthLab.Technol.(莫曦明,梁旭霞,陈砚朦,彭寨玉,杜二青.中国卫生检验杂志),2006,16(10):1179-1180.
[22] Lakowicz J R.PrinciplesofFluorescenceSpectroscopy.2nd.New York:Plenum Press,1999:237.
[23] Jiang C Q,Gao M X,Meng X Z.Spectrochim.ActaA,2003,59(7):1605-1610.
[24] Ross D P,Subramanian S.Biochemistry,1981,20(11):3096-3102.
[25] Zhang M,Dang Y Q,Li H W,Wu Y Q,Li Q,Wang K,Zou B.J.Phys.Chem.C,2013,117(1):639-647.
[26] Estey T,Kang J C,Schwendeman S P,Carpenter J F.J.Pharm.Sci.,2006,95(7):1626-1639.

